橘皮黄酮提取的响应面优化及抗氧化活性研究*
王 芳, 淡小艳
(浙江师范大学化学与生命科学学院,浙江金华 321004)
柑橘是我国的主要水果之一,其产量居世界前列.橘皮约占柑橘质量的20% ~40%,除含有精油、果胶、色素、柠檬苦素外,还含有丰富的黄酮类物质[1-2].大量研究证实了黄酮类物质具有降血压、防止动脉硬化、清除自由基、抗突变、抗氧化、抗真菌、抗衰老和抗肿瘤等多种作用[3-8],具有很高的药用价值.已鉴定出来大约60余种黄酮类化合物存在于柑橘中,其主要成分是黄烷酮、黄酮、黄酮醇等,它们大多以糖苷的形式存在[9-10].目前,大部分橘皮被作为垃圾丢弃.开发橘皮黄酮,既能提高柑橘的经济效益,又能减缓橘皮废弃带来的环境污染[11-12],具有广阔的市场前景.
近年来,对橘皮黄酮的研究报道逐渐增多,在提取工艺方面主要集中在加热回流提取法、微波提取法和超声波提取法等[13].加热回流提取法会因长时间加热而导致黄酮结构破坏;微波提取法和超声波提取法涉及设备昂贵、操作技术要求较高等因素,仍停留于实验室研究阶段.而溶剂提取法具有设备简单、成本低、产量大的优势,可广泛用于工业化生产.目前,对黄酮提取的超声波和微波辅助提取的响应面法优化的报道较多[13],而对浸提法的响应面研究尚少见报道.本文运用响应面法优化了橘皮黄酮的提取工艺,用AB-8型大孔吸附树脂为色谱柱填充料对橘皮黄酮提取物进行了纯化,并对橘皮黄酮的抗氧化活性进行了考察,旨在为橘皮的进一步开发利用提供依据.
1 材料与方法
1.1 材料与仪器
供试柑橘购自浙江省金华市农贸市场.实验所用芦丁、1,1-二苯基-2-三硝基苯肼(DPPH)、牛血清蛋白购自Sigama公司.AB-8型大孔吸附树脂购自上海鼎国生物技术有限公司.其他试剂均为分析纯.
料理机(九阳股份有限公司),DZF-9140B型真空干燥箱(上海一恒科学仪器有限公司),BT224s型电子天平(德国赛多利斯公司),旋转蒸发仪R-1001(郑州长城科工贸有限公司),柱色谱装置,UV1000紫外可见光光度计(上海天美科学仪器有限公司),SC-5A超级恒温槽(宁波海曙亿恒仪器有限公司).
1.2 响应面实验设计
根据Box-Behnken中心组合实验设计原理,结合单因素实验结果,分别选择料液比(X1)、提取温度(X2)和提取时间(X3)作为自变量,橘皮黄酮得率作为响应值设计响应面实验,因素和水平取值见表1.

表1 响应面法实验设计因素和水平
1.3 黄酮含量测定
对照文献[6,14].标准曲线的制作:称取芦丁20 mg,用10%乙醇溶液定容至25 mL,备用.取 7 支具塞试管,分别加入 0,0.5,1.0,1.5,2.0,2.5,3.0 mL芦丁标准溶液,用30%乙醇溶液补足体积至5 mL,混匀,各加入0.3 mL 50 g/L NaNO2溶液,混匀,静置 5 min,加 0.3 mL 100 g/L Al(NO3)3溶液,混匀后静置 6 min,加入 4 mL 1 mol/L NaOH溶液,再加入0.4 mL 30%乙醇溶液使总体积为 10 mL,混匀后静置 10 min,用UV1000紫外-可见分光光度计在510 nm处测量吸光度.以吸光度(A)为横坐标,芦丁质量浓度(ρ芦丁)为纵坐标绘制工作曲线.用最小二乘法作线性回归,得芦丁浓度Y与吸光度值x的关系曲线,回归方程为:Y=0.768x-0.001 2,相关系数R2=0.999 9.
同法测定样品液中黄酮的含量为

其中:X是1 mL提取液中总黄酮的质量(mg);Vt是提取液总体积(mL);Vs是测定用样品液体积(mL);W是总质量.
1.4 蛋白质含量测定
参照文献[15].考马斯亮蓝G250溶液的配置:称取100 mg考马斯亮蓝G250溶解于50 mL 90%乙醇溶液中,加入850 g/L磷酸溶液100 mL,用蒸馏水定容到1 000 mL,摇匀,放冰箱中备用.
标准曲线的制作:5 mg牛血清蛋白溶于100 mL水中,配成0.05 mg/mL牛血清蛋白溶液,分别取 0.4,0.8,1.2,1.6,2.0 mL 于 10 mL 具塞试管中,加水补足2 mL,然后加入5 mL考马斯亮蓝G250溶液,倒转振荡,放置2 min,用 UV1000紫外-可见分光光度计在595 nm处测量吸光度.以吸光度(A)为横坐标,牛血清蛋白质量浓度(ρ蛋白)为纵坐标绘制标准曲线.用最小二乘法作线性回归,得牛血清蛋白溶液浓度Y与吸光度值x关系曲线的回归方程为:Y=0.153 7x-0.004 1,相关系数 R2=0.992.
样品中蛋白质含量测定同标准曲线的制作,根据所得吸光度计算蛋白质的含量.
1.5 橘皮黄酮纯化
大孔树脂的处理:选用AB-8型大孔吸附树脂对橘皮黄酮提取物进行纯化.树脂于95%乙醇溶液中浸泡26 h,用蒸馏水洗至无乙醇味为止,装柱于2 cm×20 cm玻璃柱中.分别用100 mL 5%和2%的HCl溶液以2 mL/min的流速冲洗100 min,用蒸馏水以同样流速冲洗至pH呈中性.
纯化工艺[16]:将样品用蒸馏水溶解,上样浓度为100 mg/mL,上样体积为5 mL.将上样液缓慢加入色谱柱中,用蒸馏水洗5 min,使样品充分分布在色谱柱中,静止10 min,用100 mL蒸馏水以2 mL/min的流速洗脱杂质,再用100 mL 20%乙醇溶液以同样流速洗脱杂质,最后用100 mL 95%乙醇溶液洗脱黄酮,用旋转蒸发仪以65℃恒温水浴进行减压蒸馏,回收乙醇,得黄褐色膏状物质,真空干燥至恒重,测黄酮和蛋白质的含量.
1.6 橘皮黄酮抗氧化活性测定
1.6.1 对DPPH自由基的清除能力
参照文献[16],精密称取 12.0 mg DPPH,用无水乙醇定容于250 mL容量瓶中,现配现用.取待测样品溶液2 mL,加入2 mL 0.2 mmol/L DPPH溶液,混匀,放置30 min,在517 nm处测其吸光度(Ai);以溶剂为参比,于517 nm处测定吸光度中:Ac为2 mL溶剂加2 mL DPPH溶液的吸光度;Ai为2 mL待测液加2 mL DPPH溶液的吸光度;Aj为2 mL待测液加2 mL溶剂的吸光度.
1.6.2 对羟自由基的清除能力
参照文献[17].在10 mL试管中依次加入2.5 mmol/L FeSO4溶液2 mL、不同浓度的黄酮溶液2 mL 和2.5 mmol/L H2O2溶液2 mL,摇匀,静置10 min,再加入2.5 mmol/L水杨酸溶液2 mL,摇匀静置30 min后于510 nm处测其吸光度.清照;Ai为某质量浓度黄酮溶液的吸光度;Aj为无水杨酸时黄酮溶液的吸光度.
2 结果与分析
2.1 橘皮黄酮提取的单因子实验
2.1.1 提取溶剂的选择
分别称取干燥的柑橘皮粉0.5 g,按料液比为1 ∶30加入0%,20%,40%,60%,80%,95%的乙醇溶液,常温下浸提2 h,比较不同的含醇量对橘皮黄酮得率的影响.实验结果(见图1)表明,随着溶剂中乙醇含量的增大,橘皮黄酮的提取率降低,在乙醇含量为0(蒸馏水)时黄酮的提取效果最好,黄酮得率达到6.996 mg/g,可能是橘皮中的水溶性黄酮含量较高[18]所致.橘皮中的黄酮大多以糖苷的形式存在,糖苷的糖链越长,其水溶性越大[13].考虑到蒸馏水比乙醇健康、安全、生产成本低,因此选择蒸馏水作为橘皮中黄酮类物质的提取溶剂.
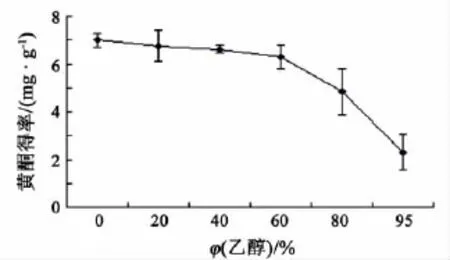
图1 溶剂含醇量对橘皮黄酮得率的影响
2.1.2 料液比的影响

图2 料液比对橘皮黄酮得率的影响
分别称取0.5 g柑橘皮粉,各加入蒸馏水10,15,20,25,30 和35 mL,在常温下浸提2 h,考查不同料液比对橘皮黄酮得率的影响.由图2可知:当料液比从1∶20改变到1∶40时,橘皮总黄酮的得率增加,因为溶剂用量的增加有利于黄酮向细胞外扩散[19];当料液比为1∶40时,黄酮得率达到最大值11.211 mg/g;料液比为1 ∶40之后,黄酮得率趋于平稳.考虑到:太大的液料比不利于样品的干燥,且会造成生产成本增加;料液比为1∶30时黄酮得率达到10.729 mg/g,且料液比为1∶30和1∶40的黄酮提取率经SPSS 16.0软件的显著性分析,结果是无显著性差异,所以综合考虑选择1∶30的料液比.
2.1.3 温度的影响
分别称取0.5 g柑橘皮粉,按照1∶30的料液比加入蒸馏水,分别在20,40,60,80和100℃浸提2 h,比较不同提取温度对橘皮黄酮得率的影响.在提取温度为0~80℃时,黄酮提取率随温度升高而逐渐增大,在提取温度为80~100℃时提取率急剧增加,提取温度为100℃时提取率达到最大值10.200 mg/g(见图3).温度升高在物质交换过程中有利于物质的溶解分配[1],因而有利于黄酮在水中的溶解.综合选择100℃为橘皮黄酮的最优浸提温度.

图3 提取温度对橘皮黄酮得率的影响
2.1.4 提取时间的影响
分别称取0.5 g柑橘皮粉,按照1∶30料液比加入蒸馏水,在100 ℃分别浸提 1,2,3,4,5和6 h,研究不同提取时间对橘皮黄酮得率的影响.实验结果(见图4)表明:提取时间在1~4 h内橘皮黄酮的提取率增加,其原因在于提取时间的延长有利于黄酮的充分溶出;当提取时间为4 h时,黄酮得率达到最大值9.403 mg/g;而4 h后,随着提取时间的延长,橘皮黄酮的提取率有所下降,因为提取时间太长会导致部分对热不稳定的黄酮被分解[19],从而使总黄酮的提取率下降.经过SPSS 16.0软件的分析,提取时间为3 h和4 h无显著性差异,为2 h和4 h则有显著性差异.提取时间的增加会导致其他杂质溶出量的增加,并且生产周期会延长,且长时间的高温会破坏黄酮的结构,所以综合考虑选择3 h为适宜的提取时间.
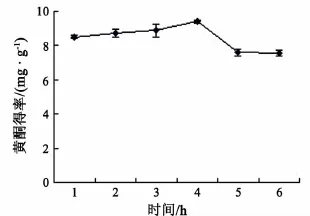
图4 提取时间对橘皮黄酮得率的影响
2.2 橘皮黄酮提取工艺的响应面法优化
2.2.1 响应面法实验设计及结果
在单因子实验的基础上,根据Box-Behnken中心组合设计原理,设计了3因素3水平的响应面分析实验,以料液比(X1)、提取温度(X2)和提取时间(X3)为自变量,以橘皮黄酮的得率作为响应值,实验设计及结果见表2.
2.2.2 响应面及等高线分析
用Design Expert 8.0软件对表2数据进行回归拟合,得到二次回归方程响应面图(见图5~图7).
图5~图7可以直观地反映各因素对响应值的影响.比较3幅图可知:料液比和提取温度的交互作用对黄酮得率的影响较为显著,表现为曲线较陡;而提取时间和料液比及提取时间和提取温度的交互作用次之,表现为曲线较为平滑.
2.2.3 响应面法优化结果分析
根据表2的实验数据,利用Design Expert 8.0软件对数据进行回归分析,拟合后得到X1,X2和X3的二次多项回归模型:橘皮黄酮得率=9.48+0.80X1+0.54X2+0.12X3+1.02X1X2-0.51X12-0.37X22+0.47X3
2.
对优化后的回归模型进行方差分析,结果见表3.该模型是极显著的(P=0.007 8),其中料液比和提取温度对提取液中橘皮黄酮含量的影响较大,提取时间对提取液中黄酮含量的影响较小.方差分析中一次项X1和X2对模型的影响显著,X1和X2的交互项对模型的影响也达到极显著.对回归模型取一阶偏导数等于零,可以得到曲面的最大点.对模型进行手动优化,由原来3个交互项手动改为只增加X1X2交互项,优化后的结果为:料液比为1 ∶37.84(g/mL),提取温度为99.15℃,提取时间为2.04 h.考虑到实际操作,则取料液比为1∶38(g/mL),提取温度为99℃,提取时间为2 h,此条件下橘皮黄酮的得率可达11.028 mg/g.优化后实验条件下的响应面3D效果图见图8.

表2 响应面法设计方案与实验结果

图5 料液比和提取温度的交互作用

图7 提取温度和提取时间的交互作用

图6 料液比和提取时间的交互作用
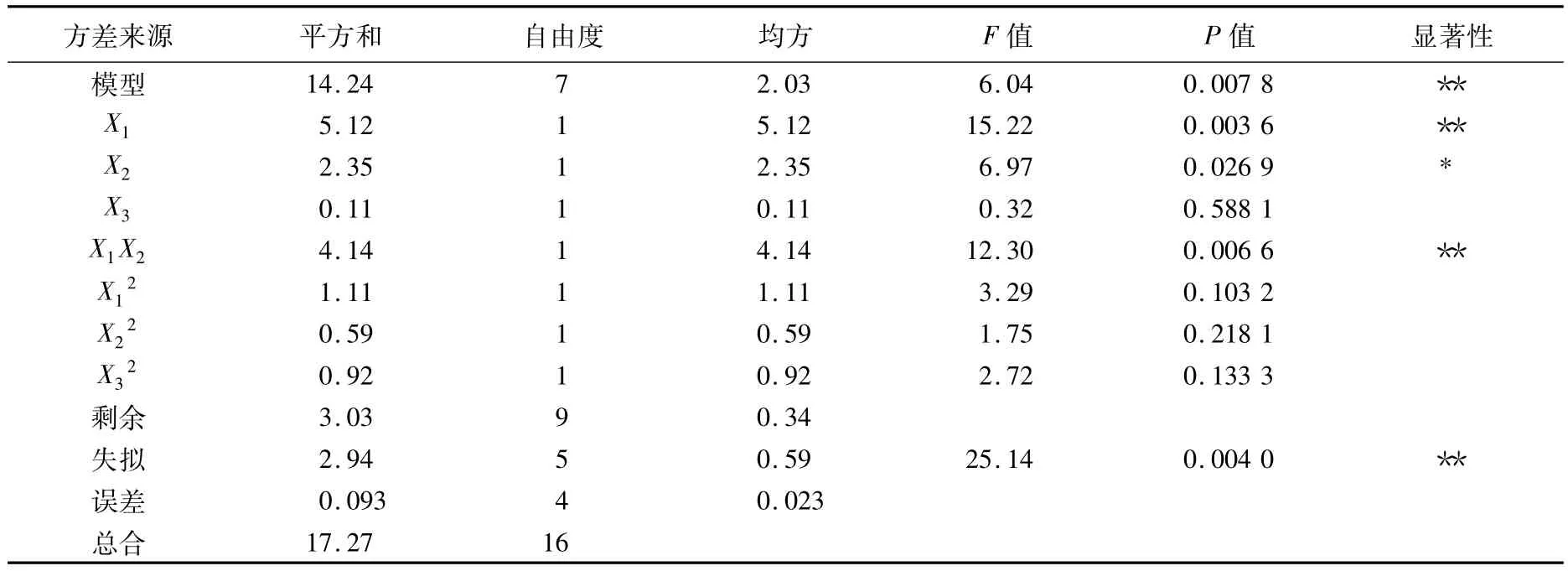
表3 优化后回归模型的方差分析

图8 优化条件下的交互作用图
2.3 橘皮黄酮提取物中黄酮和蛋白质的含量
用AB-8型大孔吸附树脂对所得橘皮黄酮提取物进行纯化,95%乙醇洗脱后浓缩干燥,得黄酮浸膏.将柱色谱前后所得黄酮浸膏均用水配制为10 mg/mL的溶液,测定纯化前后浸膏中的黄酮含量和蛋白质含量.
由图9和图10可以看出,AB-8大孔吸附树脂对橘皮黄酮粗提物的纯化效果明显,纯化前后提取物中黄酮含量由8.431 mg/g升高到40.748 mg/g,增加了 383.312%;蛋白质含量由 3.791 mg/g 降低到1.908 mg/g,降低了 49.670%.
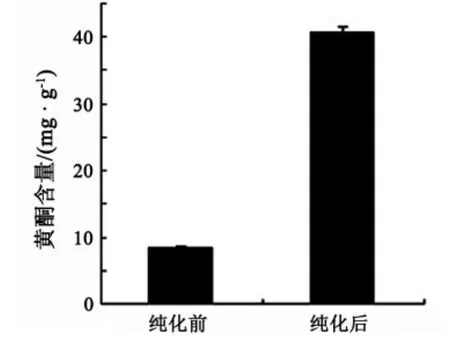
图9 纯化前后提取物中黄酮含量
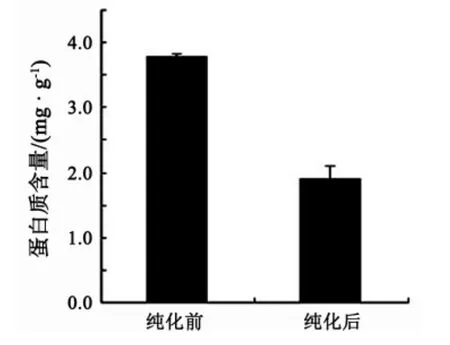
图10 纯化前后提取物中蛋白质含量
2.4 橘皮黄酮的抗氧化活性
2.4.1 对DPPH自由基的清除能力
图11显示了纯化前后不同浓度的橘皮黄酮对DPPH自由基的清除能力,可以看出,橘皮黄酮对DPPH自由基的清除能力在一定范围与样品浓度呈剂量效应关系,当样品浓度为4 mg/mL时,其对DPPH的清除率接近100%.经过IC50计算小软件计算得出,纯化前橘皮黄酮对DPPH自由基的IC50为0.498 mg/mL,纯化后橘皮黄酮对DPPH自由基的IC50为0.019 mg/mL,即清除能力较纯化前提高了96.185%.
2.4.2 对羟自由基的清除能力
图12显示了纯化前后不同浓度的橘皮黄酮对羟自由基的清除能力,可以看出,橘皮黄酮对羟自由基的清除能力在一定范围与样品浓度也呈剂量效应关系,当浓度为4 mg/mL时,纯化后的样品对羟自由基的清除率接近100%.经过IC50计算小软件计算得出,纯化前橘皮黄酮对羟自由基的IC50为1.597 mg/mL,纯化后对羟自由基的 IC50为0.557 mg/mL,较纯化前提高了65.122%.

图11 橘皮黄酮对DPPH自由基的清除能力
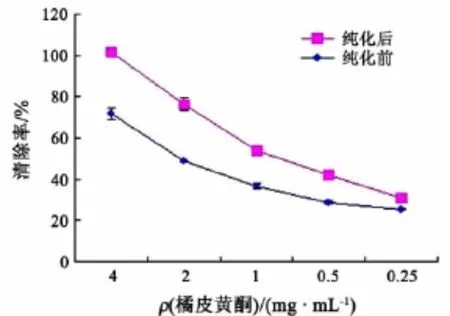
图12 橘皮黄酮对羟自由基的清除能力
3 结论
橘皮黄酮类化合物提取的最佳工艺条件是:溶剂为蒸馏水,料液比为1∶38(g/mL),提取温度为99℃,提取时间为2 h.该条件下橘皮黄酮的得率可达到11.028 mg/g.
AB-8型大孔吸附树脂对橘皮黄酮类化合物的纯化效果明显,纯化后橘皮黄酮的纯度提高了383.312%,同时黄酮类化合物的抗氧化活性大大提高.
橘皮黄酮有明显的抗氧化作用,且有剂量效应关系,尤其是经过纯化工艺后的黄酮类化合物,其抗氧化效果显著增加,对DPPH自由基和羟自由基的清除能力分别提高了 96.185%和65.122%,可以作为理想的天然抗氧化剂使用,具有广阔的开发应用前景.
[1]麻明友,刘建本,吴显明.超声微波双辅助提取柑橘皮总黄酮的研究[J].食品科学,2010,31(20):266-269.
[2]张玉,曾凡坤,吴剑.响应面法优化柑橘皮渣中类黄酮的超声波提取工艺[J].食品科学,2010,31(8):28-32.
[3]吴琼英,贾俊强.柚皮黄酮的超声辅助提取及其抗氧化性研究[J].食品科学,2009,30(2):29-33.
[4]Yi Zhibiao,Yu Yan,Liang Yizeng,et al.In vitro antioxidant and antimicrobial activities of the extract of pericarpium citri reticulatae of a new citrus cultivar and its main flavonoids[J].LWT-Food Science and Technology,2008,41(4):597-603.
[5]周小理,王青,杨延利.苦荞萌发物中生物活性黄酮对人乳腺癌细胞增殖的抑制作用[J].食品科学,2011,32(1):225-228.
[6]Londoño-Londoño J,De Lima V R,Lara O,et al.Clean recovery of antioxidant flavonoids from citrus peel:Optimizing an aqueous ultrasound-assisted extraction method[J].Food Chemistry,2010,119(1):81-87.
[7]Paula M,Céliz G,Geronazzo H,et al.Antifungal activity of natural and enzymatically-modified flavonoids isolated from citrus species[J].Food Chemistry,2011,124(4):1411-1415.
[8]Chen H J,Chung C P,Chiang W,et al.Anti-inflammatory effects and chemical study of a flavonoid-enriched fraction from adlay bran[J].Food Chemistry,2011,126(4):1741-1748.
[9]中华人民共和国卫生部药典委员会.中华人民共和国药典:一部[M].2010版.北京:人民卫生出版社,2010.
[10]宋小妹,唐志书.中药化学成分提取分离与制备[M].北京:人民卫生出版社,2004.
[11]Sun Yujing,Liu Donghong,Chen Jianchu,et al.Effects of different factors of ultrasound treatment on the extraction yield of the all-trans-β-carotene from citrus peels[J].Ultrasonics Sonochemistry,2011,18(1):243-249.
[12]陈学丽,叶立斌,励建荣.杨梅渣黄酮类化合物提取及其抗氧化活性研究[J].食品工业科技,2011,32(2):85-91.
[13]吴雅琼.柑橘皮黄酮提取、纯化和抗氧化性研究[D].杨凌:西北农林科技大学,2008.
[14]Wang Y,Chuang Y,Hsu H.The flavonoid,carotenoid and pectin content in peels of citrus cultivated in Taiwan[J].Food Chemistry,2008,106(1):227-284.
[15]王芳,励建荣,蒋跃明.桑叶黄酮的提取纯化及对油脂抗氧化活性的研究[J].中国粮油学报,2006,21(4):107-111.
[16]吴琼英,贾俊强.柚皮黄酮的超声辅助提取及其抗氧化性研究[J].食品科学,2009,30(2):29-33.
[17]杨方美,王林,胡秋辉.鼠尾藻多糖的制备及其抗氧化活性[J].食品科学,2005,26(2):224-227.
[18]张久春,赵哲勋.柑橘皮水溶性黄酮的稳定性研究[J].食品与发酵工业,2004,30(11):36-38.
[19]伏劲松,王博,蔡光华.香柏总黄酮的提取工艺优化[J].食品科学,2011,32(2):5-8.

