猪细小病毒和猪圆环病毒2 型多重PCR检测方法的建立与应用
樊振华,王娟萍,孟 帆,吴 忻,刘文俊,米瑞娟,姚敬明,程海龙
(1.山西省农业科学院畜牧兽医研究所,山西太原030032;2.太谷县畜牧中心,山西太谷030800)
猪圆环病毒2 型(PCV2)、猪细小病毒(PPV)是导致猪繁殖障碍病的主要病原体。其中,猪圆环病毒(PCV)是1974 年德国学者发现的新病毒[1],1982 年命名为猪圆环病毒。PCV 有PCV1和PCV2 这2 种血清型。PCV2 具有较强的致病性,其经鼻、口腔侵入不同日龄的猪体内,在扁桃体局部淋巴结增殖后,向其他淋巴组织、肺、肝、肾传播,怀孕母猪感染后,经胎盘垂直感染给仔猪,初产母猪和新猪群产生繁殖障碍;PCV2 可引起断奶仔猪多系统衰竭综合征(PMWS)以及增生性坏死性肺炎、皮炎和肾病综合征、仔猪先天性震颤,该病多发生于5~12 周龄的仔猪。猪群患病率3%~50%,死亡率8%~35%,该病发展缓慢,猪群一次发病可持续12~18 个月。
猪细小病毒(PPV)于1967 年首次报道[1-2]。母猪初产或首次感染者会发生流产、死胎,仔猪大量死亡,育成猪发生皮炎、腹泻、关节炎,猪场一旦感染,3 个月内100%感染,会造成80%~100%死亡,感染猪很长时间带毒、排毒。这2 种疾病在临床上呈现出相似的症状,又常常发生混合感染,使临床诊断非常困难,必须依靠实验室检测技术进行鉴别诊断[3]。
以往的血清学诊断准确率低,病毒分离诊断方法虽然准确,但操作复杂,费时、费力。多重PCR 技术是在同一PCR 体系中加入多对引物,对多个目的基因同时进行扩增的分子生物学诊断方法,具有快速、敏感、特异、易于操作的优点,可用一个样品同时检测多种病原体或多个基因型,达到对多种疾病的同步诊断,进而缩短检测时间,减少试剂消耗。王宏魁等[4]曾建立了检测PCV2 和PCV1 的多重PCR 方法,周海范等[5]曾建立了检测PRRSV,PCV2 的多重PCR 方法。
本试验利用多重PCR 技术对PPV 和PCV2进行了检测研究,建立同时快速鉴别诊断这2 种病毒的方法,并应用于临床实践中,初步查明了山西这2 种猪病毒的感染情况。
1 材料和方法
1.1 病毒株、组织病料、阳性对照
猪细小病毒株(PPV)、猪圆环病毒2 型毒株(PCV2)由军事医学科学院军事兽医研究所提供,2 种病毒PCR 阳性对照由北京世纪元亨动物疫病防疫技术有限公司提供,临床组织病料是山西省农科院畜牧兽医研究所动物基础医学研究课题组从疑似病猪体内采集。
1.2 主要试剂和引物
1.2.1 试剂 TaKaRa Ex Taq Taq DNA 聚合酶、DNA Marker DL 2 000 等试剂购自宝生物工程(大连)有限公司,病毒DNA 抽提试剂盒、PPV 和PCV2 病毒单项PCR 诊断试剂盒购自北京世纪元亨动物疫病防疫技术有限公司。
1.2.2 引物设计与合成 通过计算机网站(http://www.ncbi.nlm.nih.gov/)查找出PPV,PCV2 的基因序列,利用Primer Premier 5.0 软件按照引物设计原则,最后选择PPV 的VP2 基因、PCV2 的ORF2 基因为其扩增靶序列[6],借助计算机筛选设计出符合多重PCR 要求的2 对引物,引物由宝生物工程(大连)有限公司合成(表1)。

表1 多重PCR 引物
1.3 试验方法
1.3.1 病毒模板DNA 的提取
1.3.1.1 病料采集与处理 取病、死猪有明显病变与健康部交界处的淋巴结、扁桃体、脾脏、肺、肝、肾等组织,-70 ℃保存。
1.3.1.2 病毒模板DNA 的提取(按总DNA 抽提试剂盒操作步骤进行) (1)称取待检病料0.1 g置组织研磨器中剪碎并研磨,加入1.5 mL PBS(pH 值7.2)继续研磨成匀浆后,8 000 r/min 离心5 min,取其上清液100 μL,加入500 μL 消化液、10 μL 蛋白酶K 混匀,置55 ℃水浴中过夜。病毒细胞液、血清、阳性对照液、阴性对照液(灭菌去离子水)可直接取100 μL,加入500 μL 消化液、10 μL 蛋白酶K 混匀,置于室温下10 min。(2)从水浴锅中取出样品,加入酚300 μL(用前不要晃动,不要吸到上层保护液)、氯仿/异戊醇混合液(24/1)300 μL,颠倒10 次,12 000 r/min 离心10 min。(3)取500 μL 上清液置于灭菌离心管中,加入500 μL 异丙醇混匀,置液氮中3 min 或-70 ℃冰箱中30 min。取出样品管,室温下融化,13 000 r/min 离心15 min。(4)弃上清,倒扣在卫生纸上吸干(1 min),沿管壁缓缓加入1 mL 75%乙醇(冻存),13 000 r/min 离心15 min。(5)弃上清,倒扣在吸水纸上吸干(1 min),再将离心管开口置50 ℃恒温金属浴中15 min 或真空抽干15 min(以无乙醇为准)。(6)取出样品管,用30 μL 灭菌去离子水溶解沉淀,模板-20 ℃保存备用。
1.3.2 单相PCR 检测方法的建立 分析测定PCR 反应最适条件,包括退火温度、引物浓度、MgCl2浓度等因素[7],首先确定每种病毒单相PCR反应最佳条件。
1.3.3 多重PCR 检测方法的建立 在单相PCR的基础上,进行多重PCR 试验,其反应总体积、各引物和试剂的剂量不变,各模板比例按等剂量加入,减少灭菌双蒸水的用量,扩增条件统一以退火温度较低的循环参数为准,试验结果较好[8]。
1.3.4 PCR 检测敏感性试验 将提取的2 种病毒DNA 模板,用Gene Quant Ⅱ核酸定量仪测定其含量,然后将2 种病毒模板分别进行10 倍系列稀释,各取1 μL,按照优化的PCR 反应条件进行PCR 检测,以其模板最高稀释倍数扩增呈阳性为其PCR 的敏感度。
1.3.5 PCR 特异性试验 将病料作DNA 提取后,用多重PCR 检测方法,扩增体系中加入2 种被检测病毒的引物与DNA 模板,同时设猪瘟病毒(CSFV)、猪流感病毒(SIV)及阴性对照,按以上条件进行相同的PCR 扩增。
1.3.6 PCR 产物检测 采用1.5 g/L 琼脂糖凝胶,PCR 产物15 μL,与上样缓冲液3 μL 混合加样,用TAE 电泳缓冲液,电压5 V/cm,单相PCR电泳30 min;多重PCR 电泳40 min,紫外凝胶成像系统中观察结果并拍照、记录。
1.3.7 自然感染病料的检测 用建立的多重PCR 方法,与北京世纪元亨动物疫病防疫技术有限公司提供的2 种病毒PCR 检测试剂盒,对采集的82 份病料进行2 种病毒的单相PCR 检测与多重PCR 检测对比试验,以多重PCR 检测阳性数与单相PCR 检测阳性数之比为其二者的阳性符合率。
1.3.8 临床样品检测应用试验 从10 个发病猪场和门诊病例的病猪无菌采血样,分离血清于1.5 mL 离心管中-70 ℃保存备用。剖检病死猪取有明显病变与健康部交界处的淋巴结、扁桃体、脾脏、肺、肝、肾等组织,-70 ℃保存。共收集血样和病料211 份。
2 结果与分析
2.1 单相PCR 检测扩增结果
按照2 种病毒单相PCR 优化后的反应条件,分别进行PCR 扩增,结果如图1、图2 所示。


2.2 多重PCR 反应条件的优化结果
多重PCR 反应条件为总体积20 μL:MgCl2(150 μmol/L)2 μL,dNTP(2.5 mmol/L)2 μL,10×PCR Buffer 2 μL,2 种病毒的上下游引物混合液各2 μL(每条引物浓度10 pmol/mL),2 种病毒模板各2 μL,Taq 酶(0.5 U/μL)2 μL,灭菌双蒸水4 μL。
多重PCR 的扩增条件:94 ℃3 min;94 ℃30 s,55 ℃30 s,72 ℃30 s,循环35 次;72 ℃延伸7 min。
2.3 PCR 敏感性试验结果
测定出所用模板的DNA 含量是:PPV 为16 ng/μL,PCV2 为19 ng/μL;10 倍稀释2 种病毒模板后,分别进行100~10-5的单相PCR 与多重PCR 扩增,结果如表2 和图3 所示。

表2 PCR 敏感性结果
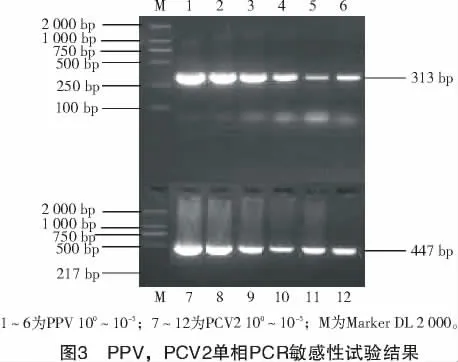
由表2 可知,多重PCR 比单项PCR 病毒的最低核酸检测量降低了约100.5~102个数量级,但仍然具有很强的敏感性,达到了pg(微微克,10-12g)级别,表明建立的多重PCR 反应具有很高的敏感性。
2.4 多重PCR 特异性试验结果
经过一次扩增,可检测出多重PCR 相应病毒的特异条带,目的基因全部扩出,CSFV,SIV,阴性对照全部为阴性,而且无交叉反应。多重PCR重复性及特异性与单相PCR 结果完全一致。
2.5 多重PCR 对自然感染病料的检测结果
单相PCR 与多重PCR 的阳性符合率平均为100%,建立的多重PCR 检测方法具有良好的特异性和重复性,诊断条带清晰、无交叉反应,在临床诊断中准确率可达98%以上,可用于临床诊断。
PPV+PCV2 mPCR 扩增结果如图4 所示。

2.6 临床样品检测结果
211 份样品中检出猪圆环病毒2 型(PCV2)阳性56 份,阳性率为27%;猪细小病毒病(PPV)阳性42 份,阳性率为20%;二者混合感染17 份,阳性率为8%(图5 和表3)。

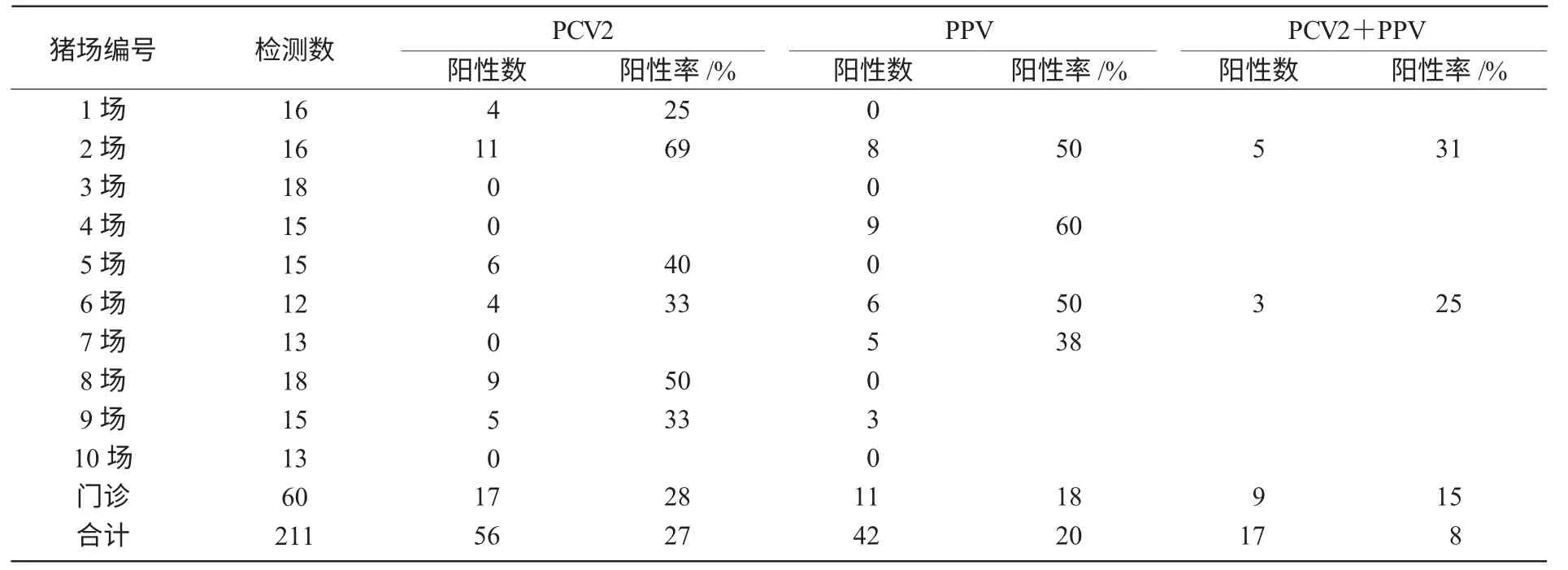
表3 多重PCR 检测PPV,PCV2 病原结果
3 结论与讨论
(1)在建立多重PCR 体系中,引物的设计是关键,经分析PPV,PCV2 基因组信息后,在单相PCR 引物的基础上,设计出了适于多重PCR 的2 对引物。利用2 对特异性引物,在一次PCR 中扩增出猪细小病毒(313 bp)、猪圆环病毒2 型(447 bp)的特异性片断,成功地建立了PPV,PCV2 的多重PCR 检测方法,试验证实了该方法特异性强、敏感性高和重复性好,可节省40%的检测成本和时间,适用于临床鉴定猪细小病毒和圆环病毒2 型,为鉴定这2 种猪病毒提供了一种准确、快速的技术手段。
(2)应用山西省农科院畜牧兽医研究所动物基础医学研究课题组建立的多重PCR 检测技术,在211 份样品中检测出猪圆环病毒2 型阳性56 份,感染率为27%;猪细小病毒阳性42 份,感染率为20%;二者混合感染阳性17 份,混合感染率为8%。证明山西猪群已比较严重地感染了这2 种疫病,今后应加强防疫免疫等综合措施。
(3)在我国,PCV2 和PPV 造成的猪繁殖障碍最为普遍和严重,特别是这2 种病原常混合感染;病毒既可水平传播,又可垂直传播;可以引起70%以上的初产母猪发生流产、产死胎、弱仔,仔猪死亡,免疫抑制等危害,造成巨大的经济损失。现在猪细小病毒和圆环病毒2 型疫苗已经在生产中广泛应用,通过大家不懈的努力,一定能够有效地控制这2 种病毒的流行。
[1]Barbara E Straw,Syilvie D’Allaire.猪病学[M].赵德明,张仲秋,沈建忠,译.8 版.北京:中国农业大学出版社,2003.
[2]殷震.动物病毒学[M].北京:科技出版社,1985:810-814.
[3]王泽洲,于勇,吴越,等.猪生殖障碍疾病的研究概况[J].中国兽医科技,2007,37(9):823-826.
[4]王宏魁,彭志锋,孙彦婷,等.猪圆环病毒复合PCR 检测方法的建立及应用[J].河南农业科学,2009(1):109-111.
[5]周海范.猪繁殖与呼吸综合征、猪圆环病复合PCR 诊断方法的建立及应用[J].河南农业科学,2007(1):106-109.
[6]孙明,李卫红,高显明,等.应用多联PCR 对引发猪繁殖障碍有关病毒的检测1.JEV,PPV,PRRSV,PRV 多联PCR 引物设计[J].中国兽医学报,2000,20(1):10-14.
[7]Joseph Sambrook,David W Russell.分子克隆实验指南[M].黄培堂,译.3 版.北京:科学出版社,2005:698-699.
[8]赵丽,崔宝安.猪伪狂犬病病毒及猪细小病毒复合PCR 检测方法的建立[J].华北农学报,2009,24(2):206-209.

