低植酸玉米育种的研究概况
徐秀红,郭国锦,吕桂华,卢华兵
(浙江省东阳玉米研究所,浙江 东阳 322100)
植酸,又名肌醇六磷酸,是成熟作物种子中含磷最丰富的化合物,占种子干重的1%以上,总磷含量的65% ~85%[1]。是种子萌发和幼苗生长所需肌醇和磷酸等营养成分的贮藏库,是玉米籽粒中广泛存在的一种有机酸 (肌醇六磷酸)。植酸可与Zn2+、Fe3+、Ca2+等金属阳离子螯合形成植酸盐,难以被人和非反刍动物 (猪、鸡、鱼等)消化利用,降低了磷元素以及与之结合的微量金属元素、蛋白质和淀粉的生物有效性,尤其在发展中国家植酸是造成微量营养元素缺乏的主要原因,被认为是一种抗营养因子[2]。鳌合形成的植酸盐因为不能被吸收利用,随着粪便排出体外,进入水体后造成水体富营养化,继而引起水体环境污染。另外,土壤中因为缺乏分解微生物,难以分解这些植酸盐,即使畜禽粪便作为有机肥还田,也难以被农作物吸收利用;大量磷肥的使用,也造成了不可再生磷资源的浪费,人类将会面临磷矿短缺的局面。
培育低植酸作物,能够降低植酸抗营养性,提高微量元素营养成分的生物有效性,可减少磷对环境的污染和动物饲料中磷元素的添加,这些已成为育种学家、营养学家和环境学家关注的焦点之一[3]。因此,作物低植酸种质的创新和品种选育近年来已成为育种家们研究的热点,并先后在玉米、大麦、水稻、小麦、大豆等作物中创造出低植酸突变体。本文综述了迄今为止玉米低植酸突变种质创新、突变体植酸含量变化、农艺性状及种子特性、突变的遗传学研究方面的研究进展,并对低植酸玉米的研究前景进行展望。
1 低植酸玉米突变体的选育
低植酸作物的选育开始于1992年,主要是应用化学诱变剂 (叠氮化钠,EMS)或γ-射线诱变。低植酸玉米最早是Raboy等[4]在1996年采用EMS化学诱变剂对玉米花粉进行诱变,育成了2份玉米低植酸突变体lpa1-1和lpa2-1,植酸含量分别下降66%和30%。Pilu等[5]通过 EMS诱导玉米花粉,育成了一份低植酸玉米突变体lpa241,其植酸下降90%。随后,Shi等[6-8]利用转座子插入和基因沉默的方式育成了3份玉米低植酸突变体lpa2、lpa3和lpa1,植酸分别下降30%、50%和93%。在国内,低植酸玉米研究稍晚,2006年浙江大学核农所王雪艳等[9]开始了玉米低植酸突变体的初步筛选,获得了6个低植酸突变体,植酸下降幅度在43.94%~79.09%。中国农科院于2007年9月10日宣布了转植酸酶基因玉米的问世,并在2009年获得了农业部颁发的转基因生物安全证书,成为我国首例获得安全证书的粮食作物。之后,刘欣芳等[10-11]也开展对转植酸酶基因玉米的获得及其后代的初步鉴定。
目前,选育低植酸玉米的主要方法是:用EMS处理玉米花粉或者γ-射线处理干种子,M1代自交获得M2代种子,混收;M2按单株种植,套袋授粉自交,按株收获种子,形成株系。每株系取成熟的8粒M3种子,按Chen等测定无机磷 (Pi)含量的方法进行无机磷检测,如果检测到1粒以上呈高无机磷 (HIP)种子的单株,此单株将被认为是可能的突变株,8粒全部呈HIP的单株视为可能的纯合低植酸突变体,继续种植检测,若还为纯合,则可确认为低植酸突变体。研究表明,低植酸突变体的植酸含量下降都伴随着无机磷含量的成倍增加[8],且正常玉米中无机磷的含量很低,在0.3~0.5 mg·g-1,因此,筛选低植酸突变体可以通过种子的无机磷检测来间接选择[12]。
2 低植酸玉米突变体的植酸含量及其他成分含量的变化
玉米种子中植酸含量在8.3~22.2 mg·g-1,占种子干重的0.69%~1.14%,占种子全磷量的75%~80%,植酸主要的沉积部位是盾片层(胚),占90%,只有10%在糊粉层[13-14]。玉米种子中植酸的含量一般受品种、种子成熟度、栽培地点及土壤气候条件等影响,主要由品种的遗传特性和环境条件决定的[12]。
有关研究表明,玉米低植酸突变体植酸含量的降幅达30% ~93%。最早Raboy等发现的lpa1-1和lpa2-1 2个突变体植酸的降幅分别为66%和50%,lpa1-1在植酸下降的同时,其无机磷含量同等比例升高,但肌醇和低价肌醇磷酸盐中间物没有积累;lpa2-1植酸含量下降伴随无机磷的升高,五价或更低价的肌醇磷酸盐含量上升,野生型中却未积累相关的成分。与野生型相比,以上2种低植酸突变体的总磷含量都保持不变[2,4]。Pilu 等[5]发现的lpa241突变体,其与lpa1-1等位,但植酸的降幅为90%。Shi等[7]发现一个低植酸突变体,与lpa1和lpa2不等位,命名为lpa3,其植酸的降幅是50%,其植酸含量下降的同时,无机磷和肌醇含量显著增加,未积累低价肌醇磷酸盐中间物,总磷含量也保持不变。Shi等发现的另外2个突变体,按照其他成分含量的变化,分别归类于lpa2和lpa1。
迄今为止,发现的玉米低植酸突变体多数总磷含量基本不变,在正常的环境条件下均能自然发芽,是非致死型突变体,但Larson等[5,15]在低植酸玉米研究中发现了一类突变体,其在正常的栽培环境条件下纯合的突变体种子不能发芽,低植酸性状只能通过杂合的株加以保留;Pilu等[5]在玉米低植酸的研究中共筛选到29份低植酸突变体,发现有28份是致死型的,其中18份可能由于胚特异性致死,另外的10份可能由于胚乳引起。
3 玉米低植酸突变体的农艺性状及种子特性变化
植酸在种子的萌发和植物的生长发育过程中起着重要作用,因此,研究所发现的绝大多数玉米低植酸突变体随着植酸含量的下降,一些农艺性状和种子的品质特性也出现了变化,与对照野生型相比,突变体的发芽率和成苗率降低,种子的干重下降,继而产量下降,抗逆性变差,生育期延迟等。
Raboy等[4]在研究低植酸玉米时发现,与对照相比,lpa1-1杂合型的发芽、茎叶长度、种子成熟时的含水量以及花期等农艺性状都没有显著的差异,但其产量比对照减产8% ~23%,lpa2-1减产4%~16%。大部分低植酸突变体纯合状态下种子具有活力,包括一些植酸含量几乎接近零的突变体,但其产量性状都会变差,植酸含量下降小于75%时,与野生型相比,产量损失一般在5%~15%;当植酸含量下降幅度巨大,达到90%~98%时,突变体的生长发育就会受到严重的影响,甚至会死亡,这些都将导致产量严重下降[2]。Pilu等[5]在研究低植酸玉米突变体lpa241时发现,与对照相比,突变体的发芽率下降了30%,但其生长发育却没有受到显著影响。
此外,还有一些研究表明,转基因技术育成若干玉米低植酸突变体,其在农艺性状和种子的品质特性上与亲本没有显著的区别。运用反向遗传学方法,利用Mu转座子插入和球蛋白的胚特异性启动子构建的基因沉默载体,Shi等[12]获得玉米低植酸突变体lpa3、lpa2和lpa1,突变并没有影响一般田间条件下的种子发芽率,种子干重也没有显著下降。中国农科院范云六等[11]自主研发的转植酸酶基因玉米,是从曲霉属的一种真菌中分离出能产生植酸酶的基因,并把它插入玉米基因组中而获得的,这种转植酸酶基因玉米在种子发芽率、生长速度和产量上都没有受到影响。
4 玉米低植酸突变的遗传学研究
4.1 遗传模式
研究证实,目前所获得的玉米低植酸突变均为隐性突变,共出现3类突变体,分别受1对非等位隐性基因控制,如纯合的lpa1/lpa1和lpa2/lpa2杂交,后代植酸水平正常,说明这2个突变位点互不等位;而Shi等获得的低植酸突变体与lpa1和lpa2杂交后,发现其与这2个突变位点互不等位,定为lpa3。这些突变体的杂合型后代分离比例基本符合,野生型∶杂合型∶低植酸基因型1∶2∶1,野生型∶低植酸型表现型为3∶1的遗传模式。
研究中还发现,有些分离后代中纯合单株的比例低于理论值,即在后代的分离群体中纯合的低植酸植株较少,这可能与其发芽力下降有关系。
4.2 基因定位及克隆
在玉米中,已发现3类纯合低植酸突变体lpa1、lpa2和lpa3,且都位于1S染色体上,其中lpa1-1突变位点与RFLP分子标记umc157相连锁,遗传距离为7.7 cM[4];lpa2-1突变位点则与RFLP分子标记umc167相连锁,遗传距离为10 cM[14]。另一个玉米低植酸突变体 lpa241,与lpa1等位,与RFLP分子标记umc1222相距大约9.2 cM[5]。
在种子的发育过程中,植酸合成途径中任何一步的酶发生突变或植酸的运输途径受阻,就会造成植酸的合成或积累受抑制,引起种子植酸含量的下降,产生低植酸突变体[15]。一个突变体植酸含量的下降,可能是植酸合成的2个底物——肌醇和无机磷的合成或供应受阻导致,也可能是2个底物转化成磷酸盐的过程受阻,还有可能是植酸的运输或者其他基因调控引起。因此,了解植酸的代谢途径(图1),对研究低植酸突变体非常重要,图1中与植酸代谢途径相关的基因已经相继被克隆出来[16]。
迄今为止,作物中发现的低植酸突变基因有很多,大豆中发现的突变基因主要是肌醇磷酸合成酶(MIPS)基因[17-18]和抗药相关蛋白 (MRP)基因[19],拟南芥中发现的主要是肌醇磷酸激酶(AtIPK1和AtIPK2β)基因[20],水稻中发现的有肌醇激酶 (MIK)基因[21]和 MRP 基因[22],大麦中发现的有硫转运蛋白 (HvST)基因[23]。在玉米中目前发现的3个低植酸突变的基因已经被克隆出来,玉米 lpa1突变是由于1个 MRP基因(ZmMRP4)突变导致,它编码一个MRP-ABC(ATP结合盒)转运蛋白,构建基因沉默载体使其沉默后,产生了植酸含量下降无机磷升高的玉米低植酸突变体lpa1;玉米lpa2突变是由于一个肌醇磷酸激酶 (ZmIpk)基因序列的重排导致,在ZmIpk基因的编码序列核苷酸158位置上,DNA序列发生由C到T突变,在开放阅读框的N-末端产生一个终止密码子,仅有34个氨基酸,蛋白翻译终止,促使肌醇磷酸激酶活性下降,多磷酸肌醇的合成减少,突变体的植酸含量下降约30%,无机磷含量增加约3倍,肌醇和肌醇磷酸盐IP3、IP4和IP5得到积累;玉米lpa3突变则是由于MIK基因发生突变引起,它使催化肌醇和磷酸生成肌醇-3-磷酸的步骤受抑,最终导致植酸含量的下降[12]。
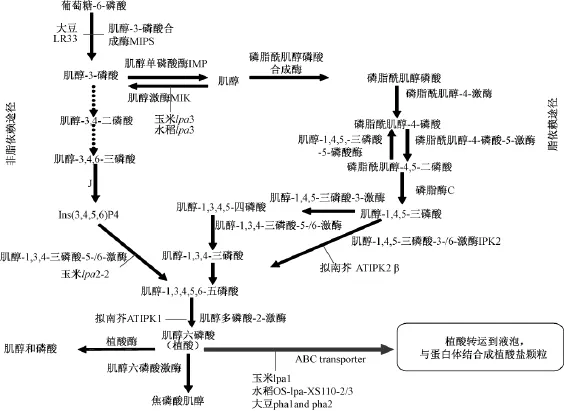
图1 植物体内植酸的代谢途径及引起植酸含量下降的已报道突变基因
5 展望
玉米是粮食、饲料和经济兼用型作物,玉米总产量的75%用于饲料加工,是饲料原料总量的60%。低植酸玉米直接作为饲料,可提高动物对微量金属元素的吸收利用,提高其生物有效性,有效改善微量金属元素缺乏症,同时可减少其粪便中的磷含量,提高磷的利用率,减少环境中的磷污染,达到绿色环保的目的;或以低植酸玉米为原料生产饲料,在生产过程中可不加植酸酶或降低其使用量,从而降低生产成本,增加畜禽对饲料中的钙、铁、锌等金属微量营养元素的吸收和利用,提高其生物有效性。因此,低植酸玉米的研究应用前景广阔。
研究表明,低植酸突变会使农艺性状变差,种子的品质和特性一定程度上变劣,这说明植酸含量的下降与产量的下降呈正相关[24]。产量性状的下降表明,直接利用低植酸突变体育种存在一定难度,但对产量影响较小的突变也可用于育种,选择不同的低植酸突变基因可减少农艺性状变差和种子品质变劣[25]。另外,还可以通过多次回交、杂交等改良低植酸品种的产量性状。此外,研究结果表明,大多数转基因玉米其农艺性状和种子特性没有受到影响,这也给低植酸玉米育种带来新手段。随着低植酸玉米育种技术的不断成熟,具有营养和环境双重功能的低植酸玉米杂交种的选育将为改善动物和人类的营养、减少环境污染等作出巨大贡献。
[1] Raboy V.Accumulation and storage of phosphate and minerals[G] //Larkins B A,Vasil I K.Cellular and Molecular Biology of Plant Seed Development. Dordrecht,the Netherlands:Kluwer Academic Publishers,1997:441-477.
[2] Raboy V.Seeds for a better future:“low phytate”grains help to overcome malnutrition and reduce pollution [J].Trends in Plant Sci,2001,6(10):458-462.
[3] Lott J N A,Ockenden I,Raboy V,et al.Phytic acid and phosphorus in crop seeds and fruits:a global estimate [J].Seed Sci Res,2000,10:11-33.
[4] Raboy V,Gerbasi P F,Young K A,et al.Origin and seed phenotype of maize low phytic acid 1-1 and low phtic acid 2-1 [J].Plant Physiol,2000,124:355-368.
[5] Pilu R,Panzeri D,Gavazzi G,et al.Phenotypic,genetic and molecular characterization of a maize low phytic acid mutant(lpa 241)[J].Theor Appl Genet,2003,107:980-987.
[6] Shi J R,Wang H Y,Wu Y S,et al.The maize low-phytic acid mutant lpa2 is caused by mutation in an inositol phosphate kinase gene [J].Plant Physiol,2003,131:507-515.
[7] Shi J R,Wang H Y,Hazebroek J,et al.The maize lowphytic acid 3 encodes a myo-insitol kinase that plays a role in phytic acid biosynthesis in developing seeds [J].T Plant J,2005,42:708-719.
[8] Shi J R,Wang H Y,Schellin K,et al.Embryo-specific silencing of a transporter reduces phytic acid content of maize and soybean seeds [J]. NatBiotechnol, 2007, 25:930-937.
[9] 王雪艳,王忠华,梅淑芳,等.高无机磷低植酸玉米突变体筛选初报[J].核农学报,2006,20(1):15-18.
[10] 刘欣芳,高晓蓉,苏乔,等.转植酸酶基因玉米的获得及其后代的初步鉴定 [J].玉米科学,2008,16(1):15-19.
[11] 张琪,陈茹梅,杨文竹,等.组成型表达转植酸酶基因(phyA2)玉米的获得[J].农业生物技术学报,2010,18(4):623-639.
[12] 徐秀红.一个植酸代谢相关水稻基因的定位、克隆与特性研究[D].杭州:浙江大学,2009.
[13] Raboy V.Low-phytic-acid grains [J].Food Nutr Bull,2000,21:423-427.
[14] Larson S R,Raboy V.Linkage mapping of maize and barley myo-inositol1 - phosphate synthase DNA sequences:correspondence with a low phytic acid mutation [J].Theor Appl Genet,1999,99:27-36.
[15] RaboyV.The ABCsoflow-phytate crops [J].Nat Biotechnol,2007,25:874-5.
[16] Raboy V.Forward Genetics Studies of Seed Phytic Acid [J].Israel Journal of Plant Sciences,2008,55:171-181.
[17] Hitz W D,Carlson T J,Kerr P S,et al.Biochemical and molecular characterization of a mutation that confers a decreased raffinosaccharide and phytic acid phenotype on soybean seeds[J].Plant Physiol,2002,128:650 –660.
[18] Yuan F J,Zhao H J,Ren X L,et al.Generation and characterization of two novel low phytate mutations in soybean(Glycine max L.Merr) [J].Theor Appl Genet,2007,115:945-957.
[19] Gillman J D,Pantalone V R,Bilyeu K.The low phytic acid phenotype in soybean line CX1834 is due to mutations in two homologs of the maize low phytic acid gene [J].Plant Genome,2009,2:179-190.
[20] Stevenson-Paulik J, BastidasR J, Chiou S T, etal.Generation ofphytate-free seeds in Arabidopsis through disruption of inositol polyphosphate kinases[J].Proc Natl Acad Sci USA,2005,102:12612–12617.
[21] Kim S I,Andaya C B,Newman J W,et al.Isolation and characterization of a low phytic acid rice mutant reveals a mutation in the rice orthologue of maize MIK [J].Theor Appl Genet,2008,117:1291-1301.
[22] Xu X H,Zhao H J,Liu Q L,et al.Mutations of the multidrug resistance-associated protein ABC transporter gene 5 result in reduction of phytic acid in rice seeds[J].Theor Appl Genet,2009,119:75-83.
[23] Ye H X,Zhang Z Q,Broughton S,et al.A nonsense mutation in a putative sulphate transporter gene results in low phytic acid in barley [J].Funct Integr Genomics,2011,11:103-110.
[24] Zhao H J,Liu Q L,HW F U,et al.Effect of non-lethal low phytic acid mutations on grain yield and seed viability in rice[J].Field Crops Res,2008,108:206-211.
[25] Yuan F J,Zhu D H,Deng B,et al.Effects of two low phytic acid mutations on seed quality and nutritional traits in soybean[J].Agricultural and Food Chemistry,2009,57(9):3632-3638.

