米良一号猕猴桃遗传转化体系的建立
田宏现 ,苑 平 ,王曼玲 ,刘 艺 ,李 菁 ,夏新界 ,谭晓风
米良一号猕猴桃遗传转化体系的建立
田宏现1,2,苑 平2,王曼玲3,刘 艺2,李 菁2,夏新界3,谭晓风1
(1.中南林业科技大学,湖南 长沙 410004;2.吉首大学,湖南 吉首 416000;3.中国科学院 亚热带农业生态研究所,湖南 长沙 410125)
为建立猕猴桃基因功能研究技术平台并通过生物技术改良猕猴桃, 选用米良一号叶片和茎为外植体,通过优化培养基, 建立了适合转化的高效再生系统,通过农杆菌介导将ACC(1-氨基环丙烷-1-羧酸)氧化酶基因成功转化米良一号,构建了根癌农杆菌介导米良一号遗传转化体系。结果表明,TD培养基为合适的愈伤诱导培养基,诱导率达100%,愈伤经3次继代培养转入分化培养基,分化率为90%。共获得29株潮霉素抗性植株,随机挑选 14株经PCR检测,其中10株检测到ACC氧化酶基因目的条带,阳性植株占71.4%。
猕猴桃;根癌农杆菌;转化体系;组织培养
猕猴桃原产中国,是一种营养价值极高的水果,素有“果中之王”的美誉。它含有多种氨基酸,以及丰富的矿物质、胡萝卜素和多种维生素,对保持人体健康具有重要的作用。维生素C含量比柑桔高5至10倍,是各种水果中营养成份最丰富、最全面的水果。也对多种疾病有着很好的预防和治疗的作用。
米良一号猕猴桃是吉首大学石泽亮教授于20世纪80年代选育出来的美味猕猴桃优良品种,它具有适应性强、果大、结果早、产量高、含糖量高、含维生素C高、较耐贮等优点。目前已推广至15个省市,全国种植面积1.3万hm2。其中湘西自治州约0.5万hm2。猕猴桃生产已成了我国山区广大农民脱贫致富的重要途径[1]。
ACC氧化酶是乙烯生物合成途径的关键酶,它直接催化ACC(1-氨基环丙烷-1-羧酸)转变为乙烯,通过调节它的表达能有效地调节乙烯的合成量,从而达到控制果实成熟时间的目的。
目前国内外对猕猴桃各个品种组织培养的研究已经很充分,但分子方面的研究还不是很多,目前未见关于米良一号根癌农杆菌介导转化的报道[2-3]。以米良一号猕猴桃叶片和茎为外植体,诱导出愈伤。本文通过对诱导、继代、分化、生根培养基的研究建立了米良一号高效再生系统,并从共培养、筛选培养、预分化等步骤建立米良一号根癌农杆菌介导转化体系,为开展米良一号基因组学研究和获得耐贮、高抗性品种奠定基础。
1 材料与方法
1.1 材 料
受体植物材料:选取米良一号优良单株上无病虫害的1年生硬枝和当年生嫩枝及叶片为材料。
菌种和质粒:根癌农杆菌菌株为EHA105,质粒为pCAMBIA1300-163,为中科院亚热带农业生态研究所提供。该质粒T-DNA区结构如图1,其中含有潮霉素磷酸转移酶基因(hpt)。

图1 植物表达载体pCAMBIA1300-163的T-DNA区Fig.1 Schematic representation of the T-DNA region of plasmid pCAMBIA1300-163
培养基:
诱导培养基TD:MS + 10 mg·L-16-BA + 0.2 mg·L-1NAA + 0.2 mg·L-1TDZ + 30 g·L-1蔗糖 +7.5 g·L-1琼脂;
继代培养基Y1:MS + 0.25 mg·L-16-BA + 1 mg·L-1NAA + 30 g·L-1蔗糖 + 7.5 g·L-1琼脂;
共培养基YA:MS + 0.25 mg·L-16-BA + 1 mg·L-1NAA + 30 g·L-1蔗糖 + 0.1 mmol乙酰丁香酮+ 7.5 g·L-1琼脂,pH 5.6;
筛选培养基YS:MS + 0.25 mg·L-16-BA + 1 mg·L-1NAA+500 mg·L-1头胞霉素+400 mg·L-1羧苄青霉素+ 20 mg·L-1潮霉素+ 30 g·L-1蔗糖+ 7.5 g·L-1琼脂,pH 6.0;
预分化培养基ZD3:MS+3.0 mg·L-1ZT+0.5 mg·L-16-BA + 0.05 mg·L-1NAA +30 g·L-1蔗糖+ 400 mg·L-1羧苄青霉素+7.5 g·L-1琼脂,pH 6.0;
分化培养基ZD:MS+1.0 mg·L-1ZT+30 g·L-1蔗糖+ 400 mg·L-1羧苄青霉素+ 7.5 g·L-1琼脂,pH 6.0;
生根培养基YR:1/2MS + 0.7 mg·L-1IBA +0.15 mg·L-16-BA + 15 g·L-1蔗糖+ 7.5 g·L-1琼脂,pH 6.0。
1.2 组织培养
1.2.1 猕猴桃愈伤组织的诱导
挑选供试材料有芽茎段先用洗衣粉洗涤,随后盛于塑料桶中用自来水流水冲洗48 h。接种时先用75%的乙醇表面消毒30 s,无菌水冲洗2~3次,再用0.1%升汞溶液消毒8~10 min,无菌水冲洗5~6次。将灭菌枝条切成0.6~0.8 cm长的茎段外植体,于灭菌滤纸上晾干,然后接种到诱导培养基上,每瓶2节外植体,25 ℃~26 ℃,14 h光照培养,光强1000~1500 lx[1]。
取猕猴桃无菌苗叶片,切成0.5 cm × 0.5 cm大小的叶盘,叶片正面向上于诱导培养基上避光培养,7 d左右可以看到叶脉及叶片边缘处开始膨大,愈伤开始生长。
1.2.2 愈伤组织继代
接种外植体30 d后转入继代培养基继代,每20 d继代1次,连续继代3次,观察愈伤状态。
1.2.3 愈伤组织分化
挑选继代3次的愈伤转入分化培养基,20 d后统计分化率(分化率=能分化出植株的愈伤数/接入愈伤总数×100%)。
1.3 反义表达载体的构建
从猕猴桃中克隆得到ACC氧化酶基因的cDNA片段,测序确定为所需片段后将其反向连入表达载体pCAMBIA1300 + 163当中,得到猕猴桃ACC氧化酶基因的反义表达载体。
1.4 遗传转化
1.4.1 农杆菌与愈伤组织的共培养
EHA105(含pCOsAc1300 + 163质粒)划LB板(加 Kan 50 mg·L-1和 CHL 34 mg·L-1),28 ℃培养2 d后挑单菌落,在LB板(加Kan 50 mg·L-1和CHL 34 mg·L-1)划线至全培养皿,28 ℃过夜培养,用液体共培养基将菌洗下,调OD600=0.6挑选表面干爽结构致密的愈伤组织浸入上述准备好的菌液中,浸泡30 min,每隔5 min摇一次。用灭菌滤纸吸干表面多余菌液。将愈伤转移到固体共培养基,在培养基表面铺一层用液体共培养基浸湿的灭菌滤纸,25 ℃~26 ℃下暗培养3~4 d[4]。
1.4.2 抗性愈伤组织的筛选
3 d后,将共培养的愈伤组织转入灭菌三角瓶,灭菌水冲洗5~6次至液体不浑浊,再用加有500 mg·L-1头胞霉素和400 mg·L-1羧变青霉素的灭菌水浸泡30 min,每隔5 min摇一次。用灭菌滤纸吸干水分,转移到筛选培养基YS中,25 ℃~26 ℃暗培养,20 d后将抗性愈伤转入新的筛选培养基。
1.4.3 抗性愈伤组织的分化
两次筛选后,将抗性愈伤转移至预分化培养基ZD3,置于25 ℃~26 ℃,每天14 h光照培养,光强1000~1500 lx,每20 d更换一次新培养基。当愈伤开始变成红褐色并开始分化出芽时将愈伤转移至分化培养基ZD上。
1.4.4 抗性植株的生根
绿苗长至约3~5 cm,转移到生根培养基YR,置光照培养箱中,条件同预分化。
1.4.5 抗性植株的练苗
挑根多而粗壮的抗性植株,拧松瓶盖于室内炼苗3d后用自来水将幼苗上的培养基冲洗干净,移栽到装有泥土(基质土∶珍珠岩=3∶1)的盆子,置于置物箱中室内练苗2周后打开置物箱室内练苗3 d,移至室外1周左右即可移入实验田中。
1.5 抗性植株的PCR检测
DNA提取:取抗性猕猴桃植株幼嫩叶片0.2~1.0 g,采用CTAB区室法提取基因组DNA。
PCR扩增:扩增产物为575 bp的基因片段。
上 游 引 物 为 Term F:5′ -GGT,GCT,TTC,CCA,GTC,CAA,ATC,GTT-3′。
下 游 引 物 为 Term R:5′ -CCA,GGT,TTA,GTC,GTC,TCG,TGT,CTG,GT-3′。
PCR扩增体系(20 μL):Takara公司TaqDNA聚 合 酶 (5 mmol·μL-1)0.2 μL,10×Buffer (KCl)缓 冲 液 2.0 μL,MgCl21.6 μL,dNTP Mixture 2.0 μL,Term F(20 mmol·μL-1)0.4 μL,Term R(20 mmol·μL-1)0.4 μL,模板 1 μL,ddH2O 12.4 μL。
PCR反应程序为:95 ℃变性5 min后运行下循环,94 ℃ 35 s,59 ℃ 35 s,72 ℃ 45s,共 35 个循环,最后72 ℃ 10 min。取PCR产物10 μL进行常规琼脂糖(1.0%)凝胶电泳分离并照相保存。
2 结果与分析
2.1 诱导培养基对猕猴桃愈伤诱导率的影响
茎段愈伤的诱导可选用Y1或者ZD为诱导培养基,愈伤诱导所需时间比叶片要长,主要是沿切口处开始生长。茎段愈伤结构致密,颜色较深,分化出芽的效率相对较低,而且米良一号内生菌比较多,用茎段诱导愈伤染菌率较高。
叶片诱导培养基选用TD,叶片接到培养基后,7天左右可以看到叶脉及叶片边缘处开始膨大,愈伤开始生长,除去坏死的叶片,猕猴桃叶片愈伤诱导率为100%(图2-A),且在TDZ的培养基上即可直接分化出芽。

图2 米良一号农杆菌介导的遗传转化体系Fig.2 Genetic transformation of Miliang-1 by Agrobacterium-mediated method
2.2 继代培养基对猕猴桃愈伤组织的影响
继代培养基选用Y1,愈伤组织在此培养基都能很好的生长,20 d左右继代一次。愈伤组织在此培养基上继代后,结构致密,颜色翠绿,基本上不会出现褐化,但当继代时间超过30 d时,愈伤结构开始变的疏松,颜色变白,后期分化效率变低。可能是培养基中营养物质基本上消耗完毕而有害物质积累过多造成的,所以20 d左右必须继代一次,继代次数超过3次后,愈伤状态仍然保持很好的活力,基本上没有出现愈伤褐化的现象(图2-B)。
2.3 筛选时潮霉素浓度对米良一号愈伤生长的影响
以Y1为培养基,在其中添加潮霉素用于筛选抗性愈伤,添加头孢霉素和羧变霉素用于抑制农杆菌的生长,将潮霉素浓度设为5个梯度,每个梯度10个皿,每个皿9个愈伤,即每个梯度90个愈伤,19 d后统计结果如表1所示。当潮霉素浓度达到40 mg·L-1时愈伤的存活率只有10%,当浓度为50 mg·L-1时愈伤全部死亡,而将潮霉素浓度降低到20 mg·L-1时愈伤的存活率为43.3%,最终在继代培养基中添加20 mg·L-1的潮霉素用于抗性愈伤的筛选(图2-C)。

表1 潮霉素对愈伤组织生长的影响Table 1 The effect of hygromycin on callus tissue growth
2.4 抗性愈伤的分化
将抗性愈伤接到预分化的培养基ZD3上,在此培养基中将ZT的浓度提至3.0 mg·L-1加速芽的诱导。抗性愈伤刚开始时为白色,在预分化的过程中逐渐变成绿色,当愈伤开始变成红褐色时,开始分化出芽(图2-D)。此时再将愈伤接到分化培养基ZD上,此培养基降低ZT的浓度至1.0 mg·L-1,不影响芽的分化和生长[5-7]。因为有研究证明在植物体内积累过高的ZT将影响后期根的分化[8]。
2.5 生根培养基对猕猴桃抗性植株生根的影响
在实验中,将IBA和6-BA,分别设成不同的浓度,米良一号在5种培养基中均能诱导出根。当IBA的浓度达到1 mg·L-1时,由于生长素浓度过高,芽的底部很容易诱导出愈伤,而且愈伤的生长速度很快,虽然也能长出根来,但由于愈伤过大,根的生长受到严重的抑制,上面的芽的活力也比较低,生长的很慢,甚至还会出现落叶的现象。当在其中添加一定浓度的6-BA时,芽的生长状况明显比没加时要好,但却对根的生根没有任何促进作用。当降低IBA的浓度后,愈伤的生根变慢,但还是有一小块愈伤被诱导出来,根的诱导率有明显的提高。随着IBA浓度的降低,平均每个芽诱导出来根的数目和根的生长速度也相应降低[9-11]。因此最终我们选择1/2 MS + 0.7 mg·L-1IBA + 0.15 mg·L-16-BA为米良一号的生根培养基。将长至3 cm左右的芽接到YR培养基上,20 d左右即可成功诱导出根,米良一号根的诱导比较容易,且根比较粗状,但生根的数量不多,平均每个芽10条根左右(图2-E)。
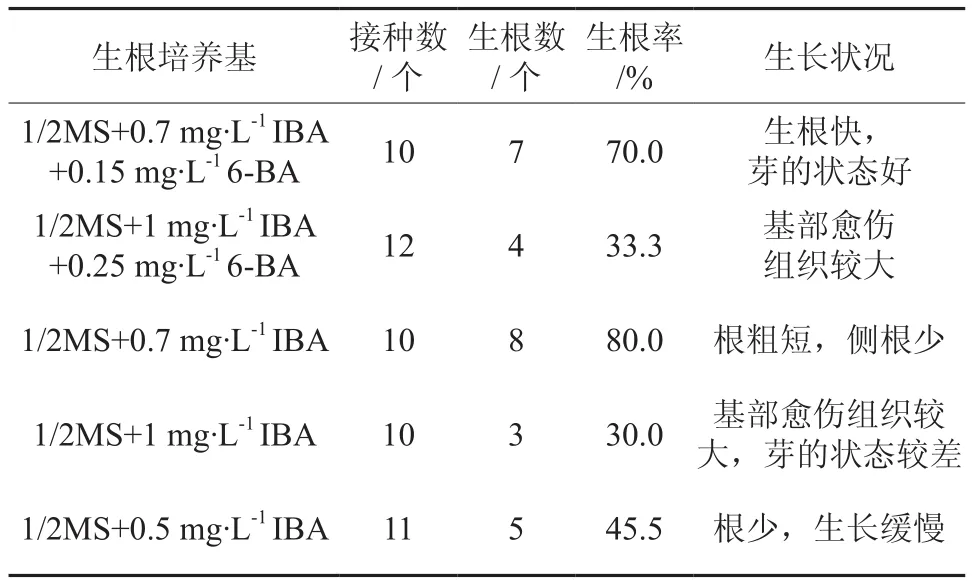
表2 植物生长调节剂对不定芽生根的影响Table 2 The effects of betanaphthoxy acetic acid on rooting
2.6 练 苗
猕猴桃的叶片较大,水份的蒸发量较高,如果直接将组培得到的再生苗种在自然环境中会因为失水而存活率不高。本实验中将米良一号再生苗开盖3 d后,种在小花盆中,先将其放在有盖且透光性较好的置物箱中,以防水份蒸发过快。等其恢复生长后再逐步将其释放到环境中去,存活率可达到90%以上(图2-F)。
2.7 抗性植株的PCR检测
经过转化获得29株潮霉素抗性植株,随机选取其中14株提取基因组DNA,进行PCR扩增,结果其中有10株扩出目的条带,为阳性植株,阳性植株率为71%,如图3为14株抗性植株ACC氧化酶基因的PCR检测结果,575 bp大小为目的条带,结果显示抗性植株中10株的扩增片段大小与阳性对照的条带一致,而阴性对照(水和非转基因米良一号植株)没有目的条带,证明目的基因已整合到转化米良一号的基因组中。

图3 转化植株的PCR分析Fig.3 PCR analysis of transformed plants
泳道1为D2000 ladder marker;泳道2为无模板阴性对照;泳道3为未转化米良一号的DNA PCR扩增阴性对照;泳道4为质粒的PCR扩增阳性对照;泳道5~18为待检测的样品DNA的PCR扩增产物(目标片断的大小为575 bp)。
3 结论与讨论
农杆菌介导转化法是一个细菌和愈伤组织共同作用的复杂过程。凡是涉及到细菌活性或愈伤组织状态的因素都可能影响转化效果。对米良一号而言,一方面是愈伤分化较难,另一面是潮霉素筛选时对愈伤组织造成伤害,潮霉素浓度过高时愈伤完全不能生长。筛选时培养基中合适的潮霉浓度是筛选成功的关键所在。目前仍未见农杆菌介导米良一号转化的报道。通过本实验的研究,找到合适的诱导、继代、分化培养基并优化了生根条件,为农杆菌介导转基因猕猴桃提供合适的组培体系。另一方面,本实验通过对潮霉素浓度的摸索,找到了一个适合用于米良一号筛选的潮霉素浓度,并对侵染时农杆菌的浓度,愈伤的处理以及共培养的条件等进行了优化且取得了较为理想的效果。本实验以叶片和茎为外植体,首次采用农杆菌法成功转化米良一号,为通过转基因研究来改良米良一号奠定了基础。
米良一号猕猴桃属于多糖多酚类植物,多糖物质主要存在于叶中,叶片越老多糖含量越高,在DNA提取过程中,这些物质容易与DNA不可逆地粘附在一起而污染DNA,从而抑制DNA限制性内切酶、T4 DNA连接酶、TaqDNA聚合酶等多种分了生物学酶类的活性[10],传统的CTAB法、SDS法等都很难达到要求[12-14],本实验中我们采用CTAB区室法提取米良一号猕猴桃叶片中的基因组DNA,并对其进行一定改进使所得到的基因组DNA能够满足PCR鉴定和Southern印迹杂交要求。
[1] 田宏现, 曾艳玲, 谭晓风, 等. 米良一号猕猴桃的组织培养研究[J]. 经济林研究, 2005, 23 (1): 7-9.
[2] 陈晓玲, 秦华明, 周玲艳, 等. 以潮霉素为筛选标记猕猴桃遗传转化体系的初步建立[J]. 北方园艺, 2008, (1): 189-191.
[3] 周玲艳, 秦华明, 梁 红. 猕猴桃遗传转化研究进展[J]. 北方园艺, 2007, (8): 50-53.
[4] 肖 媛, 李落叶, 徐孟亮, 等. 根癌农杆菌介导籼稻93-11遗传转化体系的建立[J]. 湖南师范大学学报:自然科学版,2008, 31(3): 77-82.
[5] Han Meili, Gleave Andrew P, Wang Tianchi. Efficient transformation of Actinidia arguta by reducing the strength of basal salts in the medium to alleviate callus browning[J]. Plant Biotechnol Rep, 2010, 4(2): 129-138.
[6] Rugini E, Pellegrineschi A, Mencuccini M, et al. A Increase of rooting ability in the woody species kiwi (Actinidia deliciosa A. Chev.) by transformation with Agrobacterium rhizogenes rol genes[J]. Plant Cell Reports, 1991, 10: 291-295.
[7] Uematsu C, Murase M, Ichikawa H, et al. Agrobacteriummediated transformation and regeneration of kiwi fruit[J]. Plant Cell Reports, 1991, 10: 286-290.
[8] 王平红. 活性炭对蓝莓组培苗生根的影响[J]. 安徽农业科学,2010, 38(22): 11762-11763.
[9] 阳小成, 王伯初, 叶志义, 等. 中华猕猴桃的组织培养及其实用快速繁殖[J]. 重庆大学学报:自然科学版,2002,25(6):75-77.
[10] 王大平, 杨 玲. 猕猴桃组培苗生根培养的研究[J]. 安徽农业科学, 2008, 36(21): 8930-8931.
[11] 谢志兵, 鲁旭东. 不同浓度的IBA对猕猴桃组培苗生根的影响[J]. 落叶果树, 2003, (2): 9-10.
[12] 徐小彪, 陈 华, 张秋明. 美味猕猴桃基因组DNA的高效提取[J]. 中国农学通报, 2004, 20(4): 41-53.
[13] 陈 华, 徐小彪, 易干军, 等. 猕猴桃基因组DNA不同提取方法的研究[J]. 江西农业大学学报, 2005, 27(1): 12-16.
[14] 罗志勇, 周 钢, 陈湘晖, 等. 高质量植物基因组DNA的分离[J]. 湖南医科大学学报, 2001, 26(2): 178-180.
Establishment of transformation system of Kiwifruit Miliang-1
TIAN Hong-xian1,2, YUAN Ping2, WANG Man-ling3, LIU Yi2, LI Jing2, XIA Xin-jie3, TAN Xiao-feng1
(1. Central South University of Forestry and Technology, Changsha 410004, Hunan, China; 2. Jishou University, Jishou 416000, Hunan,China; 3. Institute of Subtropical Agriculture eology, Chinese Academy of Sciences, Changsha 410125, Hunan, China)
In order to establish the technology platform for function analysis of genes and genetic improvement of kiwifruit through biotechnology, the leaves and stems of Miliang-1 plants were used as explants. An efficient regeneration system was established for gene transformation by optimizing the culture medium. By using Agrobacterium-mediated method, transgenic plants containing the ACO(1-Aminocyclopropane-1-carboxylate oxidase) gene fragment were successfully obtained. The results show that the TD medium was the efficent medium for callus induction with a rate of 100%. After three times of subcultures, calli were moved into the differentiation medium, and the rate of differentiation was 90%. A total of 29 hygromycin resistant plants were obtained, and 14 of them were chosen randomly for PCR analysis. Ten of the analyzed plants were shown to be positive for the ACO gene insert (71.4 % ).
Actinidia deliciosa (A. Cher.) (kiwifruit);Agrobacterium tumefaciens;transformation system;tissue culture
S663.4
A
1673-923X(2012)08-0081-05
2012-01-24
湖南省省级科技计划(专项计划)项目“耐贮保鲜高抗性转基因猕猴桃的研究和开发”(2008JT3008);湖南省高校产学研合作示范基地开放项目(2011jsjk003)
田宏现(1953—),男,湖南保靖人,教授,硕士生导师,博士生,主要从事微生物学和林业生物技术方面的研究。E-mail:jstianhx@163.com
谭晓风(1956—),男,湖南茶陵人,教授,博士生导师,博士,主要从事经济林和林业生物技术研究;E-mail:tanxiaofengcn@126.com.cn;夏新界(1959-),男,博士,研究员,博士生导师,主要研究方向为作物耐逆分子生物学;E-mail:jxxia@isa.ac.cn
[本文编校:吴 彬]

