鼠李糖脂对堆肥介质中水分下渗和保持性能的影响
马小玲,钟 华,晏 铭,曾光明,亓永先,刘智峰
鼠李糖脂对堆肥介质中水分下渗和保持性能的影响
马小玲,钟 华,晏 铭,曾光明,亓永先,刘智峰
(湖南大学,湖南 长沙 410082)
为了探讨生物表面活性剂鼠李糖脂对堆肥介质中水分下渗和保持性能的影响,通过下渗实验模拟堆肥,测定了添加表面活性剂后的堆肥样品的含水率。实验结果表明鼠李糖脂保持水分能力优于SDS和Triton X-100,且添加鼠李糖脂浓度越高,介质水分保持性能越好。不同浓度的鼠李糖脂对水在介质中下渗过程的影响各异,400 RE mg/L的鼠李糖脂促进了水的下渗,且效果优于两种化学表面活性剂,而浓度高于800 RE mg/L的鼠李糖脂阻碍了水的下渗。不同深度段的颗粒介质中水分含量和鼠李糖脂含量变化存在对应关系,浓度为400 RE mg/L鼠李糖脂可以提高介质中水的承载能力,这可能是由于鼠李糖脂能够显著降低溶液的表面张力,有效增强溶液在颗粒介质表面的铺展和向微孔中的扩散所致,而高浓度的鼠李糖脂形成的聚集体堵塞了扩散孔道,反而阻碍了介质中水的下渗和减弱了介质对水的承载能力。
鼠李糖脂;堆肥;水分保持;下渗
城市生活垃圾好氧堆肥是依靠自然界广泛分布的细菌、放线菌、真菌等微生物,在一定的人工条件下,有控制地促进垃圾中可被生物降解的有机物向稳定的腐殖质转化的生物化学过程[1]。与绿化废弃物一样,生活垃圾堆肥产物经过无害化处理后也可用作花卉栽培基质[2]。土壤中的生物量会随着土层深度的增加而减少[3],因此,一般采用表层土壤来给生活垃圾好氧堆肥提供微生物。堆肥介质中的所有生物化学反应都需要水的参与,提供一定的含水率是堆肥中有机质降解的必要条件。此外,微生物高效降解有机质还需要一定的含氧量,即保持一定的堆肥介质孔隙来与外界空气流通。好氧堆肥介质是一个固、水、气三相混合体,而微生物对有机物的降解是在堆肥介质间隙中的固体颗粒表面的一层液态膜中进行的[4],有机质降解所需的碳源和氧气都需要通过传质作用到达微生物。但是水的表面张力值较高,容易填充和停留在堆肥物料的空隙中,因而在好氧堆肥水分调节过程中,直接在堆料上添加水容易使之富集于表面或局部,部分则通过表面流、沟流等作用快速到达底部,并不能使它在颗粒介质中均匀分散,严重时可造成堆体部分厌氧而部分缺水。因此,反应体系内垃圾颗粒间隙微环境的物化条件对堆肥效率有重要影响。
表面活性剂是一类同时含有亲水基团和疏水基团的两性分子,具有表面和界面活性。当它们被引入堆肥介质中时,可能通过在固液界面吸附和降低水相的表面张力的作用导致堆肥物料的润湿而优化水相的分布。生物表面活性剂是由微生物或植物产生的天然的表面活性剂,相对于化学表面活性剂它具有稳定性、高效性、低毒性以及易降解性等特点[5-8]。其中,鼠李糖脂(rhamnolipid)是一类主要由假单胞菌属产生的生物表面活性剂,其合成机理、分子结构以及理化性质等均得到了深入研究[9-13],是生物表面活性剂的典型代表,具有优良的表面和界面活性[14-17]。基于以上事实,研究了生物表面活性剂鼠李糖脂对模拟堆肥的有机质颗粒的水分下渗及保湿性能的影响,并与十二烷基硫酸钠(SDS)和曲拉通(Triton X-100)两种化学表面活性剂进行了对比。
1 材料与方法
1.1 材料
1.1.1 有机质颗粒材料
有机质颗粒介质的制备方法同文献[18],得到煤灰为核心、表面附着有机质的颗粒状基质, 粒径0.10~0.13 mm,堆密度0.999 g/mL,真密度2.356 g/mL,空隙率57.6%,有机质含量为14.6%,浸出液pH 6.43。
1.1.2 试剂
鼠李糖脂由中国典型培养物保藏中心提供的Pseudomonas aeruginosa CCTCC AB93066 产生 ,制取和提纯采用酸沉降法[19]。标准鼠李糖和SDS购于美国Sigma公司(纯度>99%);Triton X-100购于英国BDH公司(纯度>99%)。其余试剂为分析纯。
1.1.3 仪器
UV-2550型紫外-可见分光光度计(日本岛津);FA2004N型精密电子天平(上海垒固仪器有限公司);DHG-9070型电热恒温鼓风干燥箱(上海市三发科学仪器有限公司)。
1.2 实验方法
1.2.1 蒸发实验
通过苯酚硫酸法[20]绘制标准曲线得到鼠李糖脂与标准鼠李糖的浓度当量(RE)关系为2.5∶1。准 确 吸 取 0、100 REmg/L、800 REmg/L、2000 REmg/L的鼠李糖脂溶液、800 mg/L的Triton X-100溶液和2 330 mg/L的SDS溶液各12 mL,分别于干燥坩埚内与18 g干燥的有机质颗粒混合,边添加边用玻璃棒快速搅拌,保证表面活性剂溶液与有机质颗粒混合均匀。将该试样放入50℃鼓风干燥箱使其水分蒸发,每隔2小时取样一次,置于准确称重的取样坩埚内,称得样品与取样坩埚总重,两者差值得到取样质量。再在将该取样坩埚于105℃下烘干10 h至恒重,称得烘干后的样品与坩埚总重,烘干前后取样坩埚和样品总重的差值与取样质量之比为样品的含水率W。
1.2.2 下渗实验
下渗实验所用柱子为Φ9×20 mm的刻度玻璃管,样品填充长度10 cm,底部用四层纱布绑好以防止填充物下漏。将同等质量的有机质颗粒装入玻璃管的有效容积中并垛紧,直至样品高度均为10 cm,空隙体积约1.6 mL。采用移液管吸取0、50 REmg/L、100 REmg/L、400 REmg/L、800 REmg/L、2000 REmg/L的鼠李糖脂溶液、800 mg/L的Triton X-100溶液和2330 mg/L的SDS溶液各2.0 mL,同时分别添加到8根玻璃管柱子中,从各表面活性剂溶液流入有机质开始记时,记下不同时间下各表面活性剂溶液液面的深度值。
当表面活性剂溶液上液面到达玻璃管柱子中的有机质颗粒时终止下渗实验。然后除去玻璃管柱子底部的纱布层,将玻璃管的填充部分切成等长的四段,每段2.5 cm,分别测定各段样品中的含水率和鼠李糖脂含量。含水率的测定采用蒸发法,见1.2.1。
对于鼠李糖脂,其含量测定方法如下:在离心管中加入0.50 g样品和2 mL的0.05 M NaHCO3溶液,剧烈震荡1 min,10 000 r·min-1离心15 min,吸出上清液,反复此过程3次,将收集到的上清液于40 mL离心管中合并后用2 mol的盐酸调pH=2,再加入6mL的乙酸乙酯剧烈振荡5 min,静置30 min。取2 mL萃取相于玻璃试管中,60℃将溶剂蒸发干净,加0.05 mol NaHCO3溶液2 mL,静置30 min后摇匀,用苯酚硫酸法测定其中的鼠李糖脂的含量。
2 结果与分析
2.1 表面活性剂作用下有机质颗粒介质水分的保持
由图1可知,每个试样中含水率都随时间呈现下降的趋势,而且加入了表面活性剂的试样含水率要高于未加入表面活性剂的试样含水率,蒸发6 h后含水率最大提高了约12%。表面活性剂的种类和浓度对土壤颗粒介质中的水分保持能力有一定的影响。生物表面活性剂(鼠李糖脂)比化学表面活性剂(SDS和Triton X-100)在颗粒介质中的水分保持能力更强。鼠李糖脂溶液浓度在100 RE mg/L时对水分的保持能力就优于以上两种化学表面活性剂。且鼠李糖脂浓度越大,相同时间介质含水率也较大,这说明加入的鼠李糖脂溶液浓度与介质的水分保持能力是正相关的。然而相对于添加的鼠李糖脂浓度的增幅而言,这种水分保持能力的增幅有限,表明低浓度鼠李糖脂对于有机质颗粒介质中水分的保持即是有效的。
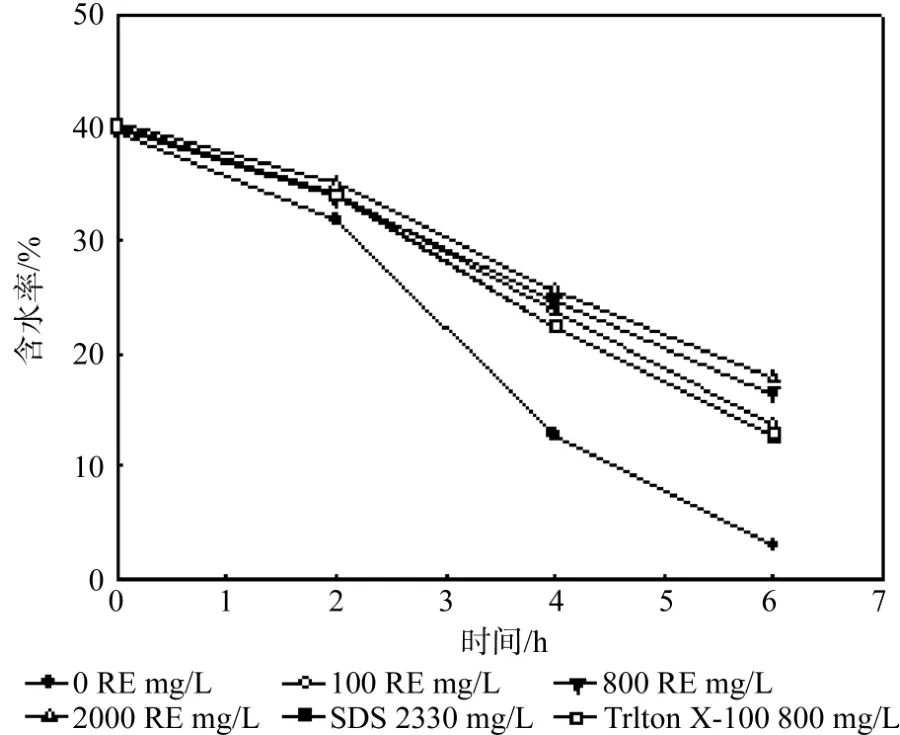
图1 蒸发实验中试样含水率随蒸发时间的变化Fig. 1 Changes of sample moisture content in evaporation experiment as function of time
2.2 表面活性剂溶液在有机质颗粒介质层中的下渗
由图2可知,各溶液渗透速率(曲线斜率)随时间的增加而减小。这是由于表面活性剂液面越深,其溶液需要渗透的介质层也就越长,因而需要克服的介质层阻力也就越大。此实验中,浓度为400 RE mg/L的鼠李糖脂溶液在300 min之内就渗透到柱子底部,下渗速率最快。0、50、100 RE mg/L的鼠李糖脂溶液和800 mg/L的Triton X-100溶液的下渗速率相当。当鼠李糖脂浓度增加至800 RE mg/L时,其溶液的下透速率开始变慢,2000 RE mg/L时的鼠李糖脂溶液下透速率最小,600 min之内还不能穿透柱子。柱子中溶液下渗的驱动力主要有两种,一是因溶液本身重力产生的向下的压力,二是孔隙管道中基于表面张力的毛细作用。下渗开始时压力大于表面张力,毛细作用对扩散的影响小,因而各溶液下渗的速率相差不大。随着下渗过程的进行,下渗阻力增大,毛细作用逐渐成为下渗的主要驱动力。在表面活性剂的作用下,由于表面张力的降低,水相更容易在颗粒介质表面铺展而加速扩散。鼠李糖脂具有极强的表面/界面活性,其临界胶束浓度约为40 mg/L[20-22],该浓度下水溶液的表面张力可降至30 mN/m左右[10,20],这种作用对于400 RE mg/L的鼠李糖脂表现得最为明显。然而,表面活性剂分子在介质孔隙中的吸附和聚集也可能将增加液相下渗的阻力,从而使下渗减慢,鼠李糖脂浓度超过800 RE mg/L时下渗速率反而降低可能就是由于这个原因造成的。

图2 表面活性剂溶液下渗深度随时间变化曲线Fig. 2 Effects of time on permeation depth of surfactant solutions
图3 为下渗实验中不同深度段的试样含水率的变化曲线。由图可知,各柱子中介质的含水率随深度基本呈现一致的趋势,皆为先下降后上升。随着下渗深度的增加,传输的鼠李糖脂含量不断减小,溶液的表面铺展和微孔扩散能力减弱,导致含水率先呈现下降趋势。最后一段的介质含水率反而上升,这是由于柱子底部介质和空气交界面之间存在着毛细阻力阻碍了水分溢出。添加不同浓度的表面活性剂对于柱子介质中的含水率也有显著区别。当鼠李糖脂浓度从0增加到400 RE mg/L时,介质前两段中的含水率不断上升,且鼠李糖脂浓度为400 RE mg/L时介质中含水率最高,表明一定浓度的鼠李糖脂能使土壤颗粒介质对水的承载力加强。而当加入的鼠李糖脂浓度较高(800和2000 RE mg/L)时,柱子中不同深度段含水率随鼠李糖脂浓度的增加而呈现下降的趋势,其中以添加了2000 RE mg/L鼠李糖脂溶液的介质含水率最低。这说明高浓度的表面活性剂分子可能更容易在介质颗粒表面发生吸附和聚集从而阻碍了水分子向介质微孔中进行扩散。
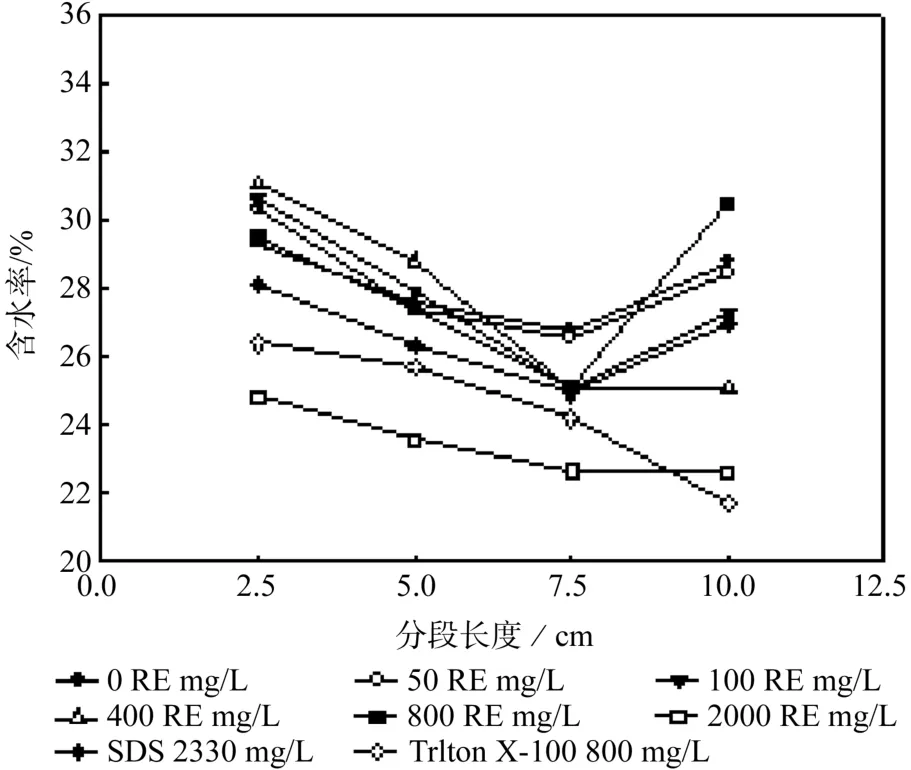
图3 柱子不同深度段含水率的变化曲线Fig. 3 Changes of moisture content within different depth in the pillar
如图4所示,柱子中各段的鼠李糖脂含量随深度段的增加基本呈降低趋势,且对于高浓度鼠李糖脂的添加这种趋势更为明显。这是由于土壤颗粒介质对鼠李糖脂的吸附,使介质中的鼠李糖脂浓度从浅到深不断降低。最后一段柱子中鼠李糖脂含量反而上升,这可能是由于介质与空气界面间的表面张力对鼠李糖脂的滞留作用使得该段鼠李糖脂含量有所上升。鼠李糖脂在不同深度段的分布与溶液的下渗速率及不同深度段介质含水率的分布情况吻合。

图4 柱子中不同深度段鼠李糖脂含量变化曲线Fig. 4 Changes of rhamnolipid content within different depth in the pillar
鼠李糖脂优化堆肥有机质颗粒介质中水的分布的作用模式有如下推测。当鼠李糖脂被引入有机质颗粒的间隙,其分子的疏水端将与有机质结合并固定在垃圾颗粒表面,其亲水端与颗粒孔隙内的水结合,从而降低间隙液相的表面张力,使空隙通道中的呈块状的水沿着有机质颗粒表面舒展开来,并将原本没有水的固体颗粒表面覆盖同时连接成液膜。这种液膜十分稳定,可以为微生物降解有机质提供表面环境[23]。当堵塞空隙通道的块状水体消失时,各个空隙就会互通并与大气相连,介质中的各相态的分布得到优化,空隙中氧气的传质也会由之前的完全扩散传质变为部分扩散传质部分对流传质,从而加强氧气的传质效率(图5),大大提高微生物降解有机质颗粒的反应速率。
3 结 论
表面活性剂对有机质颗粒介质的水分有较好的保持性能,有利于长时间保持堆肥微生物的活性。生物表面活性剂鼠李糖脂的作用优于化学表面活性剂SDS和Triton X-100,在低浓度下即可有效地减缓水分的蒸发,并且溶液浓度越高,这种水分保持性能越好。
在合适的浓度范围内,鼠李糖脂降低了介质水的表面张力,增强了溶液在有机质颗粒介质表面的铺展和润湿,导致了水分下渗速度的加快,并提高了介质中水分的承载能力。通过这种作用,鼠李糖脂有可能促进堆肥颗粒中水相向微孔的扩散,使水分更容易渗透到介质深层,从而优化水分在介质中的分布,这对于将之应用于有机质堆肥过程有一定的借鉴意义。
[1] 赵由才.生活垃圾资源化原理与技术[M]. 北京:化学工业出版社,2002:140-142.
[2] 张 强,孙向阳,任忠秀,等.园林绿化废弃物堆肥用作花卉栽培基质的效果评价[J]. 中南林业科技大学学报,2011,31(9):7-13.
[3] 李 灵,张 玉,王利宝,等. 不同林地土壤微生物生物量垂直分布及相关性分析[J]. 中南林业科技大学学报,2007, 27(2):52-56.
[4] Tom L R. Municipal solid waste Composting: Biological Processing[M]. Published by Cornell Waste Management Institute, Center for the Environment, Hollister Hall, Ithaca, NY,1998, 425.
[5] Zhang L, Somasundaran P, Singh S K, et al. Synthesis and interfacial properties of sophorolipid derivatives[J]. Colloid.surfac. A, 2004: 75-82.
[6] Fleck L C, Bicca F C, Zachia Ayub M A. Physiological aspects of hydrocarbon emulsification, metal resistance and DNA profile of biodegrading bacteria isolated from oil polluted sites[J].Biotechnol. Lett. , 2000, 22: 285-289.
[7] Zeng G M, Fu H Y, Zhong H, et al. Co-degradation with glucose of four surfactants, CTAB, Triton X-100, SDS and rhamnolipid,in liquid culture media and compost matrix[J]. Biodegradation,2007, 18: 303-310.
[8] Poremba K, Gunkel W, Lang S, et al. Marine biosurfactants. III.Toxicity testing with marine microorganisms and comparison with synthetic surfactants[J]. Zeit. Naturforsch.,1991,46c:210-216.
[9] Gloria S C, François L, Eric D. Production of rhamnolipids by Pseudomonas aeruginosa[J]. Appl. Microbiol. Biotechnol, 2005,68: 718-725.
[10] Mata-Sandovala J C, Karnsb J, Torrents A. High-performance liquid chromatography method for the characterization of rhamnolipid mixtures produced by Pseudomonas aeruginosa UG2 on corn oil[J]. J. Chromatogr. A, 1999, 864: 211-220.
[11] Noordman W H, Brusseau M L, Janssen D B. Adsorption of a multicomponent rhamnolipid surfactant to soil[J]. Environ. Sci.Technol. , 2000, 34: 832-838.
[12] Champion J T, Gilkey J C, Lamparski H, et al. Electron microscopy of rhamnolipid (biosurfactant) morphology: effects of pH, cadmium, and octadecane[J]. J. Colloid Interface Sci.,1995, 170: 569-574.
[13] Dahrazma B, Mulligan C N, Nieh M P. Effects of additives on the structure of rhamnolipid (biosurfactant): a small angle neutron scattering (SANS) study[J]. J. Colloid Interface Sci. , 2008, 319:590-593.
[14] Sánchez M, Aranda F J, Espuny M J, et al. Aggregation behaviour of a dirhamnolipid biosurfactant secreted by Pseudomonas aeruginosa in aqueous media[J]. J. Colloid Interface Sci., 2007, 307: 246-253.
[15] Zhong H, Zeng G M, Yuan X Z, et al. Adsorption of dirhamnolipid on four microorganisms and the effect on cell surface hydrophobicity[J]. Appl. Microbiol. Biotechnol, , 2007,77: 447-455.
[16] Yuan X Z, Ren F Y, Zeng G M, et al. Adsorption of surfactants on a Pseudomonas aeruginosa strain and the effect on cell surface lypohydrophilic property[J]. Appl. Microbiol. Biotechnol. , 2007,76: 1189-1198.
[17] Zhong H, Zeng G M, Liu J X, et al. Adsorption of monorhamnolipid and dirhamnolipid on two pseudomonas aeruginosa strains and the effect on cell surface hydrophobicity[J]. Appl. Microbiol. Biotechnol., 2008, 79: 671-677.
[18] 钟 华,曾光明,黄国和, 等. 鼠李糖脂对铜绿假单胞菌降解颗粒有机质的影响[J]. 中国环境科学, 2006,26(2): 201-205.
[19] Noordman W H, Brusseau M L, Janssen D B. Adsorption of a multicomponent rhamnolipid surfactant to soil[J]. Environ. Sci.Technol. , 2000,34(5): 832-838.
[20] Zhang Y, Miller R M. Enhanced octadecane dispersion and biodegradation by a pseudomonas rhamnolipid surfactant(biosurfactant) [J]. Appl. Environ. Microbiol. , 1992, 58: 3276-3282.
[21] Sánchez M, Aranda F J, Espuny M J, et al. Aggregation behavior of a dirhamnolipid biosurfactant secreted by Pseudomonas aeruginosa in aqueous media[J]. J. Colloid Interface Sci., 2007,307: 246-253.
[22] Wei Y H, Chou C L, Chang J S. Rhamnolipid production by indigenous Pseudomonas aeruginosa J4 originating from petrochemical wastewater[J]. Biochem. Eng. J.,2005,27:146-154.
[23] Ellis H, Harold P, Kronberg H. Bioremediation of a creosote contaminated site[J]. Environ. Technol. , 1991, 12: 447.
Effect of rhamnolipid on water permeation and reservation in compost matrix
MA Xiao-ling, ZHONG Hua, YAN Ming, ZENG Guang-ming, QI Yong-xian, LIU Zhi-feng
(Hunan University, Changsha 410082, Hunan, China)
In order to explore the effect of biosurfactant rhamnolipid on water reservation and permeation in compost matrix, the permeation experiment was used for the simulation of compost and the moisture content of compost samples after surfactant addition was determined. The results show that rhamnolipid was superior to SDS and Triton X-100 in water bearing, and the higher the rhamolipid concentration added, the better the effect. The effect of rhamnolipid on water permeation in the matrix changed with the biosurfactant concentration. 400 RE mg/L rhamnolipid enhanced water permeation and the effect was better than that of the two synthetic surfactants.However, when the rhamnolipid concentration was higher than 800 RE mg/L it slowed down the water downflow. The water content was relevant to rhamnolipid content in the compost matrix of different depth sections. 400 RE mg/L rhamnolipid enhanced water bearing capacity in the matrix, which probably resulted from the ability of rhamnolipid to decrease water surface tension and to enhance water spreading on the granule surface and diffusion in micropores. However, rhamnolipid of high concentrations was readily to form large aggregates which blocked the micropores and weakened water permeation and bearing capability in the matrix.
rhamnolipid; compost; water bearing capability; permeation
S718;X172
A
1673-923X(2012)08-0112-05
2012-01-24
国家973计划项目“环境生物技术与控制”(2005CB724203);国家自然科学基金青年基金(50908081);长江学者和创新团队发展计划资助项目(IRT07190)
马小玲(1986—),女,湖南常德人,硕士研究生,主要从事表面活性剂在堆肥中的应用研究;E-mail:marymaxiaoling@126.com
曾光明(1962—),男,湖南华容人,教授,主要从事固体废物资源化,E-mail: zgming@hnu.edu.cn
[本文编校:吴 彬]

