进口针叶木木材的DNA提取与分子鉴定方法
刘金良,伏建国,杨晓军,安榆林,骆嘉言
进口针叶木木材的DNA提取与分子鉴定方法
刘金良1,伏建国2,杨晓军2,安榆林2,骆嘉言1
(1.南京林业大学 木材工业学院,江苏 南京 210037;2.江苏出入境检验检疫局,江苏 南京210001)
我国每年从国外进口大量的针叶木材,这些材种的正确识别对于保护我国进口商利益及消费者合法权益等方面具有重要意义。由于木材形态学鉴定技术的局限性,近年来,分子遗传学技术开始应用于木材的材种鉴定及来源地识别。选取进口的6类针叶木木材为材料,研究木材DNA提取和纯化方法,摸索出了适合于针叶木木材的CTAB-SDS-磁珠相结合的DNA提取和纯化体系。扩增出500 bp 的trnL内含子片段,共发现85个碱基多态性位。聚类分析结果可以将6类进口针叶木区分开来,为进口针叶木的鉴定及分子识别研究工作奠定了良好的基础。
针叶木木材; DNA提取;纯化;PCR;trnL;鉴定
木材识别技术对于木材的合理使用、生产加工、打击非法采伐、保护珍稀濒危材种、规范市场秩序、维护消费者权益等方面具有重要意义[1]。随着世界木材消费量的快速增长,木材资源的短缺和匮乏日益显现,非法砍伐和贸易严重破坏了林木资源的可持续利用。为了保护森林资源,很多国家出台了保护森林的法规和政策,对木材的合法性提出了要求,如美国的《雷斯法案》(2008年修订案)要求,所有输美的木制品都应提供木材供应的合法来源,包括使用的植物种类的拉丁名、采伐的国家、数量、价值等[2],这对木材识别技术提出了更高的要求。传统的形态学方法只能鉴定木材的种类(通常鉴定不到种的水平),无法识别木材的来源。
随着分子遗传学的发展,分子标记及DNA条形码技术[3-7]逐渐成为一种物种辅助鉴定的工具,越来越多的学者开始尝试利用核酸序列的差异来识别木材[8]。目前,很多实验在木材DNA提取领域取得了成功,从干燥或处理过的木材中获得了可以满足短片段核酸序列PCR扩增的DNA[9-15],也有少数通过分子标记技术实现了木材种类的鉴定或来源地的验证[16-20]。虽然这些研究仅限于试验的少数树种,但其证明了分子遗传学技术在材种识别领域应用的可行性及其光明前景。
我国每年从美国、加拿大、俄罗斯等国进口大量的针叶木,这些材种的正确识别鉴定对于保护我国进口商利益、保护我国消费者合法权益等方面意义重大。由于木材的形态鉴定需要具有丰富经验的技术专家,目前这些技术人才十分缺乏。本研究拟通过对进口的针叶木木材DNA提取及分子鉴定技术进行研究,建立适合于针叶木木材DNA提取的方法体系,通过初步的识别试验,探索分子识别的方法,为针叶木木材分子鉴定及来源地识别的研究工作打下基础。
1 材料和方法
1.1 材料
实验材料取自江苏太仓港口进口的针叶木,样品经南京林业大学和太仓出入境检验检疫局鉴定为花旗松Pseudotsuga menziesii、铁杉Tsuga spp.、 冷 杉 Abies spp.、 云 杉 Picea spp.、 落 叶 松Larix spp.和辐射松Pinups radiata,样品的详细信息见表1。

表1 实验用材料的信息Table 1 Information of tested materials
1.2 DNA提取
DNA提取采用CTAB-SDS法,参考Novaes[21]等从豆科树皮中提取DNA的方法,在其基础上略有改变,具体操作步骤如下:
(1) 用手术刀削取约150 mg去除污染的木材削片,加入液氮,在低温破碎仪(Retsch MM400)上研磨4 min,频率30次/s;
(2) 迅速将粉末移入2 mL离心管中,加入900 μL 2% CTAB 溶液、0.02 g PVP、20 μL 巯基乙醇、2 μL 蛋白酶 K(20 mg/mL),混匀后加入 35 μL 20%SDS,再次充分混匀;
(3) 在65℃水浴锅中水浴过夜,其间多颠倒混匀几次;
(4) 冷却至室温,加入900 μL酚∶氯仿∶异戊醇(25∶24∶1),颠倒混匀5 min;
(5) 用小型高速离心机离心20 min,13 000 r/min,吸取上清液至新的离心管中;
(6) 加入等体积氯仿/异戊醇(24∶1),颠倒混匀,离心20 min,13 000 r/min,吸取上清液至新的离心管中;
(7) 加入 140 μL 10% CTAB 溶液和 280 μL 5 mol NaCl溶液,颠倒混匀,然后离心20 min,13 000 r/min,吸取上清液至新的离心管中;
(8) 重复步骤 6;
(9) 加入等体积冷冻的异丙醇,轻轻晃动,然后-20℃冷冻沉淀DNA 过夜;
(10) 13 000 r/min离心20 min,弃上清液;
(11) 用2 mL冷冻70%乙醇溶液洗涤沉淀2次;
(12) 在超净工作台上晾干,加入50 μL TE溶液溶解DNA,-20℃储藏
1.3 DNA纯化
采用GenMagBio公司的植物DNA磁珠纯化试剂盒,详细操作步骤如下:
(1)取50 μL DNA溶液于1.5 mL离心管中,加入等体积无水乙醇和20 μL磁珠,颠倒混匀10 min;
(2)将离心管置于磁力架1 min,使管内磁珠被吸附,用移液器移走管内液体,取下离心管;
(3)加入500 μL Wash BufferⅠ,颠倒混匀数次,将磁珠团打散即可,利用磁力架吸附磁珠,1 min后移走管内液体,取下离心管;
(4)重复步骤3,将磁珠团打散即可,利用磁力架吸附磁珠,1 min后移走管内液体,同时保持离心管置于磁力架上,使磁珠继续被吸附;
(5)从离心管另一侧缓慢加入550 μL Wash BufferⅡ,1 min后移走管内液体,取下离心管;
(6)加入50 μL Elution Buffer,使磁珠重新悬浮,55℃温浴10 min,其间轻轻晃动使核酸充分洗脱;
(7)将离心管置于磁力架上1 min,使磁珠被吸附,将液体转移至新的1.5 mL离心管,即为纯化后的DNA溶液。
1.4 PCR引物设计与扩增
通过对Genbank上已发表的松科树种序列进行比对和分析,发现叶绿体tRNALeu(trnL)内含子在不同种属间的存在较为明显的差异,因此选取trnL片段的一对通用引物进行PCR扩增[15]。正反向引物分别为trnL-F CGAAATCGGTAGACGCTACG和trnL-R GGGGA TAGAGGGACTTGAAC。扩增采用Takara公司的Premix Ex Tag 混合酶液,50 μL 反应体系,Premix Ex Tag 混合酶液 25 μL,模板 DNA 2 μL,正反向引物各1 μL,双蒸水(ddH20)21 μL。扩增反应程序:95℃预变性5 min,94℃ 30 s,50℃ 1 min,72℃ 1 min, 循环30次,72℃延伸10 min。
1.5 PCR产物检测与测序分析
PCR扩增产物通过1.5%的琼脂糖凝胶电泳检测,加入8 μL PCR扩增产物,150 V 电泳30 min,溴化乙锭中染色30 min,放入凝胶成像系统中观察、拍照。扩增出清晰条带的PCR产物送上海生工和南京金斯瑞生物科技有限公司纯化后测序,测序引物采用PCR扩增引物,所有序列均进行双向测序。对测序结果首先进行手工判读和校对,然后用DNA Star软件包中的SeqMan拼接。所得序列导入Mega 5软件,使用Clustal W多序列对比功能进行对位排序。空位处作缺失状态。对位排序后的序列用软件中的邻接法(Neigobor-Joining,NJ)构建系统进化树。进化树用自展(Bootstrap)分析法进行检验,循环1 000次。
2 结果与分析
2.1 DNA提取结果
提取纯化后的DNA经Spectrophotometer定量法检测,DNA得率及OD260/280值见表2,利用CTAB-SDS-磁珠提取法,从不同材种获得的DNA质量差别明显,从花旗松中提取的DNA质量最低,平均每1 g 木材获得 DNA 4.74 μg,OD260/280的值也较低。从 中获得的DNA质量最高,平均每1 g 木材获得 DNA 25.72 μg,OD260/280 的值也较为理想。

表2 从不同材种中提取的DNA质量Table 2 DNA recovered from different woods
2.2 PCR扩增结果
PCR扩增电泳检测结果见图1,30个样品共扩增出29个约500 bp大小的目标条带,只有一个铁杉样品未扩增出条带,扩增成功率为96.7%,未发现非特异性扩增,但有些目标条带较为模糊。
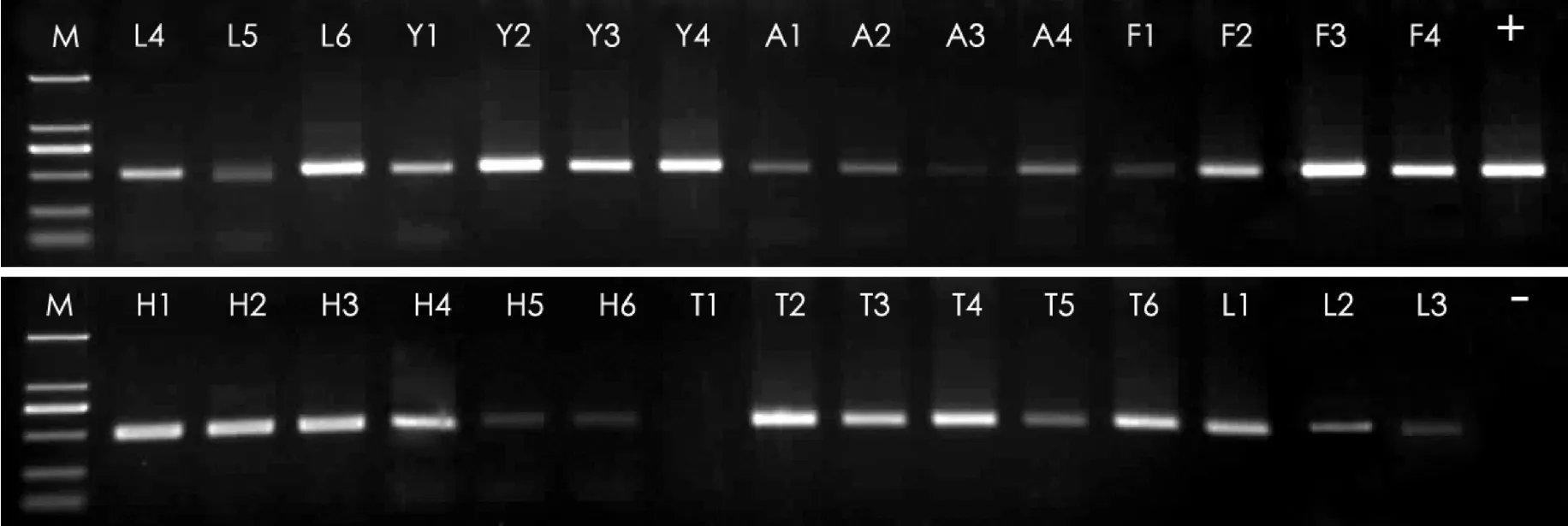
图1 6类针叶木木材trnL片断PCR结果电泳图M:marker DL2000; L(1-6):落叶松;Y(1-4):云杉;A(1-4):落叶松;F(1-4):辐射松;H(1-6):花旗松;T(1-6):铁杉;+:阳性对照;-:阴性对照Fig. 1 PCR amplification results of trnL partial sequences of six conifer wood
2.3 测序结果分析
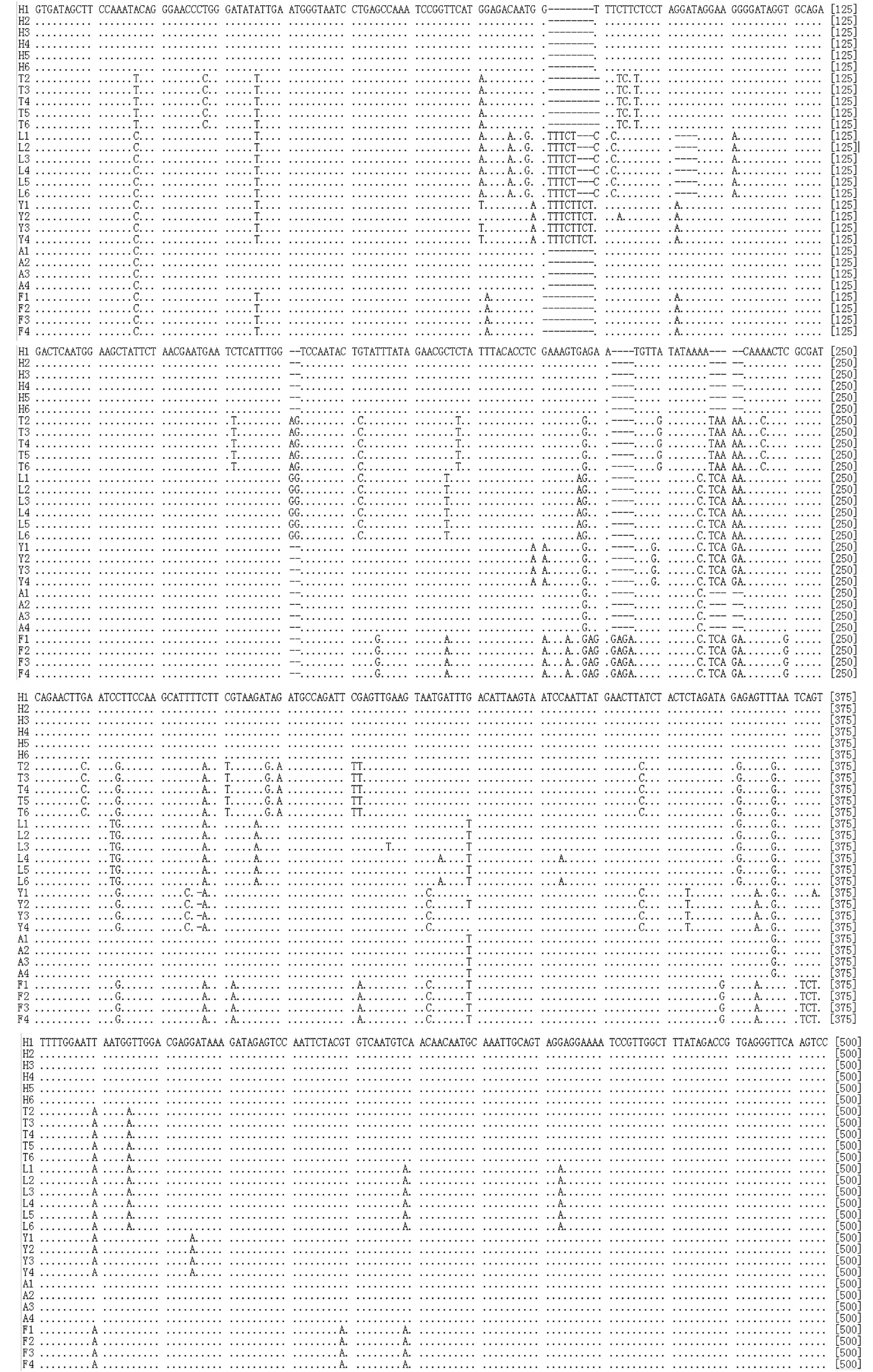
图2 6类针叶木木材trnL内含子部分片段序列L(1-6):落叶松;Y(1-4):云杉;A(1-4):落叶松;F(1-4):辐射松;H(1-6):花旗松;T(2-6):铁杉;Fig. 2 Partial sequences of the trnL intron of six conifer wood
29个PCR产物全部测出500 bp左右的DNA序列(见图2),其中花旗松6条,铁杉5条,落叶松6条,云杉4条,冷杉4条,辐射松4条。测序结果在Genbank上进行比对,全部与已经发表的同属trnL基因片断具有99%的相似度,证明本实验提取的DNA确是相应种类针叶木的DNA。在500 bp的序列中共发现85个多态性位点,可以将6类针叶材完全区分开来。所得序列导入Mega 5软件,使用Clustal W多序列对比功能进行对位排序,空位处作缺失状态,对位排序后的序列用软件中的邻接法(Neighbor Joining,NJ)构建系统进化树。系统进化树如图3所示,花旗松、落叶松、铁杉、冷杉、云杉和辐射松分别以自展值99、97、100、100、100、100聚为一支,和形态学分类鉴定的结果一致。
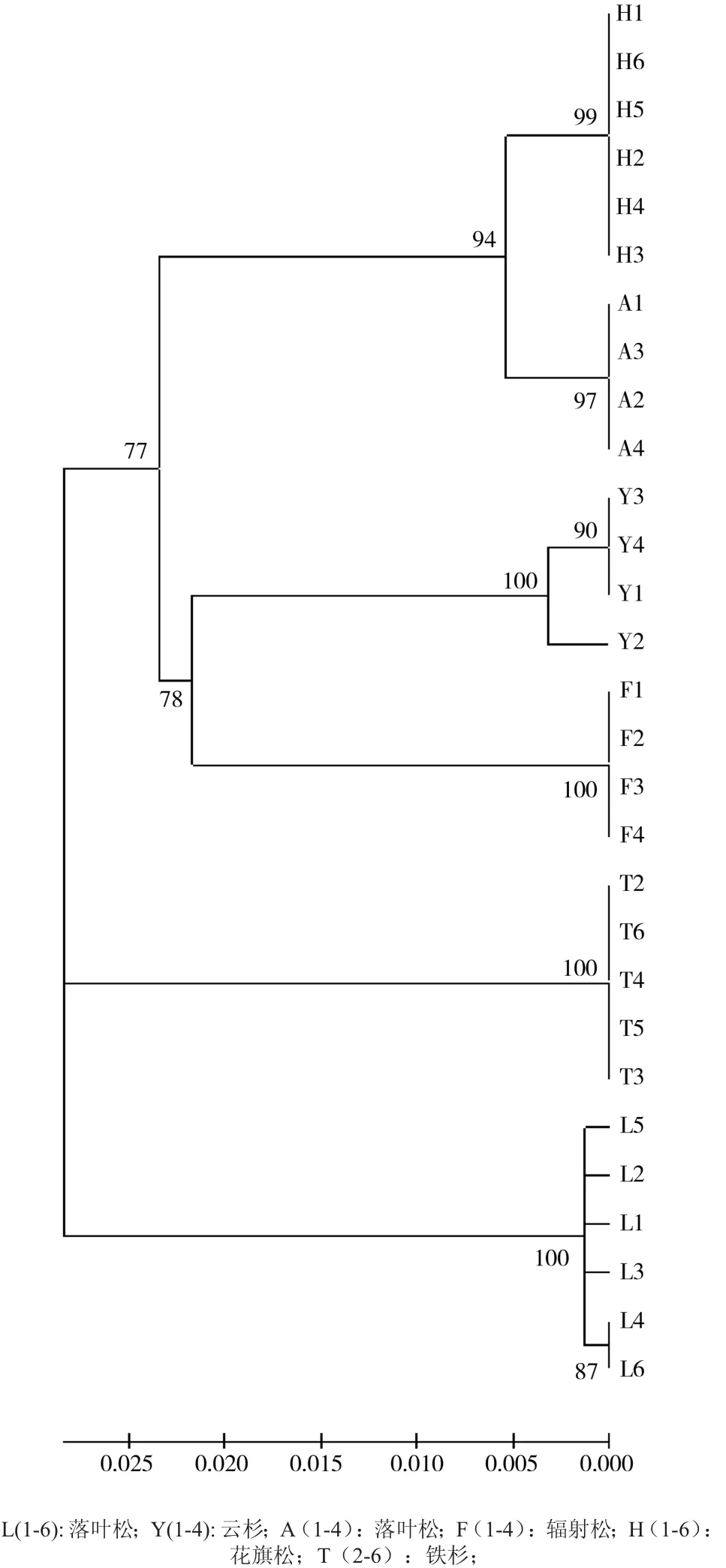
图3 基于叶绿体trnL部分序列构建的6属针叶木系统发育关系NJ树Fig. 3 NJ tree of six kinds of conifer wood based on trnL region of chloroplast DNA
3 结论与讨论
针叶木中含有很多影响DNA提取及抑制PCR扩增的物质,从针叶木中提取DNA是非常困难的[22]。 2004年Reynolds[12]利用试剂盒法从松木中提取出可以扩增出400 bp的DNA片段。本实验最初采用改良的CTAB及试剂盒法,均未获得满意的结果。最后选用CTAB-SDS方法进行提取,后用磁珠法进行纯化,从6类针叶材中获取的DNA96.7%能够扩增出500 bp的片段,证明了该方法适合于针叶木DNA的提取。未经磁珠纯化的木材DNA含有较多的抑制PCR扩增物质,将其与同体积的阳性对照DNA混合后作为模板进行PCR扩增,扩增出的条带明显比阳性对照与同体积水混合后扩增出的条带暗。利用磁珠纯化后,上述抑制现象不明显。
叶绿体trnL片段是植物DNA条形码的候选片段之一[15],通过本实验的结果,发现其在针叶木属间差异明显,通过聚类分析很容易将进口的6类针叶木材种区分开来。在Genbank上比对的结果显示,同属的树种,该段序列大多具有99%的相似度,而与其它属的序列相似度则较低,又由于500 bp片段相对较短,适合于木材DNA的扩增。因此,trnL是用于进口针叶木材种鉴定较为理想的片段。
本研究从6类进口针叶材中提取出可用于普通PCR扩增的DNA,为后继的木材DNA提取、分子识别等研究工作提供了些许借鉴。利用trnL片段成功地将6类针叶木区分开来,这一技术可作为形态鉴定的辅助手段,直接应用于进口木材的检验鉴定。但由于本实验样品有限,提取方法能不能适应于更多种类针叶木DNA的提取还有待于进一步的实验来验证,trnL序列目前只能将针叶木区分到属的水平,更精确的识别还需要进一步的研究。
[1] 姜笑梅, 殷亚方,刘 波. 木材树种识别技术现状、发展与展望 [J]. 木材工业,2010,4:36-394.
[2] 王连茂,程宝栋,唐 帅. 《雷斯法案》修正案对中美木质家具出口影响及对策分析[J]. 江西林业科技,2011,1:38-41.
[3] Hebert P D N, Cywinska A, Ball S L, et al. Biological identifications through DNA barcodes. Proceedings of the Royal Society of London Series B: Biological Sciences.2003, 270: 313-321.
[4] Kress W J, Wurdack K J, Zimmer E A, et al. Use of DNA barcodes to identify flowering plants [J]. Proc. Natl. Acad. Sci.USA, 2005, 102:8369-8374.
[5] Newmaster S G, Fazekas A J, Ragupathy S. DNA barcoding in the land plants: evaluation of rbcL in a multigene tiered approach[J]. Candian Joural of Botany, 2006, 84: 335-341.
[6] Chase M W, Cowan R S, Hollingsworth P M, et al. A proposal for a standardised protocol to barcode all land plants [J]. Taxon,2007, 56: 295-299.
[7] Hollingsworth P M, Forrest L L, Spouge J L, et al. A DNA barcode for land plants [J]. Proc .Natl. Acad. Sci. USA, 2009,106: 12794-12797.
[8] Finkeldey R, Leinemann L, Gailing O. Molecular genetic tools to infer the origin of forest plants and wood [J]. Appl. Microbiol.Biotechnol., 2010, 85:1251-1258.
[9] De Filippis L, Magel E. Differences in genomic DNA extracted from bark and from wood of different zones in Robinia trees using RAPD-PCR[J]. Trees, 1998, 12(6): 377-384.
[10] Dumolin-Lapègue S, Pemonge M H, Gielly L, et al.Amplification of oak DNA from ancient and modern wood [J].Mol. Ecol., 1999, 8: 2137-2140.
[11] Deguilloux M F, Pemonge M H, Petit R J. Novel perspectives in wood certification and forensics: dry wood as a source of DNA[J]. Proc. Biol. Sci., 2002, 269: 1039-1046.
[12] Reynolds M M, Williams C G. Extracting DNA from submerged pine wood [J]. Genome, 2004, 47: 994-997.
[13] Rachmayanti Y, Leinemann L, Gailing O, et al. Extraction,amplification and characterization of wood DNA from Dipterocarpaceae [J]. Plant Mol. Biol. Report, 2006, 24: 45-55.
[14] Liepelt S, Sperisen C, Deguilloux M F, et al. Authenticated DNA from ancient wood remains [J]. Ann. Bot., 2006, 98: 1107-1111.
[15] Rachmayanti Y, Leinemann L, Gailing O. DNA from processed and unprocessed wood: factors influencing the isolation success[J]. Forensic Science International: Genetics , 2009, 3: 185-192.
[16] Asif MJ, Cannon CH. DNA extraction from processed wood: a case study for the identification of an endangered timber species(Gonystylus bancanus ) [J]. Plant Mol. Biol. Report, 2005, 23:185-192.
[17] Ogden R, McGough H N, Cowan R S, et al. SNP-based method for the genetic identification of ramin Gonystylus spp. timber and products: applied research meeting CITES enforcement needs[J]. Endangered Species Reseach, 2008, 9: 255-261.
[18] Wong K N, Tan W L, Chew F T. Identification and characterization of microsatellite loci in Intsia palembanica(Leguminosae), a valuable tropical timber species [J]. Mol. Ecol.Resour., 2009, 9: 360-364.
[19] Tang X, Zhao G, Ping L. Wood identification with PCR targeting noncoding chloroplast DNA [J]. Plant Mol. Biol., 2011, 77(6):609-617.
[20] Deguilloux M F, Pemonge M H., Bertel L, et al. Checking the geographical origin of oak wood: molecular and statistical tools[J]. Mol. Ecol., 2003, 12: 1629-1636.
[21] Novaes R M L, Rodrigues J G, Lovato M B. An efficient protocol for tissue sampling and DNA isolation from the stem bark of Leguminosae trees [J]. Genet. Mol. Res., 2009, 8: 86-96.
[22] White E, Hunter J, Dubetz, C et al. Microsatellite mrkers for individual tree genotyping: application in forest crime prosecutions [J]. J. Chem. Technol. Biotechnol.,2000,75:923-926.
DNA extraction from imported coniferous tree wood and identification technology based on molecular genetic tools
LIU Jin-liang1, FU Jian-guo2, YANG Xiao-jun2, AN Yu-lin2, LUO Jia-yan1
(1. College of Wood Science and Technology, Nanjing Forestry University, Nanjing 210037, Jiangsu, China;2. Jiangsu Entry-Exit Inspection and Quarantine Bureau of the People’s Republic of China, Nanjing 210001, Jiangsu, China )
China imported large quantities of conifer wood every year. The correct identification of the wood had a very important significance to protect the interests of importers and consumers. Molecular genetic tools had been used to the wood identification in recent years because the morphological methods had their limitations. Six kinds of conifer wood imported from different countries were selected, the wood’s DNA extraction and purification methods were studied, and a technique system that combined CTAB, SDS and magnetic beads, is suitable for conifer wood has been put forward. The trnL intron fragment of 500 bp was amplified and sequenced,a total of 85 single nucleotide polymorphisms were found, so the 6 kinds of conifer wood could be distinguished. The success of DNA identification and PCR amplification of conifer wood would be very helpful to further study.
conifer timber; DNA extraction; purification; PCR; trnL; identification
S781.1;Q341
A
1673-923X (2012)08-0131-06
2012-02-25
国家质检总局项目“进出口珍稀濒危材种检验鉴定技术的研究”(2008IK237)
刘金良(1986—),男,研究生;主要从事木材树种鉴定研究
安榆林,男,研究员;主要从事入境植物检疫工作;E-mail:anyl@jsciq.gov.cn
[本文编校:邱德勇]

