酸碱滴定过程中酚酞变色点影响因素的分析*
毕吉利,杨文远,吴晓红,马然松
(宁夏大学 化学化工学院,宁夏 银川 750000)
酚酞(phenolphthalein)的化学名称是3,3-双(对-羟苯基),化学式:C20H14O4,其表观为白色细小晶体,相对密度为1.27,易溶于乙醇,难溶于水.在弱酸性或中性水溶液中均为无色,在8

图1 酚酞在不同PH值环境中分子结构
本文主要通过对酚酞试剂变色范围的影响因素分析和论证,从理论和实验数据上使学生理解指示剂变色的真正原因,并能够在实验中得到很好的应用.
1 实验部分
1.1 实验原理
指示剂在溶液pH改变时,由于质子转移引起指示剂分子或离子结构发生变化,使其在可见光范围内发生了吸收光谱的改变,因而呈现不同颜色的变化[2].若以HIn表示指示剂,In-为其共轭碱,那么,HIn的电离平衡为:HIn(aq)+H2OH3O+(aq)+In(aq),其中HIn(aq)和In(aq)的颜色分别为无色和红色.当溶液≤溶液的pH≥pKa(HIn)+1,指示剂90%以上以共轭碱In-的形式存在,溶液呈现In-的颜色,由于酚酞试剂为弱电解质,随着酚酞滴数的增加,(HIn)的增加率大于导致酚酞变色点范围左移,致使同一色度下,滴数越少,pH越大.同理,随着溶液温度的升高,平衡向正方向移动,导致的变化率增加,使酚酞变色点范围随着温度的升高向左移动.
1.2 实验仪器和药品
(1)实验仪器.数据采集器、pH传感器、色度传感器、计算机(配套软件)、电子天平、磁力搅拌器、水浴锅、酸式滴定管、碱式滴定管、锥形瓶、容量瓶、烧杯、量筒、玻璃棒、胶头滴管.
(2)药品.酚酞固体,0.1mol/L盐酸,0.1mol/L氢氧化钠,乙醇.
1.3 实验过程
连接好装置,打开数据采集器及计算机配套软件,设置采样频率为2s,手动停止.
实验1
(1)准确称取20mL,0.1mol/L盐酸溶液于4支200mL的锥形瓶中,再分别向4份溶液中滴加3滴、7滴、15滴、20滴的酚酞试剂,静止片刻,使其混合均匀.
(2)将pH传感器插入溶液当中,使探头完全浸没于液面以下,开启磁力搅拌器,用低速搅拌.
(3)用0.1mol/L氢氧化钠溶液匀速滴加到盛放盐酸的锥形瓶中,待溶液pH值增加到3.5左右时,减慢氢氧化钠的滴加速度(半滴/次),观察溶液颜色变化,当溶液颜色发生变化后,停止滴定,待pH值显示稳定后,迅速清洗探头转移到不同酚酞滴数的锥形瓶当中,平行测定5次,保留图像.
(4)用色度传感器测量滴定后溶液的色度,进行对比.
实验2
(1)取0.1mol/L、30mL盐酸溶液5份,盛放于200mL锥形瓶中,分别滴加3滴酚酞试剂,待其混合均匀后开始实验.
(2)开启水浴锅,调节温度,将pH传感器插入溶液当中,使探头浸没于液面下方,用玻璃棒匀速搅拌.
(3)同实验1中(3).
(4)调节水浴锅温度,平行滴定5次,并用色度传感器测量滴定后溶液的色度.
1.4 实验数据及处理
实验1
确保滴定终点溶液的吸光度相同是研究酚酞变色影响因素的前提,滴定结束后,对所滴定溶液的透光率进行测量和分析,如表1所示.根据朗伯比尔定律A=lgT=εbc,式中:A-吸光度;T-透光率;ε-吸光系数;b-液层厚度;c-溶液浓度.对溶液透光率进行换算可以证明溶液在吸光度上无明显差异,可为后续研究做充分保证.
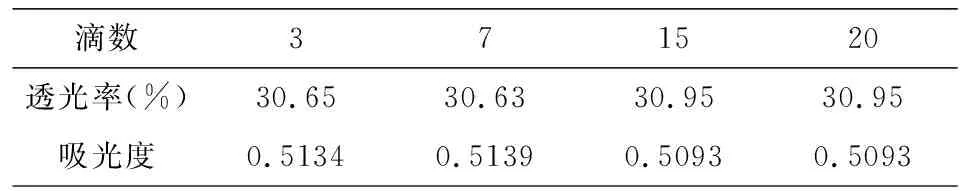
表1 不同滴数下的透光率和吸光度
相同浓度的氢氧化钠溶液滴定盐酸,在控制浓度因素的前提下,改变指示剂的用量,通过实验数据证明,随着指示剂用量的增加,同一吸光度的被滴定溶液,pH值逐渐减小(见图2).
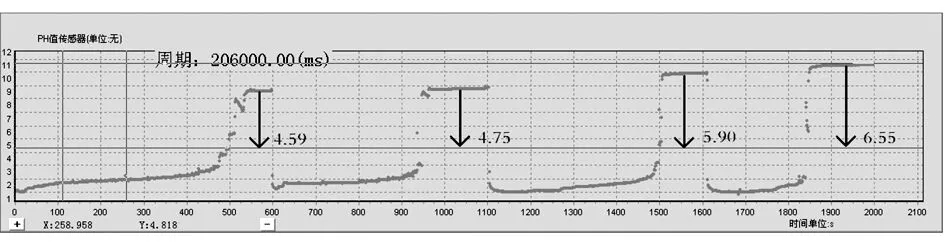
图2 不同滴数下pH值变化
对以上数据通过Spearman相关分析[3],结果显示,酚酞滴数与pH值之间的相关显著,相关系数为r=-0.736,p<0.01(见表2).
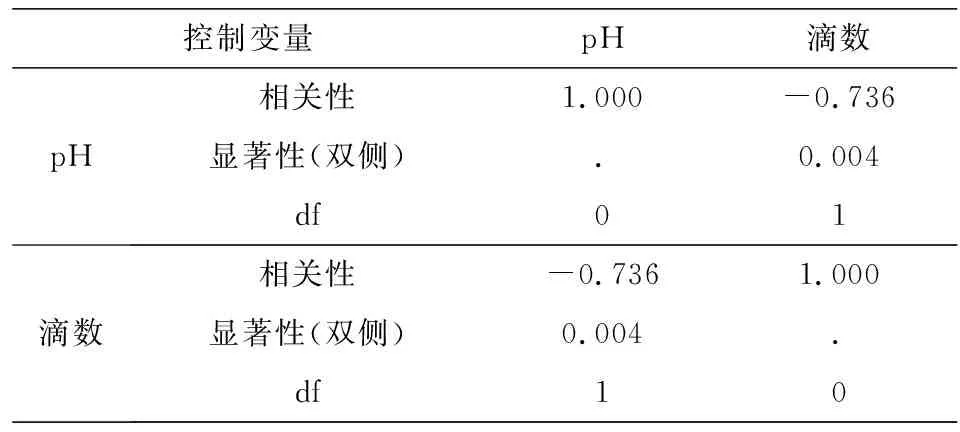
表2 滴数与pH相关性
实验2
控制酚酞滴数因素的前提下,改变滴定环境的温度,并在恒温下平行测定酚酞变色点的变化区域范围,通过Spss数理统计软件对其进行描述性统计,不难发现,随着温度的升高,变色点的pH平均值逐渐降低,极值呈周期性变化(见表3)对温度和pH值进行回归拟合,置信区间为95%,R线性=-16.345,具有明显负相关性,如图3所示.
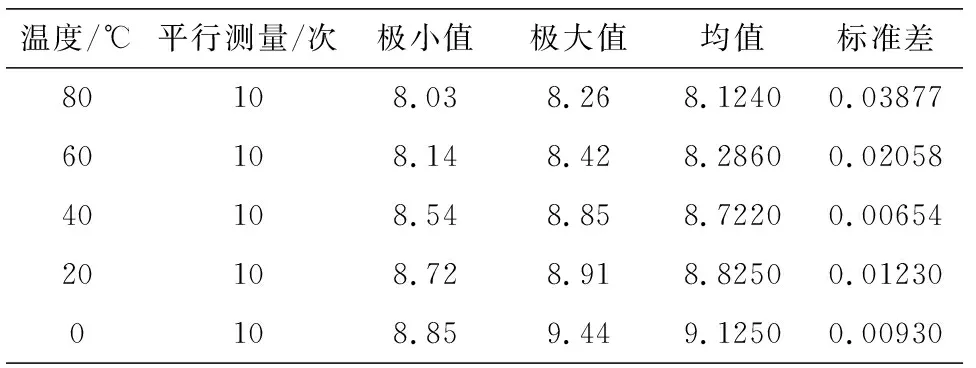
表3 不同温度下pH分析数据结果

图3 温度、pH值交互式图像(回归拟合)
2 结论
酸碱滴定是定量实验的一个重要内容[4],那么指示剂作为酸碱滴定过程中发生突跃的“标志性”物质更显的尤为重要,不仅体现在本身的种类、用量上,还关系到外界环境等影响因素,如温度、离子强度[5].实验证明,用量的不同及温度的变化都会影响到指示剂变色点的范围,当溶液
具有相同的吸光度时,随着指示剂滴数的逐渐增加,pH值在变色范围内逐渐减小.随着温度的逐渐降低,pH值在变色范围内逐渐增大.
参考文献:
[1]李晓燕,曾艳丽.关于酚酞变色机理的量子化学探讨[J].大学化学,2010,25(10):34-35.
[2]大连理工大学无机化学教研室.无机化学[M].北京:高等教育出版社,2006.
[3]张奇.SPSS for Windows在心理学与教育学中的应用[M].北京:北京大学出版社,2007.
[4]王彤.仪器分析与实验[M].青岛:青岛出版社,2000.
[5]武汉大学化学与环境科学学院.物理化学实验[M].武汉:武汉大学出版社,2000.

