热激转录因子AtHsfA9在转基因烟草中的功能分析*
高艳霞 贾凤娟 吴炳江 杨国栋
(1. 山东农业大学生命科学学院,山东 泰安 271018; 2. 泰山医学院生物科学学院,山东 泰安 271016)
植物在自然界生长发育过程中,经常遭遇到生物和非生物胁迫因子的伤害。高温胁迫是造成作物产量和品质下降的一个主要原因,而改善作物种子的抗高温能力在生产上具有重要意义。
热激蛋白(heat-shock protein,HSP)又称热休克蛋白或应激蛋白,是细胞在应激原(如高温)刺激下所生成的一类蛋白质[1]。HSP广泛存在于各种生物体内。当植物受到高温胁迫时,高温胁迫转录因子(HSF)会调控热激蛋白发生积累[1-2]。植物中的热激转录因子首先在番茄中克隆到Hsfs基因[3]且目前多对番茄HsfAla、HsfA2和HsfB1进行研究。李春光等[4]对拟南芥热激转录因子HsfA2进行了抗热和抗氧化胁迫等方面的研究,晁旭等[5]对拟南芥热激转录因子HsfA6a进行了细胞定位及耐高温功能分析等方面的研究,而对于拟南芥热激转录因子HsfA9的功能分析尚未见报道。因此,本研究以拟南芥热激转录因子HsfA9为目的基因,利用种子特异启动子At2S3来研究热激转录因子HsfA9在转基因烟草中的功能,为提高作物种子的耐高温能力提供资料。
1 材料与方法
1.1植物材料
拟南芥(Arabidopsisthaliana, Col),生态型为哥伦比亚型Columbia(Col),烟草NC89(Nicotiana tabacum NC89)为校园温室的自交种子,为本实验室所保存。培养条件:短日照为8h光照/16h黑暗,长日照为16h光照/8h黑暗;温度:拟南芥为22℃,烟草为28℃。
1.2菌株与质粒
本研究所用的大肠杆菌菌株为DH5α,根癌农杆菌菌株GV3101,双子叶植物双元表达载体pBI121为本实验室保存。pMD18-T Simple购于TAKARA公司。
1.3目的基因的克隆及表达载体的构建
根据Tair拟南芥信息资源网站上公布的AtHsfA9的基因组序列设计引物(5’-GGATCCACAAGAAATAGAAACGGTGTAGG-3’)和(5’-GAGCTCTTAGTAATGGAAGGCGATGGC-3’),从拟南芥基因组中扩增AtHsfA9目的基因,将其连接到克隆载体pMD18-T Simple上,转化大肠杆菌,进行基因测序。测序正确后,提取质粒,用BamH I和Sac I进行酶切回收,获得目的片段。将目的片段连接到表达载体pBI121上,转化大肠杆菌DH5α,挑取单菌落进行PCR鉴定,检测目的条带正确后,转化根癌农杆菌菌株GV3101获得工程菌株。
1.4烟草的遗传转化
用含有目的基因的根癌农杆菌菌液转化烟草,在含有50 mg/L卡那霉素(Kan)的MS分化培养基及生长培养基来培养愈伤组织并得到转基因苗。收获的T0代种子用MS+50 mg/L卡那霉素(Kan)平板进行筛选,10 d后挑选T1代阳性植株转移到土中,提取基因组DNA,PCR检测转基因植株。T2代选取卡那霉素(Kan)抗性3∶1分离的单基因插入株系,转移到土中培养并收种子。T3代株系中卡那霉素(Kan)抗性不再分离的为单基因插入纯合株系,用作热激转录因子AtHsfA9在转基因烟草中的功能分析。
1.5转基因烟草植株基因组DNA的提取和PCR
从每株上选取叶片,提取基因组DNA,PCR检测转基因植株。用At2S35’引物(5’-CAAACAGTGTGTATACGTACAC-3’)和At2S33’引物(5’-GGATCCTGTTGTCGGGATTATG-3’)进行PCR鉴定;PCR扩增体系为25 μl,反应步骤为:预变性:94℃ 5 min;循环条件:94℃ 30 s,50~60℃ 30 s,72℃ 1~2min;循环30次,后延伸:72℃ 10 min。反应结束后,进行琼脂糖凝胶电泳,以检测是否有目的条带,进行下一步试验。目的条带是1872 bp。
1.6热激转录因子AtHsfA9的表达分析
为了验证热激转录因子AtHsfA9是否响应高温这一非生物胁迫,我们对其进行了高温胁迫条件的诱导表达分析。将生长2周的WT(野生型拟南芥)于45℃分别热激处理0.5 h,1 h,2 h,3 h,4 h和5 h,并以未作处理的WT作为对照组,用液氮进行取材,然后提RNA,去除基因组,用PCR仪进行反转录,然后用real-time PCR检测其表达量。以EF1-α作为内参,AtHsfA95’引物(5’-ACGGAGTTGATACCGAACA-3’)和AtHsfA93’引物(5’-TGTCAGGCTCGGGATTGTGTCAGGCTCGGG-3’)。
1.7转基因烟草对高温胁迫的根系生长试验
将WT(烟草NC89)以及At2S3::AtHsfA9 L2,L3株系纯合体种子消毒后铺在MS培养基上,于4℃冰箱中成层处理,2 d后置于烟草培养箱中,竖直培养。其中,一批在正常培养条件下萌发,作为对照组;一批在45℃高温胁迫下处理12 h后,再于正常培养箱中竖直培养。萌发5 d后,将三种植株转移到MS培养基上培养,15 d后观察其根长生长差异。
2 结果与分析
2.1目的基因片段和表达载体的鉴定
如图1所示,构建的克隆载体用BamH I和Sac I进行酶切回收,得到1258 bp的目的基因片段(图1,A);将含有AtHsfA9的表达载体pBI121的大肠杆菌DH5α进行菌液PCR鉴定,得到1258 bp的目的条带(图1,B),与目的片段的大小一致,表明构建的载体正确。
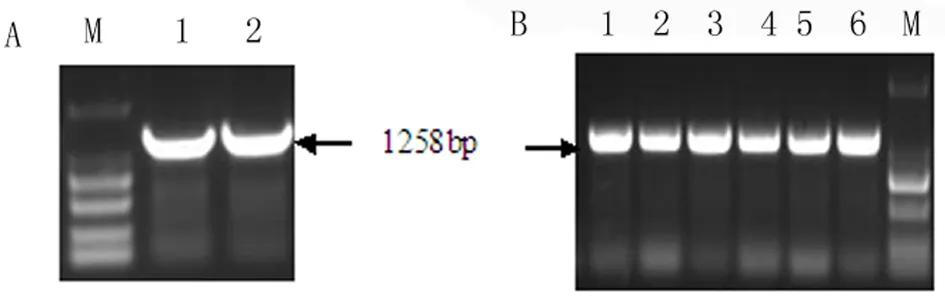
图1 目的基因片段及其表达载体的鉴定
A:M:Marker 2000,1~2:2个重复扩增的目的片段 B:M:Marker 2000,1~6:表达载体的菌液PCR
2.2转基因烟草T3代株系的PCR鉴定
如图2所示,利用At2S35’引物和AtHsfA93’引物来检测转基因烟草株系,得到超表达的转基因AtHsfA9 的PCR产物片段1872 bp(见图2),和预期相符,说明得到转基因株系的纯合体,可以进行进一步的功能分析。
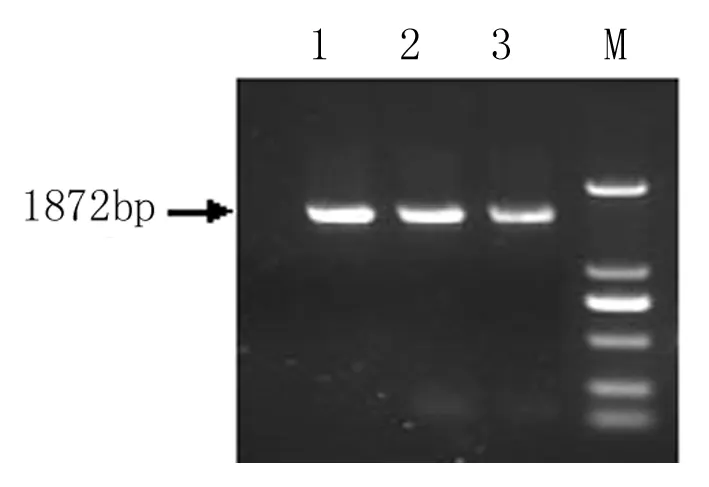
图2 At2S3::AtHsfA9转基因烟草T3代株系的PCR鉴定
M:DNA Marker 2000;1~3:超表达转基因植株
2.3热激转录因子AtHsfA9响应高温胁迫
热激转录因子AtHsfA9确实能响应高温这一非生物胁迫。结果如图3所示,热激转录因子AtHsfA9在45℃热激时,其表达量开始上升。AtHsfA9在热激处理0.5 h,1 h,2 h,3 h,4 h和5 h后,其表达量与未作处理的WT相比分别上升了4.5,6.2,15.0,34.6,27.0和10.4倍。
这个结果说明,对野生型拟南芥进行热激处理时,热激转录因子AtHsfA9的表达量先升高后降低。在热激处理3h时其表达量最高,与未热激处理时相比提高了34.6倍。由此可知,高温胁迫能不同程度的上调AtHsfA9的表达量(图3),说明AtHsfA9参与调控植物对抗高温胁迫,热激转录因子AtHsfA9确实能响应高温胁迫。如果在植物中利用转基因技术超表达AtHsfA9,则可使转基因植物具有抗高温及抗高温能力,由此可以改良植物,提高植物对抗高温胁迫的能力。
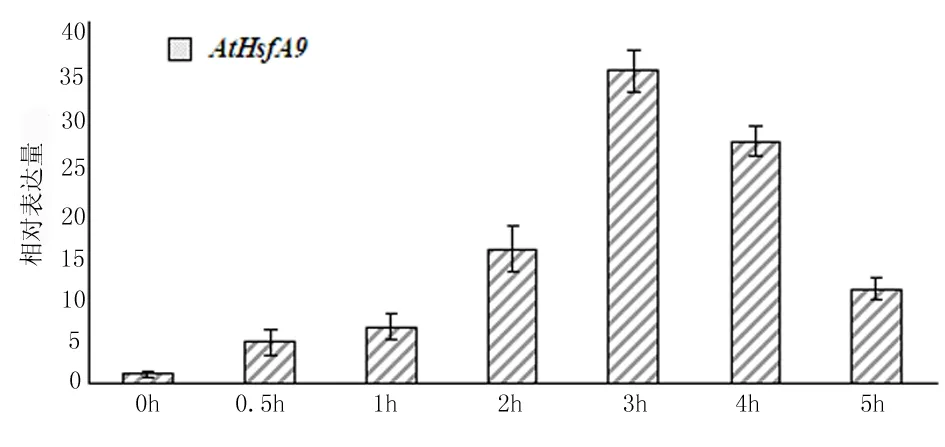
图3 At2S3::AtHsfA9的诱导表达分析
AtHsfA9受到高温胁迫条件的诱导,0h的表达量定义为1.0,以EF1-α作为内参计算相对表达量。
2.4转基因烟草的根系生长耐热性分析
将WT(烟草NC89)和At2S3::AtHsfA9 L2、L3转基因烟草株系纯合体种子分别用70%的乙醇和2.6%的安替福民进行消毒,用吐温水洗5~6遍,铺在MS培养基上,于4℃冰箱中成层处理,2 d后置于烟草培养箱中,竖直培养。其中,一批在正常培养条件下萌发生长,作为对照组;一批45℃热激处理12 h后再置于正常培养箱中萌发生长。萌发5 d后,将几种植株转移到MS培养基上继续培养,15 d后观察根系生长情况。试验结果表明,在正常培养条件下, At2S3::AtHsfA9转基因株系的根长与WT相比缩短37%。在45℃热激处理12 h后,转基因株系和WT的根长与正常对照组相比均变短, At2S3::AtHsfA9转基因株系的根长与WT相比缩短19%(图4)。以上结果说明,超表达At2S3::AtHsfA9烟草株系的根系生长与WT相比对热激处理呈现出更高的抗性。
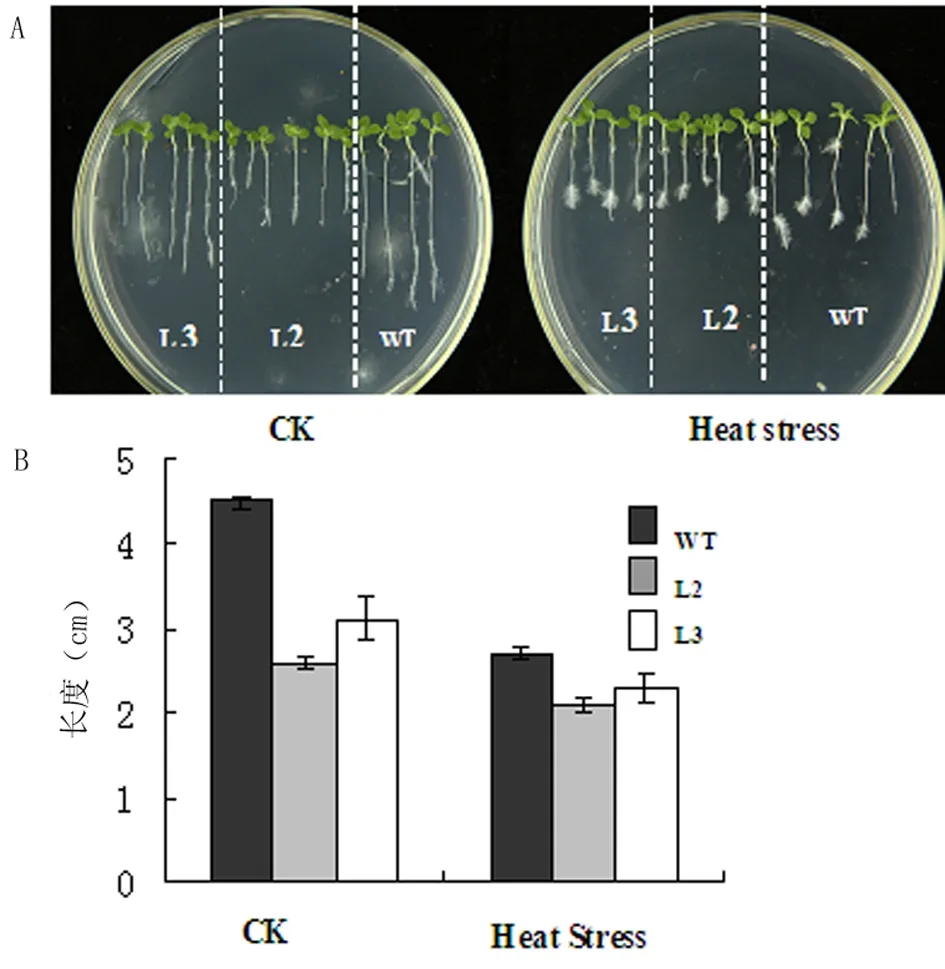
图4 At2S3::AtHsfA9根长试验
3 讨 论
非生物胁迫引起的应答常常相互关联而又非常复杂,比如植物细胞缺水有可能是由高温、低温、干旱、高盐、重金属等胁迫引起的,而缺水会使细胞的水分平衡紊乱,甚至于引起蛋白质等大分子变性,破坏植物细胞内的膜结构等。植物在长期的演变进化中产有多种多样的抗逆性机制[6-7]。由于分子生物学的发展,植物抗逆机理已在基因组成、表达调控及信号转导等分子水平上有所认识[8-9]。细胞感受逆境信号,传导逆境刺激,可以使植物激活一系列分子途径,从而调控相关基因表达和生理反应,使植物在逆境中获得抗逆性,其正常的生长发育从而得以维持[9-10]。 植物会通过各种途径忍受或抵抗非生物胁迫,其中一个主要的方式是各种抗非生物胁迫基因的表达。基因表达受其上游启动子及转录因子的调控,目前对抗非生物胁迫诱导启动子顺式作用元件及转录因子的研究成为热点。
本试验以拟南芥热激转录因子AtHsfA9为目的基因,来探讨其在转基因烟草中的功能。从试验结果上来看,热激转录因子能在高温胁迫条件下上调其基因表达量,说明热激转录因子AtHsfA9有高温胁迫抗性。同时本试验第一次利用种子特异启动子At2S3驱动热激转录因子在种子中超表达,得到的转基因烟草在种子的幼苗根长表现较高的抗高温胁迫的能力。这一结果为种子特异启动子可以在植物的早期发育时期发挥调控作用提供了依据,同时为种质在分子生物学方法的改良奠定了一定的基础。
[1] Wang W, Vinocur B, Shoseyov O, et al. Role of plant heat shock proteins and molecular chaperones in the abiotic stress response[J]. Trends Plant Sci, 2004, 9: 244-252.
[2] Nakamoto H, Vigh L. The small heat shock proteins and their clients[J]. Cell Mol Life Sci, 2007, 64: 294-306.
[3] Scharf K D, Rose S, Zott W, et al. Three tomato genes code for heat stress transcription factors with a region of remarkable homology to the DNA-binding domain of the yeast HSF[J]. EMBO J, 1990, 9: 4495-4501.
[4] 李春光, 陈其军, 高新起,等. 拟南芥热激转录因子AtHsfA2调节胁迫反应基因的表达并提高热和氧化胁迫耐性 [J].中国科学C辑:生命科学, 2005, 48(6): 540- 550.
[5] 晁旭,王东平,巩振辉,等.拟南芥热激转录因子耐高温功能分析[J].西北植物学报,2007,27(7): 1305-1310.
[6] Xiong L, Schumaker K S, Zhu J K. Cell signaling during cold, drought, and salt stress[J]. Plant Cell, 2002, 14: 165-183.
[7] Hu H, You J, Fang Y, et al. Characterization of transcription factor gene SNAC2 conferring cold and salt tolerance in rice[J]. Plant Mol Biol, 2008, 67:169-181.
[8] Gilmour DS, Thomas GH. Drosophila nuclear proteins bind to regions of alternating C and T residues in gene promoters[J]. Science, 1989, 254: 1487-1490.
[9] Thomashow MF. PLANT COLD ACCLIMATION: Freezing Tolerance Genes and Regulatory echanisms[J]. Annu Rev Plant Physiol Plant Mol Biol, 1999, 50, 571-599.
[10] Gilmour DS, Thomas GH. Drosophila nuclear proteins bind to regions of alternating C and T residues in gene promoters[J]. Science, 1989, 254: 1487-1490.

