硫辛酸对高脂日粮小鼠脂代谢紊乱及氧化应激的调节作用
李龙囡 , 王艳艳 , 尹彩娜 , 王舒平 , 孙 进 , 乐国伟 1,, 施用晖 *1,
(1.食品科学与技术国家重点实验室,江南大学,江苏 无锡214122;2.江南大学 食品学院,江苏 无锡 214122)
脂类是机体重要的营养和能量物质,但长期高脂膳食将导致机体氧化应激,氧化应激是引发高血脂症、动脉粥样硬化及肥胖等代谢疾病的根源[1-3]。脂代谢过程涉及载脂蛋白、脂蛋白受体等,而脂蛋白脂酶(LPL)和肝脂酶(HL)作为脂蛋白代谢中的两个关键酶,在脂代谢中发挥着重要的调控作用[4]。此外,载脂蛋白 E(apolipoproteinE,ApoE)作为血浆主要的载脂蛋白之一,与血浆脂蛋白代谢,LDL、CM残粒进入肝细胞代谢相关[5]。肉碱棕榈酰转移酶(carnitine palmitoyltransferaseIa,Cpt1a) 是脂肪酸氧化过程中的一种限速酶[6],它催化长链脂酰辅酶A与肉碱合成脂酰肉碱,并转运至线粒体基质而被氧化分解,在能量代谢中起重要作用。
已有研究证明,抗氧化剂硫辛酸(LA)能缓解高脂日粮导致的氧化应激及血脂代谢紊乱[7-8],而进一步研究LA对血浆脂酶活性及ApoE、Cpt1a mRNA表达的影响,有助于深入认识机体氧化还原状态对脂代谢的调节作用,为高脂引发的血脂紊乱机制研究提供理论依据。
1 材料与方法
1.1 主要试剂及仪器
硫辛酸:江苏常熟富士莱医药化工有限公司;总抗氧化能力(T-AOC)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-px)和丙二醛(MDA),总胆固醇(TCH)、甘油三酯(TG)、高低密度脂蛋白胆固醇(HDL-C、LDL-C),脂蛋白脂酶(LPL)及肝脂酶(HL)试剂盒:南京建成生物工程研究所;Trizol:Invitrogen公司;荧光染料Evagreen:Biotium公司;冷冻高速离心机:eppendurgh公司;ABI-7000荧光定量 PCR仪。
1.2 动物实验的设计
清洁级C57BL/6雄性小鼠40只,预饲1周后,根据体重随机分为4组:对照组(正常日粮),高脂组(高脂日粮,含20.0%脂肪),LA组(高脂日粮分别添加0.05%和0.1%LA)。正常日粮和高脂日粮配方见表1。小鼠同室分笼饲养,光暗周期12 h,自由采食和饮水,每周称一次体重。环境温度控制在(23±2)℃,湿度60%,小鼠饲养6 w后处死。
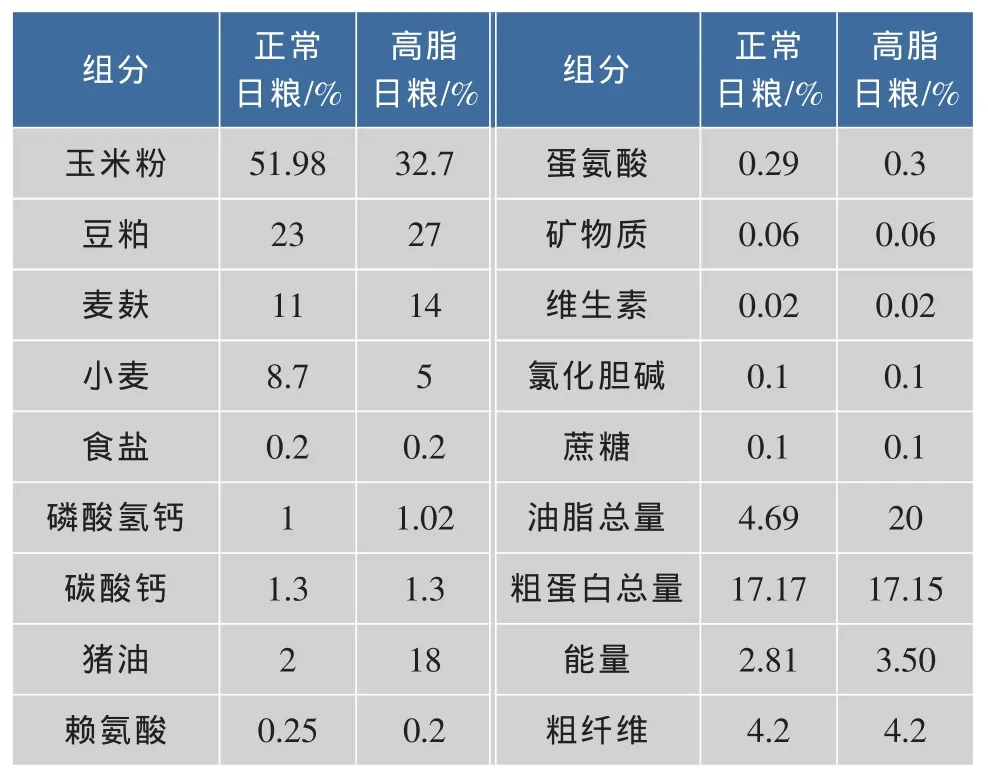
表1 正常日粮和高脂日粮配方Table 1 Compositions of normal and high fat diet
1.3 血样及组织样品采集
小鼠饲喂6周后眼球取血,放入抗凝管测定全血ROS水平,其余离心于(4℃、3 000 r/min离心10 min),取上层血浆于-20℃保存备用。
断颈椎处死小鼠后,取肝脏、胰腺、胃、十二指肠、空肠及回肠迅速在预冷的生理盐水中漂洗除去血液,滤纸拭干,精确称重相同部位组织,加入预冷的生理盐水于冰浴下匀浆制得10 g/dL组织匀浆,测ROS水平,其余组织匀浆于-20℃保存备用。取0.1 g肝脏组织迅速加入trizol中,-80℃保存以备RNA提取。
1.4 指标的检测
1.4.1 全血及组织自由基水平的测定 参照luminol化学发光法[9-10]测定,使用MPI-B型多参数化学发光检测仪检测,发光强度表示自由基水平。
1.4.2 血浆和组织匀浆中酶活测定 肝脏中过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-px)、丙二醛(MDA)和总抗氧化能力(T-AOC),血浆中脂蛋白脂酶(LPL)及肝脂酶(HL)活性及血脂指标均严格按照试剂盒说明书进行操作。
1.4.3 肝脏组织ApoE、Cpt1a的RT-PCR检测 一步法提取肝脏总RNA、反转录。RT-PCR:通过NCBI中查出小鼠ApoE、Cpt1a的基因全序列,应用Primer5.0引物设计软件设计引物,由上海生工生物工程技术服务有限公司合成,引物序列见表2。用ABI-7000定量PCR仪,进行Real-time RT-PCR扩增。 PCR 反应体系(25 μL):10×PCR 缓冲液(含 1.5 mmol/L Mg2+)2.5 μL,10 mmol/L dNTP 0.5 μL,10 μmol/L 上下游引物各 1 μL,cDNA 模板 2 μL,Taq 酶(5 U/μL)0.25 μL,无菌水 16.5 μL,SYBR green(20×)1.25 μL。PCR 扩增条件:94℃变性 3 min,55℃退火1 min,72℃延伸75 s为第一个循环。94℃变性30 s,55℃退火45 s,72℃延伸1 min为第二个循环,共30个循环。终末72℃延伸10 min。检测各模板的Ct值,通过Ct值进行相对定量。
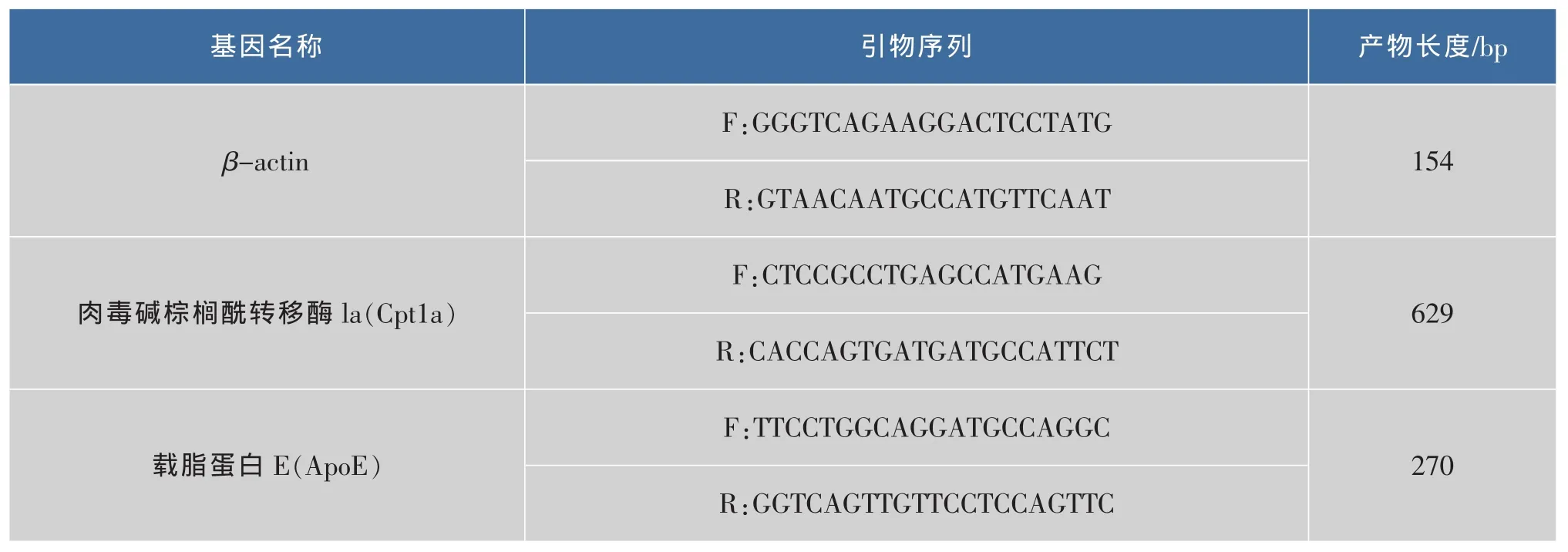
表2 β-actin、Cpt1a和ApoE引物序列Table 2 Sequence of the primers for β-actin、Cpt1a and ApoE (F:Forward;R:Reverse)
1.5 数据处理和统计分析
2 结果与分析
2.1 高脂日粮和LA对小鼠体重的影响
高脂组小鼠体重6w后显著(P<0.05)高于正常组。在高脂日粮中添加0.05%LA,与高脂组相比,体重有所下降,但差异不显著,而添加0.1%LA体重显著降低(P<0.05),结果见表 3。
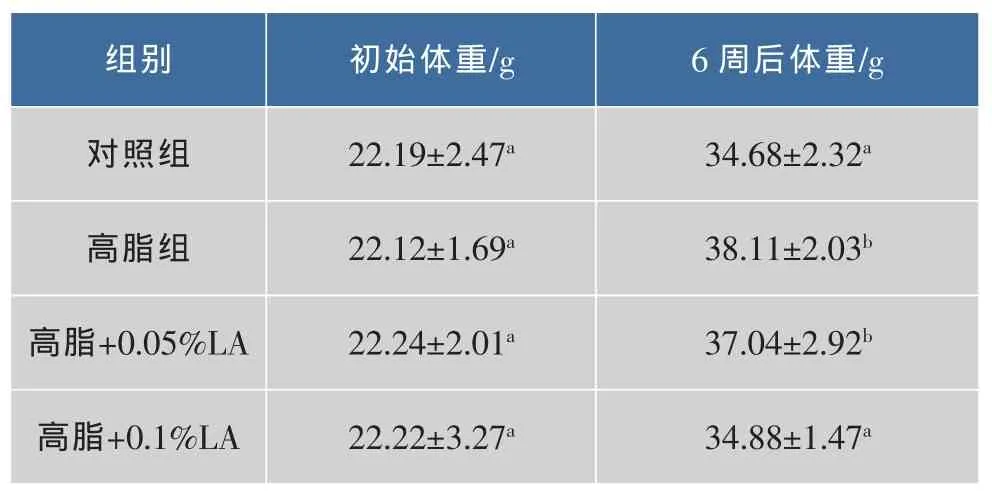
表3 小鼠体重变化Table 3 Change of body weight
2.2 LA对高脂日粮小鼠全血和各组织氧化还原状态的影响
与正常组相比,高脂组小鼠肝脏、胰腺、胃、十二指肠、空肠及回肠ROS水平显著(P<0.05)升高,见表4。其中以十二指肠、空肠最为显著。而添加0.05%LA有降低各组织ROS水平的趋势,添加0.1%LA则使其自由基显著降低(P<0.05),并接近对照组水平。
表4 高脂日粮和LA对小鼠全血及组织自由基的影响Table 4 Effect of LA and high-fat on free radicals in whole blood and tissues of mice (n=8,±s)

表4 高脂日粮和LA对小鼠全血及组织自由基的影响Table 4 Effect of LA and high-fat on free radicals in whole blood and tissues of mice (n=8,±s)
注:不同组之间字母不同表示差异显著(P<0.05)。
组织 对照组全血(103cd/μL) 0.11±0.03a肝脏(103cd/mg) 5.81±1.30a胃(103cd/mg) 4.02±1.28a胰腺(103cd/mg) 4.20±1.50a十二指肠(103cd/mg) 8.71±2.25a空肠(103cd/mg) 8.04±1.68a回肠(103cd/mg) 4.07±1.99a高脂组0.30±0.09b 9.85±3.22b 6.35±0.62b 8.50±2.10b 20.53±2.65b 12.23±1.17b 8.48±2.29b高脂+0.05%LA 高脂+0.1%LA 0.23±0.05b 0.11±0.05a 7.06±2.80b 4.92±1.80a 5.09±0.81ab 4.15±0.62a 5.90±2.30ab 4.20±2.00a 16.78±1.05b 9.57±2.50a 10.04±0.76b 7.97±1.50a 8.38±1.92b 3.36±1.52a
高脂日粮和LA对小鼠肝脏抗氧化酶活性和总抗氧化能力的影响见表5。与正常组相比,高脂组GSH-Px、CAT 及 T-AOC 显著下降 (P<0.05)。 添加0.1%LA,小鼠肝脏抗氧化能力都显著 (P<0.05)升高,而添加0.05%LA则效果不显著。
表5 高脂日粮及LA对小鼠肝脏氧化还原状态的影响Table 5 Effect of LA on liver antioxidant index of high-fat fed mice(n=8,±s)
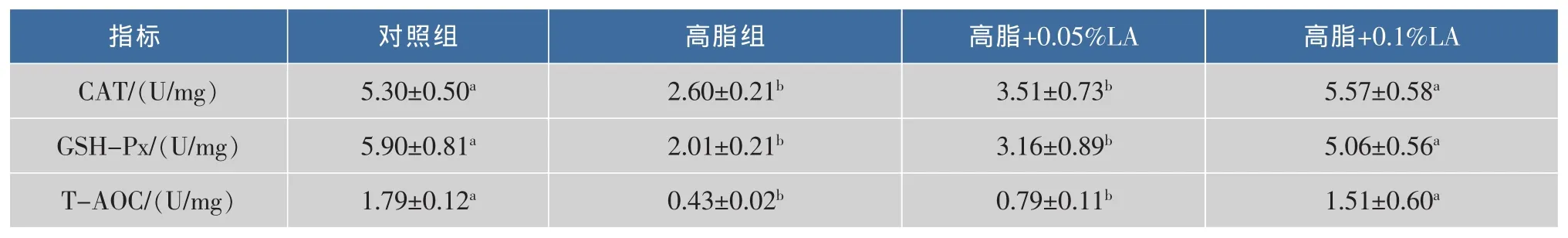
表5 高脂日粮及LA对小鼠肝脏氧化还原状态的影响Table 5 Effect of LA on liver antioxidant index of high-fat fed mice(n=8,±s)
注:不同组之间字母不同表示差异显著(P<0.05)。
CAT/(U/mg) 5.30±0.50a GSH-Px/(U/mg) 5.90±0.81a T-AOC/(U/mg) 1.79±0.12a高脂+0.05%LA 高脂+0.1%LA 3.51±0.73b 5.57±0.58a 3.16±0.89b 5.06±0.56a 0.79±0.11b 1.51±0.60a指标 对照组 高脂组2.60±0.21b 2.01±0.21b 0.43±0.02b
2.3 LA对高脂日粮小鼠肝脏及血浆MDA含量的影响
高脂日粮摄入可显著(P<0.05)提高小鼠血浆及肝脏MDA含量,造成脂质过氧化,在高脂日粮基础上添加0.1%LA可显著降低小鼠血浆及肝脏中MDA 含量(P<0.05),而添加 0.05%LA 则效果不显著,见图1。
2.4 LA对高脂日粮小鼠血脂的影响
由表6可知,与正常组相比,高脂组小鼠血浆中TCH、TG、LDL-C含量均显著增高,HDL-C显著降低(P<0.05)。添加0.1%LA可显著改善高脂导致的血脂异常,而0.05%LA的添加量作用不显著。高脂组动脉粥样硬化指数(AI)显著高于正常组,且高达正常组的3倍多,而添加0.1%LA则可显著降低AI值(P<0.05),添加 0.05%LA 有降低的趋势但不显著。
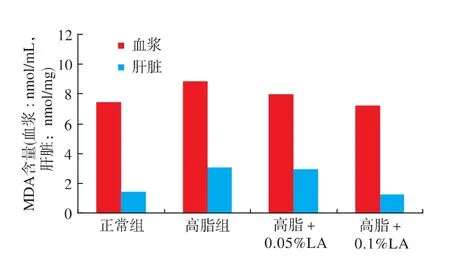
图1 高脂日粮及LA对小鼠血浆和肝脏MDA含量的影响Fig.1 Effect of LA on live and plasma MDA in high-fat fed mice
表6 LA对高脂日粮小鼠血脂水平的影响Table 6 Effect of LA on plasma lipid in high-fat fed mice(mmol/ml)(n=8,±s)

表6 LA对高脂日粮小鼠血脂水平的影响Table 6 Effect of LA on plasma lipid in high-fat fed mice(mmol/ml)(n=8,±s)
注:不同组之间字母不同表示差异显著(P<0.05)。
组别 TG对照组 1.28±0.22a高脂组 2.00±0.11b高脂+0.05%LA 1.42±0.29ab高脂+0.1%LA 1.28±0.36a TCH 2.07±0.45a 3.43±0.19b 2.41±0.31ab 2.33±0.14a LDL-C 0.87±0.07a 1.30±0.16b 1.29±0.04b 0.97±0.07a HDL-C 0.56±0.11a 0.35±0.06b 0.38±0.04b 0.54±0.04a AI 1.35±0.58a 4.80±1.32b 2.77±0.82b 1.63±0.90a
2.5 LA对高脂日粮小鼠血浆LPL、HL活性的影响
高脂组小鼠与正常组相比,血浆肝LPL、HL的活性均显著降低(P<0.05),见表 7。添加 0.05%LA 有提高其活性的趋势,但不显著;0.1%的添加量作用显著(P<0.05),可使其恢复接近正常组。
表7 LA对高脂日粮小鼠血浆LPL和HL活性的影响Table 7 Effect of LA on plasma LPL、HL in high-fat fed mice(n=8,±s)
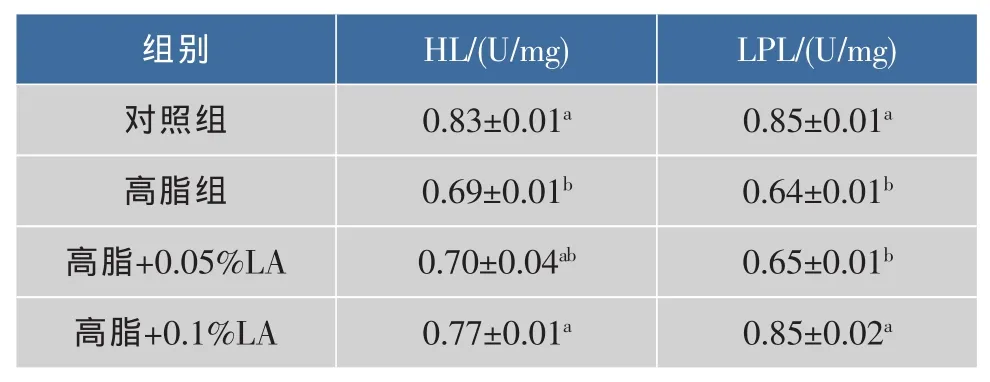
表7 LA对高脂日粮小鼠血浆LPL和HL活性的影响Table 7 Effect of LA on plasma LPL、HL in high-fat fed mice(n=8,±s)
组别 HL/(U/mg)对照组 0.83±0.01a高脂组 0.69±0.01b高脂+0.05%LA 0.70±0.04ab高脂+0.1%LA 0.77±0.01a LPL/(U/mg)0.85±0.01a 0.64±0.01b 0.65±0.01b 0.85±0.02a
2.6 LA对高脂日粮小鼠肝脏Cpt1a及ApoE表达的影响
由图2可知,与正常组相比,高脂组小鼠肝脏ApoE mRNA的表达显著上调,而Cpt-1a mRNA表达显著下调(P<0.05)。在高脂日粮中添加0.05%LA即可显著(P<0.05)下调ApoE mRNA的表达,添加量达到0.1%,可使其表达量接近于对照组。高脂日粮中添加0.1%LA可显著(P<0.05)上调Cpt1a mRNA表达量,而添加0.05%LA后上调作用不显著。

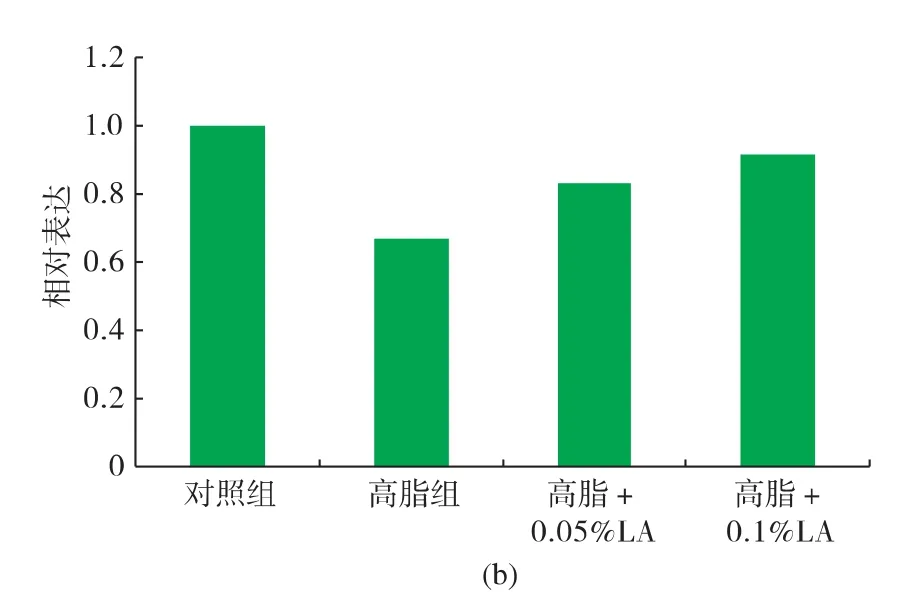
图2 高脂日粮及LA对小鼠肝脏ApoE及Cpt1a mRNA表达的影响Fig.2 Effects of LA on expression of ApoE (a)and Cpt1a(b) mRNA in liver of mice fed with high-fat diet
3 结语
氧化损伤与能量代谢之间存在着显著的相互作用,长期高脂饮食使代谢水平增高,细胞耗氧增加,ROS过量,过量的活性氧会引起蛋白质、脂肪等生物大分子的氧化损伤,损害肝细胞的完整性从而影响脂质代谢[11],所以氧化应激是肥胖、糖尿病等慢性疾病发生的根源之一[12]。在本研究中,高脂日粮导致小鼠氧化应激,各组织自由基水平显著升高,肝脏CAT、T-AOC和GSH-Px含量较正常组明显下降,脂质过氧化产物MDA显著升高,通过降低血浆HL和LPL活性导致脂代谢紊乱,而添加0.1%LA可明显改善这种脂代谢紊乱,缓解氧化应激。LA是脂溶和水溶的两性分子[13],这使其能以较高的浓度存在于细胞内外,发挥清除自由基的作用,同时能与VE和Vc的氧化还原反应耦连,使其发挥抗氧化作用,缓解机体营养性氧化应激。从而降低TG、TCH和LDL,并提高HDL,调节脂质代谢紊乱,这与国外的研究结果一致[14]。
线粒体是体内产能的主要场所,能量产生主要通过脂肪酸β-氧化和葡萄糖代谢。在脂肪酸β氧化过程中,Cpt1a是其中的一种限速酶,能够根据组织的能量需求调整脂肪酸氧化。生理情况下,Cpt1a表达受丙二酰辅酶A的抑制,而丙二酰辅酶A的合成又受乙酰辅酶A羧化酶(ACC)的调节;高脂饮食可以通过诱导ACC的活化及增加丙二酰辅酶A的浓度而抑制Cpt1a的表达[6]。Cpt1a mRNA水平降低将影响脂肪酸转运入线粒体进行β-氧化实现能量生成,使已进入细胞的脂肪酸及其活化产物脂酰辅酶A沉积在胞质内,造成大量脂质堆积[15],从而机体出现脂代谢紊乱。另一方面,血脂、胆固醇的增加可减少脂肪酸进入线粒体,防治自由基的生成。本实验中,在高脂日粮中添加0.1%LA可显著降低ROS水平,使小鼠肝脏Cpt1a表达显著上调,增强脂肪酸β氧化,缓解高脂引起的血脂异常。
载脂蛋白E在脂代谢循环中作为一种血清糖蛋白配体,主要存在于乳糜微粒及其残体、极低密度脂蛋白、高密度脂蛋白亚群颗粒中,通过与LDL受体及其相关蛋白、VLDL受体相互作用帮助血浆中脂蛋白脂解与清除,并调控VLDL和TG的浓度,在胆固醇和脂蛋白代谢中发挥关键作用,是脂类代谢和心血管疾病的决定因子[5]。有趣的是,高脂饲喂小鼠肝脏ApoE表达显著高于正常组,血浆TG含量显著升高,而添加10%LA干预后ApoE表达量显著降低。有临床研究表明血浆TG水平变化有20%到40%与ApoE有关。在ApoE基因缺陷小鼠的体内外实验中发现,其肝细胞分泌的VLDL的TG含量较野生型小鼠显著减少,如果肝脏ApoE表达增加,则可使VLDL的TG含量增加。转入ApoE3于ApoE缺陷型小鼠中,使其高水平表达,可使血浆TG含量比正常高3倍。这可能是由于高水平的ApoE刺激VLDL中TG合成增加及特异地抑制LPL对TG的水解所致[16]。本实验也发现高脂饮食小鼠LPL活性显著降低。ApoE与血浆胆固醇含量也密切相关,ApoE参与介导VLDL和CM残粒的清除。而据报道,在敲除LDL受体基因小鼠中利用腺病毒使ApoE表达增加,可使血浆胆固醇水平显著降低[17]。但也有研究用腺病毒转载ApoE于ApoE敲除小鼠中,发现即使低水平的ApoE表达也能使其血胆固醇降低。如果同时敲除ApoE和LDL受体基因,则只有中等水平ApoE表达才能使胆固醇水平下降[18]。ApoE对脂代谢的影响还有待深入研究。
综上所述,本研究证实了LA对小鼠脂代谢紊乱,氧化应激的改善作用,初步推测这种作用可能是通过改善小鼠肝脏Cpt1a和ApoE的表达实现的,至于具体的机制有待进一步的研究。
[1]Auer J,WeberT,Berent R,et al.Obesity,body fat and coronary atherosclerosis[J].Int J Card,2005,98:227-235.
[2]Weintraub W S.Is atherosclerotic vascular disease related to a high-fat diet?[J].Clin Epid,2002,55:1064-1072.
[3]Grattagliano I,Palmieri V O,Portincasa P,et al.Oxidative stress-induced risk factors associated with the metabolic syndrome:a unifying hypothesis[J].Nutr Bioch,2007:1-14.
[4]Hans Jansen,Belinda Breedveld,Kees Schoonderwoerd.Role of lipoprotein lipases in postprandial lipid metabolism[J].Atherosclerosis,1998,141:31-34.
[5]Philip W,Connelly.The role of hepatic lipase in lipoprotein metabolism[J].Clinica Chimica Acta,1999,286:243-255.
[6]ZANG Yan,WANG Tong,XIE Wei-sheng,et al.Regulation of AcetylCoA carboxylase and carnitine palmitoyl transferase-1 in ratadipocytes[J].Obesity Research,2005,13:1530-1539.
[7]YANG Rui-Li,LE Guo-wei,LI An-lin,et al.Effect of antioxidant capacity on blood lipid metabolism and lipoprotein lipase activity of rats fed a high-fat diet[J].Nutr,2006,22:1185-1191.
[8]Navari-Izzo F,Quartacci M F,Sgherri C.Lipoic acid:a unique antioxidant in the detoxification of activated oxygen species[J].Plant Physiol Biochem,2002,40:463-470.
[9]Esfandiari N.Utility of the nitroblue tetrazolium reduction test for assessment of free radical production by seminal leukocytes and spermatozoa[J].Andrology,2003,24:862-869.
[10]LI Y,ZHU H,Michael A.Detection of mitochondria-derived free radical production by the chemilumigenic probes lucigenin and luminol[J].Biochim Biophys Acta,1999,1428:1-12.
[11]鲁军,任迪锋.钝顶螺旋藻的体内抗氧化和护肝作用[J].食品与生物技术学报,2009,28:777-780.LU Jun,REN Di-feng.Antioxidant and hepato-protective effect of Spirulina platensis in vivo[J].Journal of Food Science and Biotechnology,2009,28:777-780.(in Chinese)
[12]Yorek M A.The role of oxidative stress in diabetic vascular and neural disease[J].Free Radic Res,2003,37:471-480.
[13]海春旭.自由基医学[M].西安:第四军医大学出版社,2006:321-324.
[14]Butler J A,Hagen T M,Moreau R.Lipoic acid improves hypertriglyceridemia by stimulating triacylglycerol clearance and down regulating liver triacylglycerols ecretion[J].Arch Biochem Biophys,2009,485(1):632-711.
[15]Ashakumary L,Rouyer I,Takahashi Y,et al.Sesamin,a sesame lignan,is a potent inducer of hepatic fatty acid oxidation in the rat[J].Metabolism,1999,48:1303-1313.
[16]Van E M,Van D K W,Herijgers M,et al.Eseential role for the (hepatic)LDL receptor in macrophage apolipopritein E-induction in serum cholesterol lecels and atherosclerosis[J].Atherosclerosis,2001,154(1):103-112.
[17]Ichipsuga J,Yonemoto M,Yamada N,et al.Cholesterol lowering in low density lipoprotein receptor knockout mice overexpressing apolipoprotein E[J].Clin Invest,1998,102(2):386-394.
[18]Van D K W,Bart J M,Van V,et al.In LDL receptor-deficient mice,catabolism of remnant lipoprotein requires a high lebels if apoE but is inhibited by excess apoE[J].J Lipid Res,1999,40:336-344.

