草果提取物对金黄色葡萄球菌抑菌机制的初探
彭美芳,陈文学,李宇真,童惠珠,仇厚援
(海南大学食品学院,海南海口570228)
草果(Amomum tsao-ko)为姜科豆蔻属多年生草本植物,全株具有辛香味,目前主要分布于我国广西、云南及贵州等地。干燥成熟的草果果实是日常生活中必备的食用香料,又是我国一种传统的中药材,具有温中、健胃、消食、顺气的功能,常被用于镇痛、抗胃溃疡、抗癫痫、抗乙肝病毒,治疗寒湿内阻及吐泻等症[1]。目前,对草果的研究主要包括挥发油的提取[2-4],化学成分的分析[4]以及草果活性成分的分离[5-6]等方面。有文献报道,常规溶剂提取法、水蒸气蒸馏法、超临界CO2流体萃取技术[2]、超声波提取法[3]、微波萃取技术[4]等均已被用于草果挥发油的提取,由于品种和地区的差异,经GC/MS和毛细管气相色谱法的测定,挥发油在含量和化学成分方面不尽相同,但其主成分均为1,8-桉油精。天然存在的草果植物中含有多种生物活性物质,具有抑菌[7]、抗氧化[8]等作用。许多植物提取物对微生物都具有较强的抑制作用,其抗菌作用机理大致可以分为:降解细胞壁[9]、破坏细胞质膜[10]、破坏膜蛋白[11]、胞内成分渗出、胞质凝结[12]、分子主动运输力损耗[13]。大量研究表明草果提取物抑菌效果显著,对革兰氏阴性菌,革兰氏阳性菌以及霉菌均具有不同程度的抑菌作用,尤其对金黄色葡萄球菌,抑制效果最佳[5],但有关草果的抑菌机制方面尚无研究。本实验参考已有的草果抑菌物质提取工艺[5],测定草果各极性梯度萃取物的最小抑菌浓度(M IC),研究草果提取物对金黄色葡萄球菌的抑菌作用,以初步探讨草果提取物的抑菌机理,为草果提取物的进一步开发利用提供依据。
1 材料与方法
1.1 材料与仪器
草果 购自于海口旺佳旺超市;金黄色葡萄球菌 由海南大学食品学院微生物实验室提供;乙醇、石油醚、氯仿、乙酸乙酯、正丁醇等试剂 均属于分析纯,购自天津市富宇精细化工有限公司。
FW 177型中草药粉碎机 天津市泰斯特仪器有限公司;WF-300EH型超声清洗机 宁波海曙五方超声设备有限公司;RE52CS型旋转蒸发仪 上海亚荣生化仪器厂;ZHWY-211B型恒温培养振荡箱 上海智诚分析仪器制造有限公司;UV-VIS 美国Thermo Fisher Scientific公司;TG16-WS型台式高速离心机 长沙平凡仪器仪表有限公司;DDS-307型电导率测定仪 上海隆拓仪器设备有限公司。
1.2 实验方法
1.2.1 草果抑菌物质的分离萃取[5]草果粉末→浸泡→超声处理→抽滤→旋蒸→液-液萃取→旋蒸→干燥→样品。
草果粗提物的提取工艺参数为:提取溶剂为60%乙醇,料液比1∶16,浸泡时间20h,超声波温度55℃,超声波时间45m in。
采用液-液萃取法对草果粗提物进行分离,以石油醚、氯仿、乙酸乙酯和正丁醇为萃取剂,依次获得石油醚萃取物、氯仿萃取物、乙酸乙酯萃取物和正丁醇萃取物,以下统称为草果提取物。
1.2.2 草果提取物M IC的测定 分别准确称取1.2.1得到的草果提取物2g,用10m L丙酮将草果萃取物配制成200mg/m L的草果提取物原液,用试管二倍递减稀释法[14]将草果提取物原液稀释成100、50、25、12.5、6.25mg/m L的样品液。分别取1m L样品液与9m L融化培养基混匀,配制成含药培养基,以金黄色葡萄球菌为供试菌进行恒温倒置培养24h,并同时做空白对照,以完全不长菌的最低稀释浓度为草果提取物的最小抑菌浓度(MIC)。
1.2.3 草果提取物对细菌生长曲线的影响 以M IC为基础配制含药液体培养基,设置空白组和实验组。取培养至对数期的供试菌液,按5%的接种量加入到含药培养基和空白培养基,摇床培养,每2h取样,在600nm下测定OD值,连续20h。以时间为横坐标,OD值为纵坐标绘制出对应的生长曲线。
1.2.4 草果提取物对菌液蛋白质含量的影响
1.2.4.1 标准曲线的绘制 取6支10m L具塞试管,按下表1取样。盖塞后,将各试管纵向旋转,放置2m in后在595nm波长下测定OD值,并绘制标准曲线。
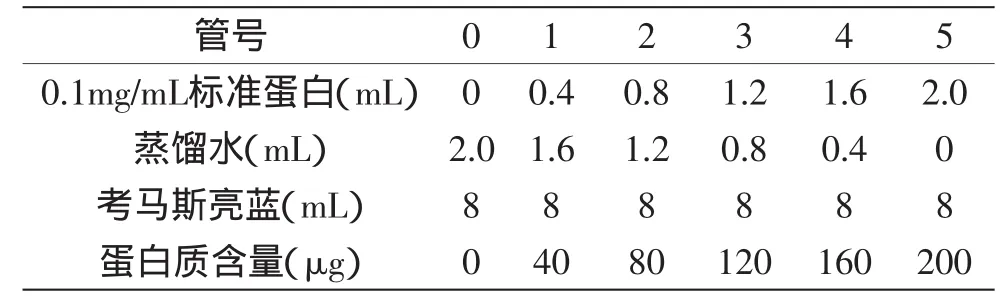
表1 标准曲线制作Table1 The preparation of standard curve
1.2.4.2 处理菌液蛋白含量测定 取经6~8h培养的供试菌液,以M IC为标准加入相应量的草果提取物,同时做空白对照,继续培养,每4h取样,放于4℃保存备用。
取1m L样品以4000r/m in离心10min,取上清液,用蒸馏水将其稀释5倍。取3支10m L具塞试管,每管加入处理菌液0.1m L,再分别加入考马斯亮蓝G-250蛋白试剂,充分混合,2m in后在595nm波长下测定OD值,通过标准曲线查得待测样品的蛋白质含量并进行倍数换算。
1.2.5 草果提取物对菌体电导率的影响 按1.2.3的方法在菌液培养至2、6、10、14、18h时分别取样,4000r/m in离心10m in,取上清液稀释20倍,用DDS-307型电导仪测定其电导率。电导率变化率的公式如下:

式中,R:电导率变化率;Rs:实验组电导率;Rc:对照组电导率。
2 结果与分析
2.1 草果提取物最小抑菌浓度(M IC)

表2 草果提取物对金黄色葡萄球菌的最小抑菌浓度Table2 The MIC of Amomum tsao-ko extract on Staphylococcus aureus
草果乙酸乙酯和氯仿提取物对金黄色葡萄球菌的M IC最低,为1.25mg/m L;其次是石油醚萃取物,为2.5mg/m L;正丁醇萃取物为5mg/m L,MIC最高。
2.2 草果提取物对菌体生长曲线的影响

图1 金黄色葡萄球菌生长曲线Fig.1 The growth curve of Staphylococcus aureus
由图1可以看出,金黄色葡萄球菌空白组经过短暂的延滞期后迅速进入快速生长的对数期,OD值显著增高,石油醚、氯仿和正丁醇萃取物实验组OD值稍有增长,幅度较小,而乙酸乙酯萃取物实验组OD值几乎无增长,与空白组差异显著,表明乙酸乙酯萃取物抑菌效果最佳。同时可以得出,草果提取物的抑菌作用主要表现在生长对数期,通过抑制细菌的分裂速度,缩短或延缓其对数期,从而有效控制菌体数量的增加[15]。
2.3 草果提取物对处理菌液蛋白质含量的影响
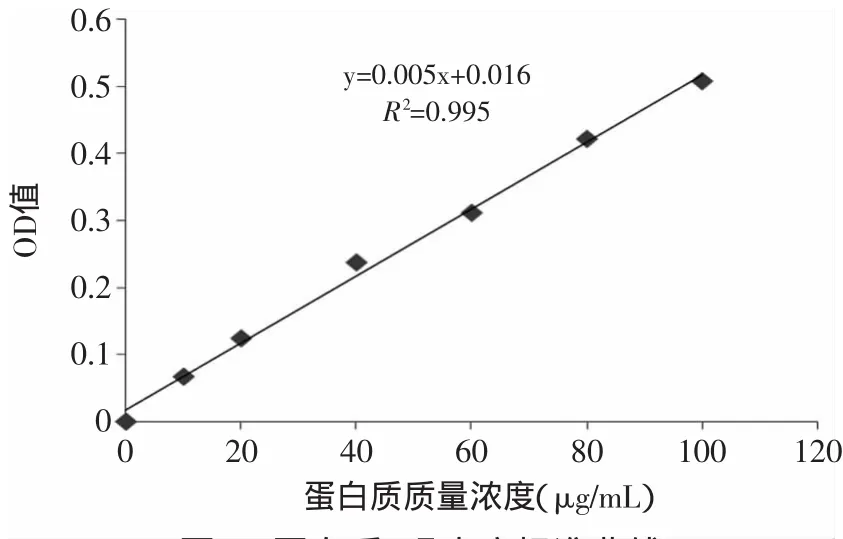
图2 蛋白质-吸光度标准曲线Fig.2 Protein-absorbance standard curve
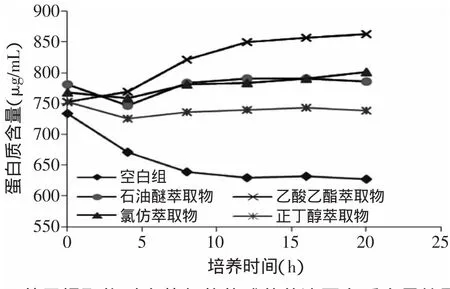
图3 草果提取物对金黄色葡萄球菌菌液蛋白质含量的影响Fig.3 Effect of Amomum tsao-ko extracton bacterium protein content of Staphylococcus aureus
从标准曲线(图2)查得相应样品的蛋白含量见图3。金黄色葡萄球菌空白组菌液蛋白质含量随着时间的延长而降低,石油醚、氯仿和正丁醇萃取物组菌液蛋白质含量在前4h有小幅度降低,之后则呈逐渐上升趋势,而乙酸乙酯萃取物组则直接呈上升趋势。分析原因可能为,草果提取物抑制菌体数量的增长,从而导致菌液蛋白质消耗量降低,另外草果提取物可能使菌体细胞膜破裂,有胞内物质外泄,从而导致培养基中的蛋白质含量增大[16]。
2.4 草果提取物对菌液电导率的影响
由图4得出,随着抑菌物质作用时间的延长,菌液电导率呈上升趋势。其中乙酸乙酯萃取物对菌液电导率影响最大,接着依次为氯仿萃取物,石油醚萃取物,最后为正丁醇萃取物。菌液电导率的改变,可以反映细胞膜渗透性的变化,加入草果提取物,菌液的电导率增加,表明草果提取物可使菌体细胞膜的通透性增加,使菌体细胞质渗漏到了细胞外[17]。分析原因可能是草果提取物诱导产生了某些降解细胞壁和细胞膜的酶所致[18]。
3 结论
本研究测定了草果提取物对金黄色葡萄球菌的M IC,并以M IC为基础,研究了草果提取物对金黄色葡萄球菌生长曲线,菌液蛋白质含量和电导率变化的影响。结果表明,草果抑菌物质主要影响金黄色葡萄球菌生长曲线的对数生长期,有效抑制细菌的增长,其中乙酸乙酯萃取物对金黄色葡萄球菌的抑菌效果最好,氯仿和石油醚萃取物次之,正丁醇萃取物最差。通过对菌液蛋白质含量和电导率变化的测定,推测其抑菌机理可能是草果提取物诱导菌体产生降解细胞壁和细胞膜的酶,提高了膜的通透性,致使胞内物质外泄[19],菌体不能正常生长繁殖,从而达到抑菌作用。

图4 草果提取物对金黄色葡萄球菌菌液电导率的影响Fig.4 Effectof Amomum tsao-ko extracton bacterium conductivity of Staphylococcus aureus
[1]李伟,贾东.草果的无机元素及药理作用[J].中国中药杂志,1992,17(12):727-728.
[2]赵怡,张国英,肖中华,等.超临界CO2流体萃取法提取草果挥发油化学成分的研究[J].中国药学杂志,2004,39(9):705-706.
[3]吴惠勤,黄晓兰,黄芳,等.草果挥发油的气相色谱-质谱指纹图谱[J].质谱学报,2004,25(2):92-95.
[4]杨丽娟,张征,李俊峰,等.云南金平草果精油的微波萃取及化学成分研究[J].中药材,2004,27(11):821-823.
[5]Moon SS,Cho SC,Lee JY.Tsaokoarylone,a cytotoxic diarylheptanoid from Amomum tsao-ko fruits[J].Bull Korean Chem Soc,2005,26(3):447-450.
[6]Moon SS,Lee JY,Cho SC.Isotsaokoin,an antifungal agent from Amomum tsao-ko[J].JNat Prod,2004,67:889-891.
[7]刘小玲.草果抑菌物质提取、防腐应用及安全性评价研究[D].海口:海南大学,2011.
[8]Martin TS,Kikuzaki K,Hisamoto M,et al.Constituents of Amomum tsao-ko and their radical scavenging and antioxidant activities[J].JAm Oil Chem Soc,2000,77(6):667-673.
[9]He Feng,Yang Ying,Yang Guang.Studies on antibacterial activity and antibacterial mechanism of a novel polysaccharide from Streptomyces Virginia H03[J].Food Control,2010,21(9):1257-1262.
[10]Li Xiaofang,Feng Xiaoqiang,Yang Sheng.Chitosan kills Escherichia coli through damage to be of cell membrane mechanism[J].Carbohydrate Polymers,2010,79(3):493-499.
[11]Sato H,Feix JB.Peptide-membrane interactions and mechanisms ofmembrane destruction by amphipathicα-helical antimicrobial peptides[J].Biochimicaet Biophysica Acta(BBA)-Biomembranes,2006,1758(9):1245-1256.
[12]Gustafson JE,Liew S.Effects of tea tree oil on Escherichia coli[J].Letters in Applied Microbiology,1998,26(3):194-198.
[13]Mader SJ,Richardson A,Salsman J.Bovine lactoferricin causes apoptosis in Jurkat T-leukemia cells by sequential permeabilization of the cell membrane and targeting of mitochondria[J].Experimental Cell Research,2007,313(12):2634-2650.
[14]Kawazoe K,YutaniA,Tamemoto K,etal.Phenylnaphthalene compounds from the subterranean part of Vitexrotundifolia and their antibacterial activity against methicillin resistant Staphylococcus aureus[J].JNat Prod,2001,64(5):588-591.
[15]Zeng Weicai,Zhu Ruixue,Jia Lirong,et al.Chemicalcomposition,antimicrobial and antioxidant activities of essential oil from Gnaphlium affine[J].Food and Chemical Toxicology,2011,49(6):1322-1328.
[16]李丽萍.紫茎泽兰提取物对细菌的抑制作用及抑菌机理的研究[D].北京:北京林业大学,2010.
[17]王海涛.大豆异黄酮的抑菌活性及其机制的研究[D].辽宁:辽宁师范大学,2009.
[18]汤雪明,戴书文.生物样品的环境扫描电镜观察[J].电子显微学报,2001,20(3):217-223.
[19]Xing Ke,Chen Xiguang,Kong Ming,et al.Effect of oleoylchitosan nanoparticles as a novel antibacterial dispersion system on viability,membrane permeability and cell morphology of Escherichia coli and Staphylococcus aureus[J].Carbohydrate Polymers,2009,76(1):17-22.

