薰衣草总黄酮的微波提取及其抗氧化性研究
李紫薇,刘 伟,张 艺,刘 枫
(伊犁师范学院化学与生物科学学院,新疆伊宁835000)
薰衣草系唇形科植物,为多年生亚灌木,是珍贵的中药材和食品香料[1]。薰衣草被维吾尔医用于治疗胸腹胀满、感冒咳嗽、头晕头痛、心悸气短、关节骨痛,为中华人民共和国卫生部《药品标准》维吾尔药分册的收载品种[1]。薰衣草富含挥发油、香豆素、单宁、类黄酮等,具有镇静[2-3]、抗菌、抗脂质过氧化、降脂肪[4]、神经保护[5]等功效。吴霞等[6-7]对薰衣草成分进行了系统的研究,已从中分离得到了7个黄酮类化合物。黄酮类化合物具有良好的抗氧化能力[8],具有增强机体免疫力、防治心脑血管疾病及抗肿瘤等功能[9-11]。研究薰衣草黄酮的提取工艺对薰衣草药用价值的开发与利用具有重要意义。微波提取法具有选择性高、操作简单、挥发性成分提取效率高等优点[12-15]。目前关于薰衣草总黄酮微波辅助提取的研究未见报道。本实验以乙醇为溶剂,对薰衣草中总黄酮的微波辅助提取工艺进行了优化,并考察了提取物的抗氧化活性。旨在为薰衣草中黄酮类化合物的提取及综合利用提供理论依据。
1 材料与方法
1.1 材料与仪器
薰衣草 超低温冷冻储藏,产自伊犁;实验用水 蒸馏水;芸香叶苷(芦丁) 上海国药集团化学试剂有限公司,AR;1,1-二苯基-2-苦肼基自由基(DPPH) 化成工业开发有限公司,AR;三羟甲基胺基甲烷(Tris) 北京双环化学试剂厂,AR;抗坏血酸 天津光友精细化工研究所,AR;亚油酸 美国,AR;水杨酸 成都化学试剂厂,AR;邻苯三酚、无水乙醇 成都市科龙化工试剂厂,AR;焦性没食子酸天津福晨化学试剂厂,AR;盐酸 天津市化学试剂三厂,AR;亚硝酸钠 西安化学试剂厂,AR;芦丁标准溶液 准确称取0.0200g芦丁标准品,以体积分数60%的乙醇溶解,定容至100mL容量瓶,得0.200mg/mL的芦丁标准液。
XH-300A祥鹄电脑微波超声波组合合成/萃取仪 北京祥鹄科技发展有限公司;RE-52系列旋转蒸发仪、SHZ-Ⅲ循环水真空泵 上海亚荣生化仪器厂;723PC可见分光光度计 上海舜宇恒平科学仪器有限公司;FW-80高速万能粉碎机 北京市永光明医疗仪器厂;KQ-250DB数控超声波清洗器 昆山市超声仪器有限公司;F2104N分析天平 上海仪器制造厂;VOS-60A真空干燥箱 上海施都凯仪器设备有限公司;TGL-16C飞鸽牌高速台式离心机 上海安亭科学仪器厂。
1.2 实验方法
1.2.1 薰衣草总黄酮的提取 样品处理:薰衣草干花(超低温冷冻储藏)阴干、粉碎,过40目筛备用。称取薰衣草花干粉2.0000g,用体积分数为45%乙醇(料液比1∶25),功率500W,微波时间25m in,抽滤,蒸馏水定容于250m L,得到薰衣草黄酮的粗提液,备用(抗氧化活性实验)。
1.2.2 芦丁标准曲线的绘制[16-17]分别移取0.00、1.00、2.00、3.00、4.00、5.00、6.00、7.00、8.00m L的芦丁标准液于9个25m L比色管中,各加1.0m L 50mg/m L的 NaNO2溶液,摇匀后静置6m in,再各加1.0m L 100mg/m L的A l(NO3)3溶液,摇匀后静置6min,继续各加入10.00m L 40mg/m L的NaOH溶液,用体积分数为60%的乙醇稀释到刻度,静置15m in。在510nm处测定吸光度(A),以浓度C(mg/m L)为横坐标,A为纵坐标制作标准曲线,其线性回归方程为: A=0.01111+18.4554C,R=0.9998,线性范围0.00~0.07mg/m L。
1.2.3 总黄酮含量的测定 移取1.00m L供试液于25m L容量瓶中,按“1.2.2”项测定吸光度,得供试品中总黄酮的质量浓度,计算总黄酮提取率。
1.2.4 微波辅助提取薰衣草总黄酮的工艺条件优化
1.2.4.1 料液比对提取率的影响 准确称取薰衣草花干粉2.0000g,平行5份,分别置100m L三颈烧瓶中,以体积分数为60%乙醇,微波提取时间10min,微波功率400W,料液比分别为1∶10、1∶15、1∶20、1∶25、1∶30时提取薰衣草花干粉中的总黄酮,计算提取率。
1.2.4.2 功率对提取率的影响 准确称取薰衣草花干粉2.0000g,平行5份,分别置100m L三颈烧瓶中,乙醇体积分数60%,微波提取时间10m in,料液比1∶20,微波功率分别为200、300、400、500、600W时提取薰衣草花干粉中的总黄酮,计算提取率。
1.2.4.3 微波处理时间对提取率的影响 准确称取薰衣草花干粉2.0000g,平行5份,分别置100m L三颈烧瓶中,体积分数60%乙醇,料液比为1∶20,微波功率为400W,微波时间分别为5、10、15、20、25、30m in时提取薰衣草花干粉中的总黄酮,计算提取率。
1.2.4.4 乙醇体积分数对提取率的影响 准确称取薰衣草花干粉2.0000g,平行5份,分别置100m L三颈烧瓶中,微波提取时间10m in,料液比1∶20,微波功率400W,乙醇体积分数15%、20%、30%、45%、60%、75%时提取薰衣草花干粉中的总黄酮,计算提取率。
1.2.4.5 正交实验设计确定最佳提取工艺 正交实验因素水平表如表1所示。

表1 L9(34)正交实验因素水平表Table1 Factors and levels of orthogonal test L9(34)
1.2.5 抗氧化能力的测定
1.2.5.1 样品预处理 薰衣草干花粉→微波辅助溶剂提取→抽滤→提取液→旋转蒸发浓缩→浓缩液→冷冻→干燥→浸膏状。
1.2.5.2 薰衣草花醇提物对羟基自由基的清除作用
配制 1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0mg/m L样品水溶液及相应浓度的VC水溶液,避光保存。取 1.00m L 4.5mmol/L FeSO4,加 1.00m L 4.5mmol/L水杨酸-乙醇溶液,1.00m L待测溶液,1.00m L 4.4mmol/L H2O2。37℃水浴中反应0.5h,以蒸馏水作参比,在510nm处测吸光度。以蒸馏水代替H2O2作为待测溶液的本底吸光度。按式(1)计算·OH清除率:
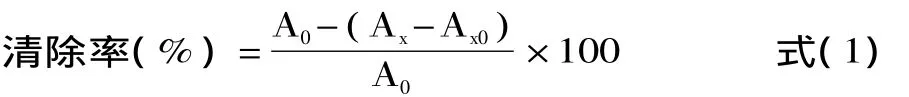
式中,A0:1.00m L FeSO4+1m L水杨酸-乙醇溶液+1.00m L蒸馏水+1m L H2O2;AX:1.00m L FeSO4+1m L水杨酸-乙醇溶液 +1.00m L样品溶液 +1m L H2O2;AX0:1.00m L FeSO4+1m L水杨酸-乙醇溶液+1.00m L样品溶液+1m L蒸馏水。
1.2.5.3 薰衣草花醇提物对DPPH·的清除作用 在2.00m L样品溶液中,加入2×10-4mol/L的DPPH溶液2.00m L,摇匀后,在室温黑暗处放置30m in。以无水乙醇作参比,测定517nm处的吸光度(Ai)。同时,测定样品溶液2.00m L与无水乙醇2.00m L混合液在515nm处的吸光度(Aj),再测定2.00m L DPPH溶液与2.00m L无水乙醇在517nm处的吸光度(A0)。按式(2)计算清除率:
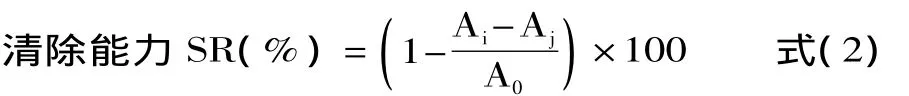
1.2.5.4 薰衣草花醇提物对超氧阴离子自由基的清除作用 取3.00m L Tris-HCl缓冲液(pH8.2),加入0.50m L样品溶液,30℃水浴保温 20m in后加入3.00m L 7mmol/L邻苯三酚,反应240s后加入1.00m L浓HCl终止反应,420nm处测吸光度。按式(1)计算O·清除率。式中,A0:3.00m L Tris-HCl+0.50m L蒸馏水+3m L邻苯三酚+1.00m L HCl;AX:3.00m L Tris-HCl+0.50m L样品溶液 +3m L邻苯三酚 +1.00m L HCl;AXO:3.00m L Tris-HCl+0.50m L样品溶液+3m L蒸馏水+1.00m L HCl。
1.2.5.5 薰衣草花醇提物抑制亚油酸的过氧化作用 在10m L比色试管中分别加入1.00m L 25mg/m L亚油酸、2.00m L 0.2mol/L磷酸盐缓冲液(pH7.0),1.00m L蒸馏水、1.00m L样液,反应液混合均匀,37℃避光恒温培养。每隔24h,在10m L具塞试管中分别加入0.10m L反应混合液、4.70m L体积分数为75%乙醇、0.10m L 0.3mg/m L硫氰酸胺、0.10m L 20mmol/L硫酸亚铁溶液,准确反应3m in后,以蒸馏水为空白,在500nm测定吸光度。每隔24h在500nm处测定其吸光度值,空白对照以乙醇代替抗氧化剂。按式(3)计算抑制率。

1.2.5.6 薰衣草花醇提物的还原力测定实验 各取VC、样品溶液2.50m L,加入0.2mol/L磷酸钠缓冲溶液(pH6.6)2.5m L和 10mg/m L铁氰化钾溶液2.50m L,将混合物在50℃保温20m in,加入2.50m L 0.1g/m L三氯乙酸之后,离心10min(650 r/m in),取上层液体5.00m L,加入5.00m L去离子水和 1.00m L 1mg/m L氯化铁,混合均匀,在700nm下测定吸光度。
2 结果与讨论
2.1 微波辅助萃取薰衣草总黄酮
2.2.1 单因素实验 按“1.2.4”项,采用单因素实验方法考察料液比、微波功率、微波处理时间、乙醇体积分数对薰衣草总黄酮得率的影响。结果表明,料液比1∶20,微波功率为400W、微波处理20m in、乙醇体积分数为30%时提取效果较好,可以获得6.82%的提取率。
2.2.2 正交实验 在单因素实验的基础上做正交实验L9(34)。以提取率作为考察指标,确定最佳提取条件,结果见表2。最佳提取条件为:乙醇体积分数45%、料液比1∶25、微波功率500W、微波时间25m in。对表2的结果进行方差分析,各因素对总黄酮提取效果的影响依次为:微波功率>料液比>乙醇体积分数>微波时间。
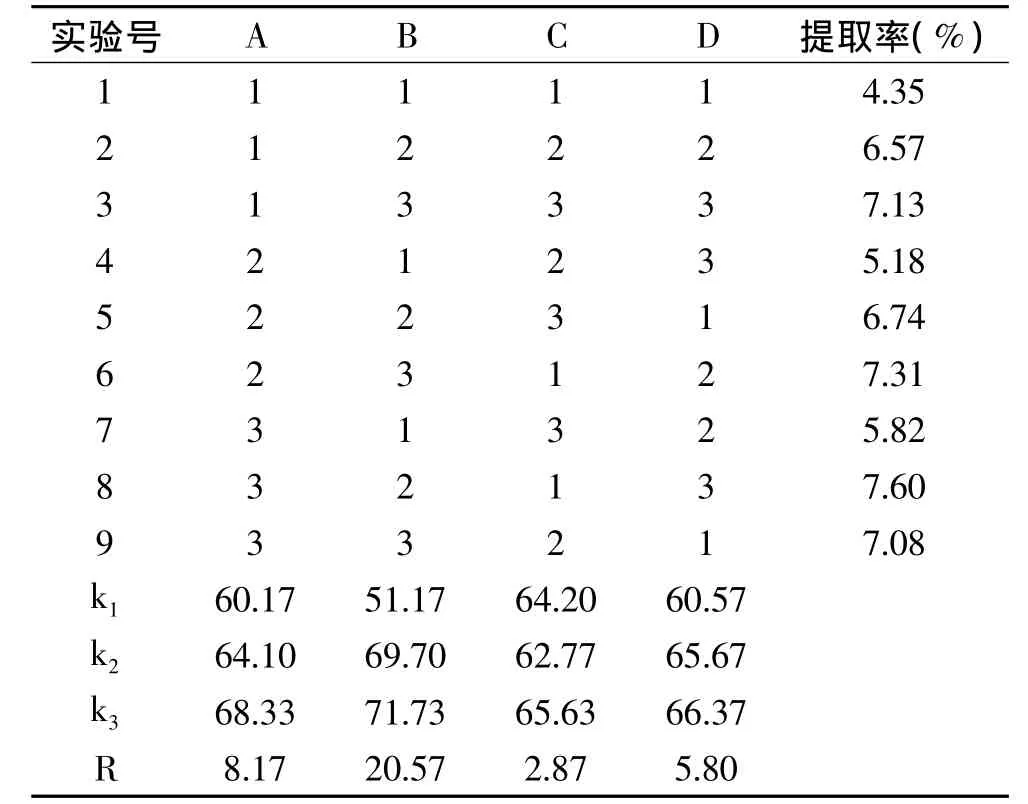
表2 L9(34)正交实验结果表Table2 Result of orthogonal test L9(34)of extraction condition
2.2 微波辅助提取物的抗氧化活性实验
2.2.1 提取物对羟基自由基的清除作用 以VC为阳性对照,测定薰衣草总黄酮提取物对·OH的清除率(图1)。薰衣草总黄酮提取物质量浓度在1.0~ 10.0mg/m L范围内,其对·OH的清除率随提取物质量浓度的升高而增加。10.0mg/m L提取物对羟基自由基的清除率可达到75.8%,相当于VC的89.7%。

图1 醇提物对·OH的清除作用Fig.1 ·OH scavenging rate of ethanol extracts
2.2.2 提取物对DPPH·的清除作用 以VC为阳性对照,测定薰衣草黄酮提取物对DPPH·的清除率(图2)。薰衣草黄酮提取物对DPPH·的清除能力随浓度升高而增强。提取物浓度为10.0mg/m L时,对DPPH·清除率是87.7%,相当于VC的91.5%。

图2 醇提物对DPPH·的清除作用Fig.2 DPPH·scavenging effect of ethanol extracts
2.2.3 提取物对超氧阴离子自由基的清除作用 不同浓度薰衣草黄酮提取物对超氧阴离子的清除能力见图3。在邻苯三酚自氧化体系中,薰衣草黄酮提取物对超氧阴离子具有一定的清除能力,并随浓度的增大而有所增强。10.0mg/m L提取物对超氧阴离子自由基的清除率可达到68.6%,相当于VC的74.5%。

图3 醇提物对O·清除作用Fig.3 The O·scavenging effect of ethanol extracts
2.2.4 提取物对亚油酸的抗氧化作用 采用亚油酸体系测定薰衣草黄酮提取物的抗氧化能力,结果见图4。薰衣草黄酮提取物抑制亚油酸过氧化能力随浓度升高而增强。在9.0mg/m L时,提取物抑制亚油酸氧化的抑制率为74.1%,相当于VC的81.3%。

图4 醇提物抑制亚油酸过氧化作用Fig.4 Anti-oxidant effect for lindeic acid
为了研究薰衣草黄酮提取物抑制亚油酸氧化能力的稳定性,选取5.0mg/m L浓度的提取物考察其在7d内抑制亚油酸过氧化能力的变化情况。如图5所示,不同提取物抑制亚油酸氧化能力随着时间的延长呈下降趋势,在第7d时仍具有一定的抗氧化能力。

图5 时间对抑制亚油酸过氧化作用影响Fig.5 Effect of time on anti-oxidant for lindeic acid
2.2.5 提取物的还原力测定实验 结果如图6所示,薰衣草总黄酮粗提物和VC的还原能力均随浓度的升高而增加。薰衣草总黄酮粗提物还原能力较强。在浓度较高时,薰衣草总黄酮和 VC的还原能力相当。

图6 还原能力测定实验结果Fig.6 Reductive ability test results
3 结论
实验研究了微波辅助提取薰衣草总黄酮的方法,确定了最佳提取条件,采用5种评价体系研究了提取物的抗氧化活性。微波辅助法对薰衣草总黄酮有较好的提取效果。最佳工艺条件是:乙醇体积分数45%、料液比1∶25、微波功率500W、微波时间25m in,提取率可以达到8.16%。薰衣草总黄酮具有较强的抗氧化性,作为多功能的抗氧化剂,应用前景广阔。实验结果为薰衣草的有效成分的研究奠定了良好的基础。
[1]中华人民共和国卫生部药典委员会编.中华人民共和国卫生部药品标准维吾尔药分册[M].乌鲁木齐:新疆科技卫生出版社,1998,112.
[2]Tiffany Field,Tory Field,Christy Cullen,et al.Lavender bath oil reduces stress and crying and enhances sleep in very young infants[J].Early Human Development,2008,84(6):399-401.
[3]希雨摘.薰衣草油可缓解重度痴呆患者的狂躁行为[J].国外医药:植物药分册,2004,19(5):217.
[4]沈莉纳,陈惠芳.由薰衣草和茴香提取物组成的外用降脂制剂[J].国外医药:植物药分册,1997,12(6):208-210.
[5]戴伟娟.薰衣草花水提取物对谷氨酸诱导的幼鼠小脑颗粒细胞培养物神经毒性的作用[J].国外医药:植物药分册,2004,19(2):75.
[6]吴霞,刘净,于志斌,等.薰衣草中黄酮类化学成分的研究[J].中国中药杂志,2007,32(9):821-823.
[7]吴霞,刘净,于志斌,等.薰衣草化学成分的研究[J].化学学报,2007,65(16):1649-1653.
[8]杨洁,高峰林.新疆狭叶薰衣草总黄酮抗氧化活性的研究[J].中国食品添加剂,2010(2):162-165.
[9]蔡为荣.微波提取荷叶黄酮及清除羟基自由基的研究[J].食品科学,2004(9):112-115.
[10]谢贞建,焦士蓉,唐鹏程,等.枳实总黄酮提取工艺的响应面法优化[J].食品研究与开发,2009,30(7):41-45.
[11]张鹏.银杏叶黄酮的微波提取及其抗氧化性研究[J].安徽农业科学,2009,37(12):5496-5497,5730.
[12]郭雪峰,岳永德.黄酮类化合物的提取分离纯化和含量测定方法的研究进展[J].安徽农业科学,2007,35(26): 8083-8086.
[13]Virota M,Tomaoa V,Giniesa C,et al.Microwave-integrated extraction of total fats and oils[J].JChromatogr A,2008,1196-1197:57-64.
[14]Yan Ming-Ming,Liu Wei,Fu Yu-Jie,et al.Optimisation of the microwave-assisted extraction process for four main astragalosides in Radix Astragali[J].Food Chemistry,2010,119 (4):1663-1670.
[15]Li Hongyan,Deng Zeyuan,Wu Tao,et al.Microwaveassisted extraction of phenolicswithmaximal antioxidantactivities in tomatoes[J].Food Chemistry,2012,130(4):928-936.
[16]邓斌,蒋刚彪,黄红英,等.分光光度法测定夏枯草中总黄酮的含量[J].时珍国医国药,2008,19(7):1608-1609.
[17]王立娟.微波辅助提取山楂叶总黄酮的条件研究[J].林产化学与工业,2006,26(3):131-134.

