响应面法优化MTGase改善暹罗鳄肌原纤维蛋白凝胶品质的工艺
罗自生,谢 妍,刘颖峰
(浙江大学生物系统工程与食品科学学院,浙江 杭州 310058)
响应面法优化MTGase改善暹罗鳄肌原纤维蛋白凝胶品质的工艺
罗自生,谢 妍,刘颖峰
(浙江大学生物系统工程与食品科学学院,浙江 杭州 310058)
为优化微生物源谷氨酰胺转氨酶(MTGase)改善暹罗鳄肌原纤维蛋白凝胶品质的工艺条件,在单因素试验的基础上,选择酶作用温度、作用时间和酶添加量为自变量,以凝胶强度和持水性为响应值,利用响应面分析法,研究各变量间及其交互作用对凝胶品质的影响。结果表明:MTGase改善凝胶品质的最佳工艺为:作用温度38℃、作用时间2.3h、酶添加量0.8U/g,该条件下所得凝胶强度为509.886g·cm,持水性为88.094%,相较空白对照,凝胶强度提高了2.32倍,持水性提高了20.6%。因此,MTGase可以显著改善暹罗鳄肌原纤维蛋白的凝胶品质。
暹罗鳄;肌原纤维蛋白;谷氨酰胺转氨酶;凝胶强度;持水性;响应面
鳄鱼作为最古老的爬行动物,具有“活化石”之称。对鳄鱼肉提取物的研究[1]中发现,人工养殖鳄鱼肉提取物可显著促进T淋巴细胞的增殖,提高血液携氧量,使咳嗽、哮喘患者肺氧交换量增加,具有提高耐缺氧能力、增强免疫力的作用。鳄鱼肉具有很高的营养价值和药用价值,是低脂肪、低胆固醇的优质蛋白质来源。
我国自1990年就开始引进、养殖鳄鱼,近年来鳄鱼产品在我国的进出口量与日俱增,中国正成为世界上鳄鱼产品的主要加工国和消费国之一[2]。但是,目前鳄鱼养殖多用于皮革生产,而由于鳄鱼肉自身所具有的独特腥味由于难以通过普通烹饪去除,存在消费者认可低、市场推广难等问题。因此,尽管鳄鱼肉具有极高的营养价值,却一直不能得到很好的开发利用,造成鳄鱼产业的极大浪费。糜类制品通过添加剂的作用可以对腥味进行掩盖,在保证营养价值、降低成本的同时,兼具携带、食用方便等优点,还可根据消费者喜好改变产品的形状、外观和滋味,使其相较其他产品形式更具灵活性和可开发性。因此开发鳄鱼肉糜制品,是开拓鳄鱼肉市场的有效途径之一。
但在鳄鱼肉产品的开发过程中发现其凝胶性能较差,因此如何提高鳄鱼肉糜的凝胶性能,成为产品开发的关键。谷氨酰胺转氨酶可以催化蛋白质或多肽链上的谷氨酸残基γ-羧基酰胺基与赖氨酸(Lys)残基ε-氨基之间发生交联作用,生成分子内或分子间ε-(γ-Glu)-Lys非二硫共价键,从而达到增强凝胶特性的目的[3]。从微生物中所获得的谷氨酰胺转氨酶(microbial transglutaminase,MTGase),具有成本低、易获取、作用温度稳定、pH值范围广、且不依赖钙离子等优势,因而在食品工业中被广泛应用[4]。国内外[5-10]在MTGase的凝胶机理、凝胶改善能力及作用条件等方向均有大量研究,对象涉及鱼糜、肉糜、虾糜、乳制品、植物蛋白等方面,但是在鳄鱼肌肉凝胶改善上的研究却未见报道。
本实验在单因素试验的基础上,通过响应面试验设计对MTGase提高暹罗鳄肌原纤维蛋白凝胶品质的作用条件进行优化,以期提高鳄鱼肉糜的凝胶性能,为鳄鱼肉产品开发提供理论依据。
1 材料与方法
1.1 材料与试剂
暹罗鳄 盐城泰鳄湖生态有限公司。
TG-B型谷氨酰胺转氨酶(100U/g) 泰州一鸣精细化工有限公司。
1.2 仪器与设备
TA-XTplus质构仪 英国Stable Micro System公司;Avanti J-E高效冷冻离心机 美国贝克曼库尔特有限公司;JM-250数显电泳仪 大连捷迈科贸有限公司。
1.3 方法
1.3.1 肌原纤维蛋白的提取
参考Sarkar等[11]和Lefevre等[12]的方法,略作改动。取冷冻鳄鱼躯干及尾部于4℃条件下解冻,用冰水洗净后去皮、去脂肪,取肌肉混合后用搅拌机绞碎。所得肉糜加入5倍A液(0.1mol/L NaCl溶液、1mmol/L EDTA溶液、20mmol/L磷酸缓冲液,pH7.0),于冰浴中以10000r/min匀浆10min。取匀浆液于8000×g、4℃条件下离心10min,去上清液。沉淀再用5倍A液悬浮、匀浆、离心(条件同上)。重复2次后取沉淀,加入5倍B液(0.1mol/L NaCl-20mmol/L磷酸缓冲液(pH7.0)),同上操作,悬浮、匀浆、离心,重复2次。所得沉淀,于-70℃条件下冻藏。
1.3.2 凝胶制备
参考陆海霞等[13]的方法,略作修改。取-70℃条件下冻藏的肌原纤维蛋白(水分含量88.9%),于4℃冰箱中解冻。称取20g置于50mL离心管中,加入2.5%的氯化钠及一定浓度的MTGase,冰浴中搅拌5min。于2000r/min、4℃条件下离心3min。然后置于一定温度的恒温水浴锅中保温一定时间,转入90℃加热30min,取出,冷却后于4℃条件下冷藏过夜,待测。
1.3.3 凝胶强度测定
将凝胶样品与于4℃冰箱中取出,放至室温,然后将其切成1.5cm高的圆柱体(直径约2.5cm),使用TA-XT plus质构仪进行凝胶强度的测定。选择圆柱形探头P/5,测前速率1mm/s,测试速率1mm/s,测后速率10mm/s;穿刺测试距离为50%压缩比;感应力5g。穿刺曲线上的第1个峰即为破断强度,对应的距离为凹陷度。按式(1)[14]计算凝胶强度。
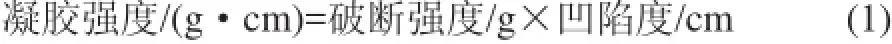
1.3.4 持水性测定
参考徐幸莲等[15]的方法,将凝胶切成5mm左右厚度的薄片,称质量记为m1,夹在上下各3片滤纸中。采用质构仪P/75探头,5kg恒压2min后,取凝胶称质量记为m2。

1.3.5 聚丙烯酰胺凝胶电泳(SDS-PAGE)
参照Laemmli[16]的方法,选取10%的分离胶和5%的浓缩胶对鳄鱼肌原纤维蛋白凝胶进行SDS-PAGE分析。称取样品3g,加入27mL 5g/100mL SDS溶液,10000r/min匀浆3min。将均质液置于85℃条件下水浴1h后取出,5000r/min离心3min后取上清液。加蛋白上样缓冲液1:1混合,煮沸5min后离心、上样。初始电压为80V,待溴酚蓝进入分离胶后将电压调至120V,电泳时间约2h。
1.3.6 响应曲面分析法试验
采用Design Expert 8.0软件进行响应面设计,根据Box-Behnken的组合设计原则,以MTGase作用温度、作用时间及酶添加量为自变量,以凝胶强度和持水性为响应值,设计了三因素三水平共17个试验点的相应面分析试验。其中12个为析因试验,5个为中心试验,用来估计试验误差。每个试验平行3次,取平均值。其中因素水平选取见表1。

表1 响应面分析因素及水平表Table1 Factors and levels for response surface analysis
1.4 数据处理及分析
利用DPS v13.5对数据作单因素方差分析,采用Tukey检验法比较平均值的显著差异性(P<0.05),并使用Origin Pro v8.0软件做图。采用Design Expert 8.0软件中的多元线性回归分析程序拟合二阶多项式方程,并转化为相应曲面,分析试验因素及水平对响应值的影响。
2 结果与分析
2.1 单因素试验
2.1.1 MTGase作用温度对凝胶品质的影响
在作用时间2h、酶添加量0.6U/g条件下,考察不同作用温度对凝胶品质的影响,如图1所示。作用温度对凝胶强度和持水性具有显著影响(P<0.05)。凝胶强度和持水性随MTGase作用温度的升高呈先上升后下降趋势,在40℃时达最高值,之后随着温度的上升,均显著下降。
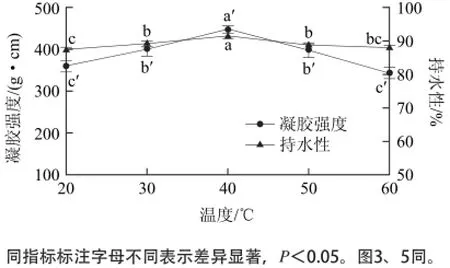
图1 MTGase作用温度对鳄鱼肌原纤维蛋白凝胶品质的影响Fig.1 Effect of incubation temperature on gelation properties of Crocodylus siamensis myofibril
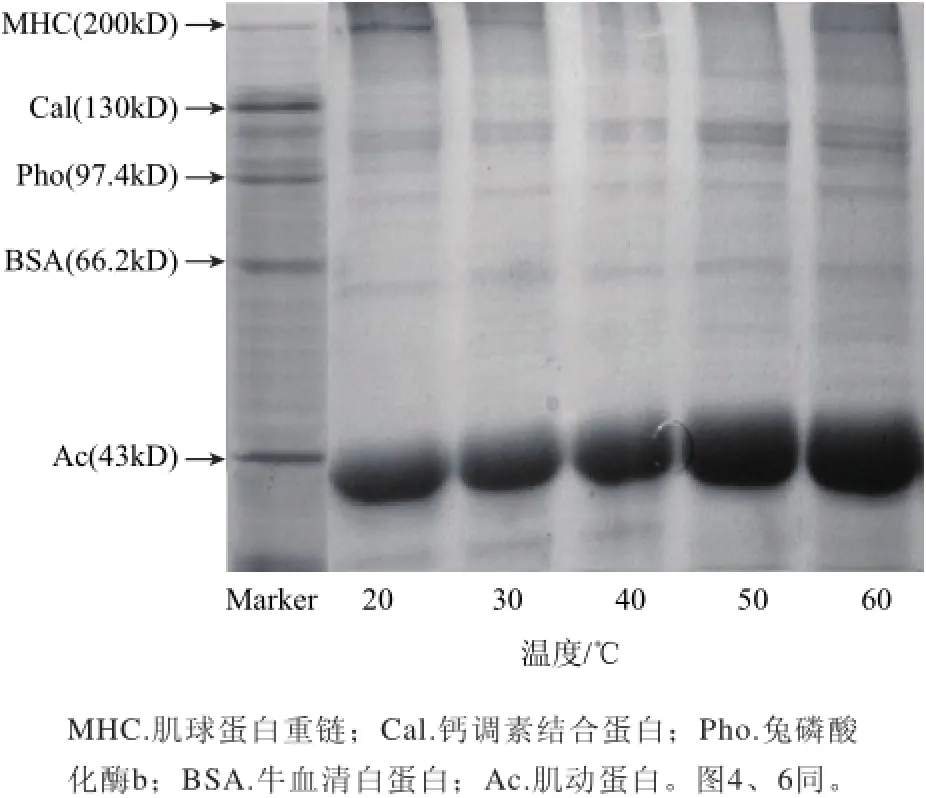
图2 MTGase作用温度对鳄鱼肌原纤维蛋白凝胶SDS-PAGE图谱的影响Fig.2 Effect of incubation temperature on SDS-PAGE profile of Crocodylus siamensis myofibril
由图2可以发现,20℃条件下处理得到的凝胶中存在明显的MHC条带,随着温度的上升,MHC条带逐渐变细变淡。40℃和50℃条件下处理所得凝胶中不能观察到MHC条带,60℃条件下MHC条带重新出现。MHC是参与凝胶形成的重要蛋白,其条带的减弱或消失说明更多的MHC参与了凝胶网络结构的交联与形成。这也证明在20℃时,MTGase不能很好地催化蛋白质之间发生交联作用,40~50℃条件下,MTGase的催化能力最强,与凝胶强度和持水性的变化结果相一致。
一方面,如杨龙江等[17]所提出的观点,加热可使蛋白质内部的巯基暴露出来,交换形成更多二硫键,从而促进不可逆凝胶的形成,因此随温度的升高,凝胶品质增强。但温度过高会导致分子运动加速,当蛋白质展开速度高于聚集速度时,变性链无法较好定向,导致形成的凝胶粗糙、无序。所以认为在40℃条件下,鳄鱼肌原纤维蛋白的展开、聚集速度达到平衡,有利于凝胶结构的稳定形成。另一方面,认为与酶作用的最适温度相关。破坏凝胶网络结构的內源碱性蛋白酶在50~60℃活性最佳,它导致肌球蛋白等发生分解,使蛋白凝胶在50℃以上的反应条件下发生凝胶劣化[18]。这也很好地解释了虽然MTGase在50℃条件下的催化能力最高,所得凝胶品质却低于40℃处理这一现象。因此,选择40℃是MTGase提高鳄鱼肌原纤维蛋白凝胶能力的最适作用温度。
2.1.2 MTGase作用时间对凝胶品质的影响
在作用温度40℃、酶添加量0.6U/g条件下,考察不同作用时间对凝胶品质的影响,如图3所示。作用时间对凝胶强度和持水性具有显著影响(P<0.05)。随着作用时间的延长,凝胶强度和持水性在2h内呈显著上升趋势(P<0.05),2h后趋于平缓。
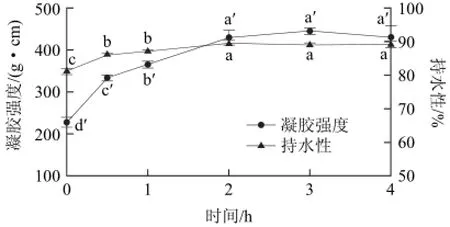
图3 MTGase作用时间对鳄鱼肌原纤维蛋白凝胶品质的影响Fig.3 Effect of incubation time on gelation properties of Crocodylus siamensis myofibril

图4 MTGase作用时间对鳄鱼肌原纤维蛋白凝胶SDS-PAGE图谱的影响Fig.4 Effect of incubation time on SDS-PAGE profile of Crocodylus siamensis myofibril
图4 为图3相应的SDS-PAGE图谱,可以看到,空白处理样品存在明显的MHC条带,随着加热时间的延长,MHC条带逐渐变细、减淡。加热时间2h后,MHC条带消失。这也说明,加热时间2h以上,可以保证蛋白质充分交联。
Kim等[19]对牛肉肌球蛋白的聚合反应研究证明了这一点,在谷氨酰胺转氨酶的作用下,35℃条件下预热30min后,牛肉蛋白凝胶出现早期网络结构的形成,1h后肌球蛋白的聚集现象明显。这说明,MTGase作用时间的延长,有利于MTGase更好地催化蛋白质发生交联反应,形成稳定的凝胶网络结构。同时Dondero等[5]指出,添加MTGase后的牛肉蛋白在不同温度条件反应,所得凝胶均在2h时强度最高,并在2h后,凝胶强度下降。Sakamoto等[20]也发现加热时间过长会导致凝胶劣化。因此,综合凝胶品质和生产成本等因素,选择2h为MTGase最适作用时间。
2.1.3 MTGase添加量对凝胶品质的影响
在作用温度40℃、作用时间2h条件下,考察不同酶添加量对凝胶品质的影响,如图5所示。酶添加量对凝胶强度和持水性具有显著影响(P<0.05)。随着MTGase添加量的增加,凝胶强度先呈显著上升趋势,后趋于平缓。在酶添加量为0.8U/g时,比空白处理的凝胶强度提高了2.1倍。超过0.8U/g后,凝胶强度无显著提高(P>0.05)。持水性呈先上升后下降趋势,在0.6U/g时持水性最强。
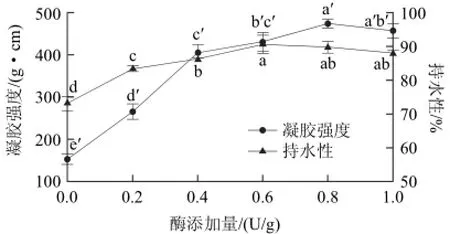
图5 MTGase添加量对鳄鱼肌原纤维蛋白凝胶品质的影响Fig.5 Effect of MTGase concentration on gelation properties of Crocodylus siamensis myofibril
由图6中相应的蛋白电泳条带可以发现,未添加MTGase所得凝胶的MHC条带明显,随着MTGase的添加及含量的增大,MHC条带逐渐变淡。当MTGase添加量超过0.6U/g时,MHC条带基本消失,随添加量的增加也无显著变化。再次证明,MTGase的添加可以显著增加蛋白质间的交联,与凝胶品质结果相一致。
这可能是由于在蛋白含量不变的条件下,谷氨酸和赖氨酸残基数量一定,过多的酶添加并不能使蛋白发生更多交联。Herrero等[21]、Chen Hongye等[22]、Ahhmed等[10]分别在对猪肉、鸡肉的研究中证明了这一结论。同时,Sakamoto等[20]、Seguro等[23]在不同鱼糜的相关研究中均发现过多的MTGase的添加会使凝胶强度发生下降,认为酶浓度过高,导致过量ε-(γ-Glu)-Lys交联的形成,破坏了凝胶结构的均一性,反而导致凝胶变脆。因此,MTGase提高鳄鱼肌原纤维蛋白凝胶能力的最适添加量为0.8U/g。
2.2 响应面分析法优化凝胶特性改善工艺
2.2.1 回归模型的建立
在单因素试验的基础上,响应面试验设计及结果如表2所示。
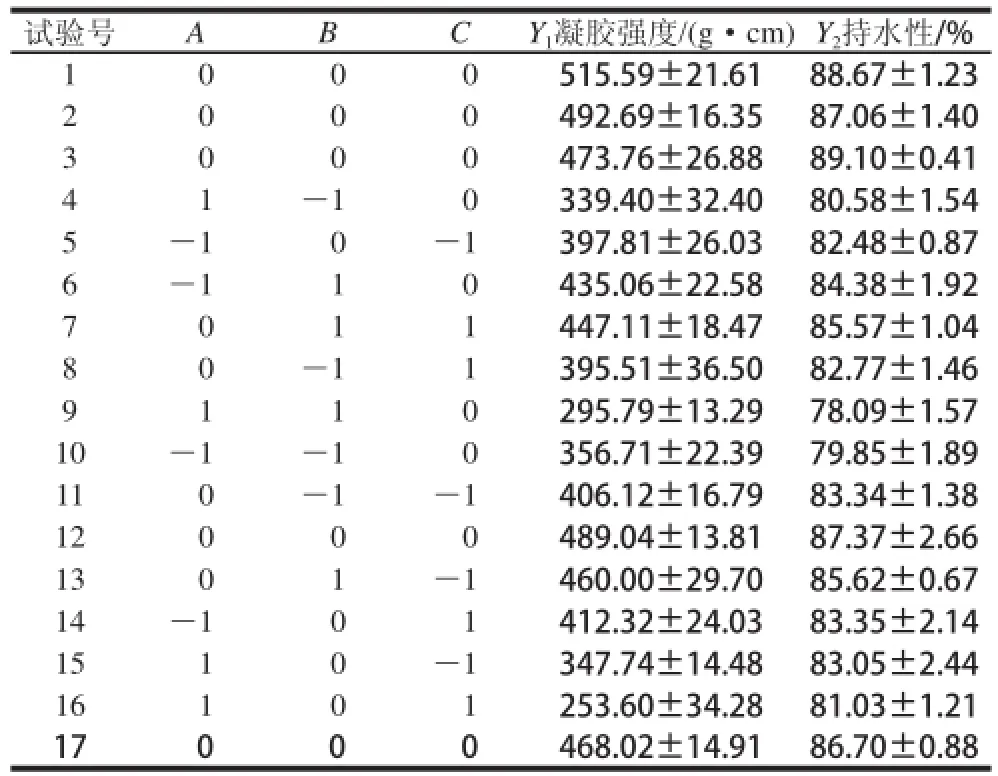
表2 Box-Behnken试验设计及结果(x±s,n=3)Table2 Box-Benhnken matrix and response values (x ±s,n==33))

表3 MTGase对鳄鱼肌原纤维蛋白凝胶强度影响的回归模型方差分析表Table3 Analysis of variance for the regression model indicating the effect of MTGase treatment on gel strength ofCrocodylus siamensis

表4 MTGase对鳄鱼肌原纤维蛋白凝胶持水性影响的回归模型方差分析表Table4 Analysis of variance for the regression model indicating the effect of MTGase treatment on water-holding capacity ofCrocodylus siamensis
运用Design Expert 8.0数据分析软件对表2试验结果进行回归分析,并建立凝胶强度(Y1)及持水性(Y2)与MTGase作用时间(A)、作用温度(B)及酶添加量(C)3个因素实际值的数学回归模型:
Y1=-2268.83+94.55487A+225.2925B+1774.64375C-3.049AB-13.58125AC+2.85BC-1.02699A2-28.38125B2-806.34375C2
Y2=-29.275+4.10962A+17.805B+46.09375C-0.1755AB-0.36125AC+0.65BC-0.044512A2-2.60375B2-21.28125C2
如表3、4所示,对凝胶强度和持水性的回归方程进行显著性检验。得到两个回归模型极显著P<0.01,且失拟项检验不显著P>0.05,说明这两个模型可用于实际值的预测,试验方法可靠。
由表3可知,凝胶强度回归方程的相关系数R2=0.9680,表明有96.80%的数据可以用此方程解释。一次项中影响凝胶强度的主次顺序为A(极显著)>B(显著)>C(不显著)。交互项中AB和AC的交互影响显著(P<0.05)。二次项中。A2影响极显著,B2和C2均影响显著。
由表4可知,持水性回归方程的相关系数R2=0.9536,表明有95.36%的数据可以用此方程解释。影响失水率的一次项主次顺序为A(显著)>B(显著)>C(不显著)。交互项中只有AB存在显著的交互影响,二次项中A2和B2影响极显著。
剔除影响不显著的一次项、交互项及二次项,得优化模型方程如下:
Y1=-2264.27+94.55487A+253.0125B+1768.94375C-3.049AB-13.58125AC-1.02699A2-28.38125B2-806.34375C2
Y2=-7.27447+3.85647A+18.50421B-0.1755AB-0.044961A2-2.64855B2
2.2.2 响应面分析
2.2.2.1 凝胶强度的响应面分析
在凝胶强度回归方程中,交互项AB和AC影响显著。因此,分别作AB和AC交互影响的响应曲面图。

图7 作用温度与作用时间对暹罗鳄肌原纤维蛋白凝胶强度影响的响应面图Fig.7 Response surface diagram for gel strength of Crocodylus siamensis myofibril affected by incubation temperature and incubation time
如图7所示,随作用温度的上升,凝胶强度呈先增大后减小的趋势。而随作用时间的延长,凝胶强度在不同温度条件下呈现不同变化。在30℃作用条件下,凝胶强度随作用时间的延长呈增大趋势,在40℃时呈先增大后减小趋势,在50℃时呈明显减小趋势。

图8 作用温度与酶添加量对暹罗鳄肌原纤维蛋白凝胶强度影响的响应面图Fig.8 Response surface diagram for gel strength of Crocodylus siamensis myofibril affected by incubation temperature and enzyme concentration
如图8所示,随酶添加量的增加,凝胶强度在不同温度条件下呈现不同变化。在30℃作用条件下,酶添加量的增加对凝胶强度的影响不大;在40℃时呈先增大后减小趋势;而在50℃时,随着酶添加量的增加呈减小趋势。
2.2.2.2 凝胶持水性的响应面分析
在持水性回归方程中,交互项中只有AB影响显著,因此根据回归模型绘制AB交互影响的响应面图,如图9所示,随着作用温度的上升,凝胶强度呈先增大后减小的趋势;而随作用时间的延长,凝胶持水性在不同温度条件下变化趋势不同。在30℃时,凝胶持水性随作用时间的延长先上升后趋于平缓;在40℃时呈先上升后下降趋势;而在50℃时随作用时间的延长主要呈下降趋势。可见,在模型范围内,MTGase在低温条件下需要较长的作用时间,而在高温条件下,长时间作用会导致凝胶劣化,凝胶特性明显下降。
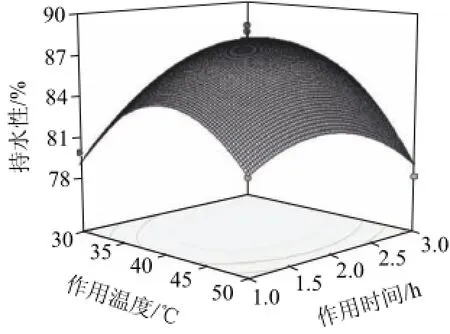
图9 作用温度与作用时间对暹罗鳄肌原纤维蛋白凝胶持水性影响的响应面图Fig.9 Response surface diagram for water-holding capacity of Crocodylus siamensis myofibril affected by incubation temperature and incubation time
2.2.3 响应面法优化工艺参数
通过Design Expert 软件分析,得MTGase改善暹罗鳄肌原纤维蛋白凝胶特性的最佳工艺条件为作用温度37.99℃、作用时间2.29h、酶添加量0.8U/g,预测所得凝胶的凝胶强度为497.732g·cm,持水性为87.560%。为了便于操作,选取作用温度38℃、作用时间2.3h、酶添加量0.8U/g,经过5次平行实验,测得凝胶强度为(509.886±10.245)g·cm,持水性为(88.094±0.981)%,相对误差分别为2.44%和0.61%,说明本模型与实际情况拟合较好,模型可靠。
3 结 论
本实验采用MTGase的添加改善暹罗鳄肌原纤维蛋白的凝胶品质,通过单因素试验和三因素三水平的Box-Behnken试验设计研究MTGase对暹罗鳄肌原纤维蛋白凝胶强度和持水性的影响,并建立相应的数据模型对其作用条件进行优化。优化后,实际所得凝胶强度达509.886g·cm,持水性达88.094%,而空白对照凝胶的凝胶强度为153.555g·cm,持水性为73.055%,通过响应面优化后,添加MTGase使凝胶强度提高了2.32倍,持水性提高了20.6%。因此,认为在作用温度38℃、作用时间2.3h、酶添加量0.8U/g条件下,MTGase可以显著改善暹罗鳄肌原纤维蛋白的凝胶品质。
[1] 张硕峰, 李耀武, 周曼, 等. 人工养殖暹罗鳄鱼肉酶解物提高缺氧耐受力的药效学验证[J]. 中国实验方剂学杂志, 2011, 17(2): 166-168.
[2] 周敏. 鳄鱼养殖与经营利用产业在我国的发展研究[J]. 福建林业科技, 2002, 29(3): 92-95.
[3] DEJONG G A H, KOPPELMAN S J. Transglutaminase catalyzed reactions: impact on food applications[J]. Journal of Food Science, 2002, 67(8): 2798-2806.
[4] MOTOKI M, SEGURO K. Transglutaminase and its use for food processing[J]. Trends in Food Science Technology, 1998, 9(5): 204-210.
[5] DONDERO M, FIGUEROA V, MORALES X, et al. Transglutaminase effects on gelation capacity of thermally induced beef protein gels[J]. Food Chemistry, 2006, 99(3): 546-554.
[6] KURAISHI C, YAMAZAKI K, SUSA Y. Transglutaminase: its utilization in the food industry[J]. Food Reviews International, 2001, 17(2): 221-246.
[7] BENJAKUL S, VISESSANGUAN W. Transglutaminase-mediated setting in bigeye snapper surimi[J]. Food Research International, 2003, 36(3): 253-266.
[8] CARDOSO C, MENDES R, PIRES P V, et al. Effect of salt and MTGase on the production of high quality gels from farmed sea bass[J]. Journal of Food Engineering, 2010, 101(1): 98-105.
[9] TAMMATINNA A, VISESSANG W. Gelling properties of white shrimp (Penaeus vannamei) meat as inf l uenced by setting condition and microbial transglutaminase[J]. LWT-Food Science and Technology, 2007, 40(9): 1489-1497.
[10] AHHMED A M, NASU T, HUY D Q, et al. Effect of microbial transglutaminase on the natural actomyosin cross-linking in chicken and beef[J]. Meat Science, 2009, 82(2): 170-178.
[11] SARKAR S, SRETER F A, GERGELY J. Light chains of myosins from white, red, and cardiac muscles[J]. Proceedings of the National Academy of Science of the United States of America, 1971, 68(5): 946-950.
[12] LEFEVRE F, FAUCONNEAU B, THOMPSON J W, et al. Thermal denaturation and aggregation properties of atlantic salmon myof i brils and myosin from white and red muscles[J]. Journal of Agricultural and Food Chemistry, 2007, 55(12): 4761-4770.
[13] 陆海霞, 张蕾, 李学鹏, 等. 超高压对秘鲁鱿鱼肌原纤维蛋白凝胶特性的影响[J]. 中国水产科学, 2010, 17(5): 1107-1114.
[14] DONDERO M. Transglutaminase effects on gelation capacity of thermally induced beef protein gels[J]. Food Chemistry, 2006, 99(3): 546-554.
[15] 徐幸莲, 王霞, 周光宏, 等. 磷酸盐对肌球蛋白热凝胶硬度、保水性和超微结构的影响[J]. 食品科学, 2005, 26(3): 42-46.
[16] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227: 680-685.
[17] 杨龙江, 南庆贤. 肌肉蛋白质的热诱导凝胶特性及其影响因素[J].肉类工业, 2001(10): 39-42.
[18] AN H, PETERS M Y, SEYMOUR T A. Roles of endogenous enzymes in surimi gelation[J]. Trends in Food Science & Technology, 1996, 7(10): 321-327.
[19] KIM S H, CARPENTER J A, LANIER T C, et al. Polymerization of beef actomyosin induced by transglutaminase[J]. Journal of Food Science, 1993, 58(3): 473-474.
[20] SAKAMOTO H, KUMAZAWA Y, MOTOKI M. Strength of protein gels prepared with microbial transglutaminase as related to reaction conditions[J]. Journal of Food Science, 1994, 59(4): 866-871.
[21] HERRERO A M, CAMBERO M I, ORD☒☒EZ J A, et al. Raman spectroscopy study of the structural effect of microbial transglutaminase on meat systems and its relationship with textural characteristics[J]. Food Chemistry, 2008, 109(1): 25-32.
[22] CHEN Hongye, HAN Minyi. Raman spectroscopic study of the effects of microbial transglutaminase on heat-induced gelation of pork myofibrillar proteins and its relationship with textural characteristics[J]. Food Research International, 2011, 44(5): 1514-1520.
[23] SEGURO K, YOSHIYUKI Y, OHTSUKA T, et al. Microbial transglutaminase and ε-(γ-glutamyl)-lysine crosslink effects on elastic properties of Kamaboko gels[J]. Journal of Food Science, 1995, 60(2): 305-311.
Optimizing by Response Surface Methodology the Use of Microbial Transglutaminase to Improve Gelation Properties of Crocodylus siamensis Myofibril
LUO Zi-sheng,XIE Yan,LIU Ying-feng
(School of Biosystems Engineering and Food Science, Zhejiang University, Hangzhou 310058, China)
The optimal conditions of microbial transglutaminase (MTGase) for strengthening gelation properties of Crocodylus siamensis myof i bril were explored. The individual and interactive effects of incubation temperature, incubation time and MTGase concentration on gel strength and water-holding capacity were investigated by one-factor-at-a-time design and response surface analysis. The results showed that the optimal conditions for strengthening gelation properties of Crocodylus siamensis myof i bril were 38 ℃, 2.3 h and MTGase concentration of 0.8 U/g. Under the optimal conditions, the gel strength was 509.886 g•cm, and water-holding capacity was 88.094%, which revealed an increase by 2.32-fold and 20.6% when compared with gels without MTGase. These results demonstrated that the optimal hydrolysis procedure was feasible, and MTGase played an important role in improving gelation properties of Crocodylus siamensis myof i bril.
Crocodylus siamensis;myofibril;microbial transglutaminase (MTGase);gel strength;water-holding capacity;response surface methodology (RSM)
TS254.4
A
1002-6630(2013)18-0006-06
10.7506/spkx1002-6630-201318002
2012-09-03
“十二五”国家科技支撑计划项目(2012BAD29B06)
罗自生(1972—),男,教授,博士,研究方向为食品贮藏与加工。E-mail:luozisheng@zju.edu.cn

