SRAP和ITS分子标记在大兴安岭地区野生黑木耳遗传多样性上的应用
张 旭,李 倩,刘华晶,刘科然,张钰雪,刘腾飞,杨永迪
(东北农业大学资源与环境学院,哈尔滨 150030)
黑木耳学名Auricularia auricula(L.ex Hook)Underw,亦称木耳、光木耳、云耳等,隶属于担子菌亚门(Basidiomycotina),异担子菌纲(Heterobasidiomycetes),木耳目(Auriculariales),木耳科 (Auriculariaceae),木耳属 (Auricularia)[1]。黑木耳经长期的人工驯化和自然选择,其遗传背景非常复杂,因此掌握其遗传关系是黑木耳育种工作的关键。
随着分子生物学研究的发展,基于PCR的标记体系类型多样,应用广泛,但各自的复杂性、可靠性与遗传信息不同[2],分子标记技术已经成为分析黑木耳遗传多样性的主要手段之一[3]。目前分子标记技术主要有RFLP、RAPD、ISSR、AFLP、SRAP等。在众多的分子标记中,相关序列扩增多态性(Sequence-Related Amplified Polymorphism,SRAP)是一种新型的基于PCR的标记系统,由美国加州大学蔬菜作物系Li与Quiros博士于2001年在芸苔属植物上开发出的新型分子标记技术[4]。SRAP利用特定引物对ORFs区域(Open Reading Frames)进行扩增,具有简单、高效、高共显性、重复性、易测序等优点,目前该技术已被用于马铃薯、甜瓜、油菜、大枣等作物[5]中,实现扩增。ITS(Internal transcribed spacer)是核糖体rDNA中介于18s与5.8s之间的ITS1、及5.8S与28S之间的ITS2的非编码转录间隔区,进化速率较快且片段长度适中(高等真菌一般小于1 000bp),加上协调进化,使得该片段在基因组不同重复单元间十分一致,成为高等真菌属内种间及种群系统学研究的核基因标记[6]。真菌的rDNA的ITS区段的保守性基本上表现为种内相对一致、种间差异比较明显,这一特点使得ITS区段不仅适合于属内物种间或种内差异较明显的菌群间的系统发育关系分析,而且非常适合于真菌物种的分子鉴定[7]。
目前对黑木耳野生菌株的种质资源研究尚处于空白阶段,野生资源多样性是否丰富决定能否选育出优质黑木耳菌株。开展黑木耳野生种质遗传多样性研究,对于黑木耳有益种质资源的收集、保存、评价和利用具有重要意义。本研究对黑龙江省境内大兴安岭地区采集的14株野生黑木耳菌株和该地区6个栽培面积较大的黑木耳菌株进行初步鉴定的基础上,对黑木耳的rDNA ITS区段进行序列测定和序列特征比较分析,并进一步对ITS序列进行核酸序列数据库GenBank同源性检索比对,构建起系统发育树,以期为基于传统形态特征对20个黑木耳菌株的分类鉴定提供分子依据,为黑木耳优良菌种选育及建立种质资源信息库提供依据。对野生黑木耳进行种质资源的分析与鉴定在国内外尚属首次。
1 材料与方法
1.1 供试菌株
供试菌株共20株,其中14个野生黑木耳样品于2009—2010年采自大兴安岭地区(7~20号),采样后带回实验室进行菌株分离工作,6株栽培菌株选自大兴安岭地区栽培品种(1~6号),具体情况见表1。
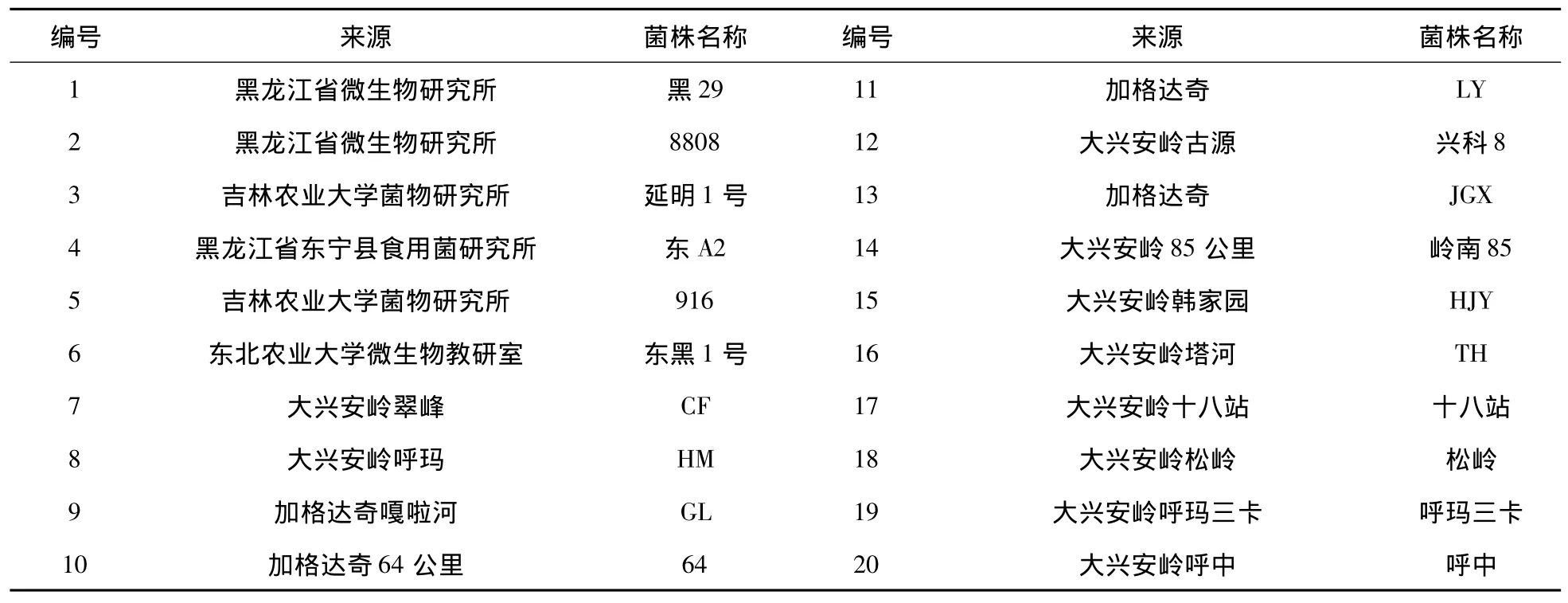
表1 供试材料及来源Tab.1 The tested strains and their locations
1.2 供试菌株的分离纯化及培养
采用组织分离法对菌株进行组织分离培养,将活化后的菌种接入250mL三角瓶液体PDA培养基中培养,120rpm于摇床上培养7d得到菌丝备用。
1.3 菌株总DNA的提取
对菌丝体基因组总DNA采用改进的CTAB法提取。在含有0.5μg/mL溴化乙锭的1%琼脂糖凝胶上检测DNA样品的质量和浓度,凝胶成像系统拍照记录。
1.4 反应体系及程序
1.4.1 SRAP 反应体系及程序
根据Li和Quiros(2001)设计SRAP引物序列,设计6个上游引物和8个下游引物,由上海生物工程技术公司合成。从6个上游引物和8个下游引物组合的48对引物中挑选扩增效果较好、多态性高、稳定性较强的引物对样品进行扩增。
PCR扩增体系为 25μL,含 1×PCR buffer,2 mmol/L MgC12,dNTPs 0.2mmol/L(TaKaRa),Tag 酶 0.75U(TaKa-Ra),模板DNA30 ng,正向和反向引物各30 ng,不足部分ddH2O补足。PCR扩增重复3次。
扩增程序为:94℃预变性5 min;94℃变性1 min,35℃退火1 min,72℃复性1 min,5 个循环;94℃变性1 min,50℃退火1 min,72℃复性1 min,35个循环;72℃延伸10 min;4℃结束保存。取 PCR产物3μL与3μL 6×Loding Buffer混匀,以1×TAE为电泳缓冲液,在含有0.5μg/mL溴化乙锭的1%琼脂糖凝胶上电泳40min,恒压100V,采用DL2000为marker,凝胶成像系统照像。
1.4.2 ITS 反应体系及程序
选用通用引物ITS1和ITS4(ITS1:5’-TCCGTAGGTGAACCTGC-3’;ITS4:5’-TCCTCCGCTTATTGATATGC -3’)扩增5.8S rDNA及其两侧的ITS1和ITS2基因片段。PCR扩增反应在Bio-Rad iCycler thermal cycler上进行。反应体积为50μL,其成分为:模板:1μL,引物ITS 1和ITS 4(2×10-5mol/L)各 5μL(上海生工),10×PCR 缓冲液(pH8.3)5μL,dNTP(0.01mol/L)4μL(TaKaRa),Taq 酶(5U/μL)0.25μL(TaKaRa),无菌双蒸水定容至50μL。
ITS-PCR扩增条件:94℃预变性5 min;94℃1 min,54℃退火1 min,72℃延伸 1.5 min,循环 36 次,72℃延伸10min,产物于4℃保存。PCR扩增重复3次。
1.4.3 ITS 序列测定
采用PCR产物克隆测序,将PCR纯化产物与pMD18-T Vector(TaKaRa)连接后转化至大肠杆菌DH5a感受态细胞中,用含 X-Gal、IPTG、Amp的 LB平板进行蓝白筛选,挑取白色菌落培养,进行菌落PCR检测。克隆成功后,样品委托上海生工生物工程技术服务有限公司测序。测序在ABI Prism 3730XL仪器上进行,测序试剂为BigDye Terminator v3.1,采用单向测序。
1.5 数据统计与分析
1.5.1 SRAP 数据统计与分析
电泳图谱中每一条扩增带均代表了引物与模板DNA互补的一对结合位点,可记为一个分子标记,有带的记为1,无带的记为0,进行统计称0/1矩阵。利用NTSYS-pc(Version 2.10)软件进行聚类分析并构建系统聚类图。
1.5.2 ITS 系统发育树的构建
根据Keller et al的方法查找ITS序列,序列的比对采用软件 ClustalX 2.0。利用 BioEdit version 7.0.5 软件进行人工调整。运用统计分析和系统发育分析软件MEGA 4.1进行系统发育分析,以最大简约法(Maximum Parsimony,MP)构建系统发育树。
2 结果与分析
2.1 引物筛选及扩增情况
从48对SRAP引物中筛选出9对引物,共扩增出88条,其中具有多态性条带76条,占总带数的84.6%,平均每对引物扩增出条带9.7条,平均每对引物扩增出多态性条带8.4条,平均多态性比例为76.8%。SRAP所检测的9对标记在20个菌株中均具有明显的多态性,但每个标记所显示的多态信息含量不同。SRAP各标记的PIC变幅在0.048~0.918,以 ME3+EM2 引物组合的最高(0.918),ME4+EM8引物组合最低(0.048)。绝大多数标记的PIC值大于0.5,而衡量多态信息量高低的指标一般认为PIC>0.5 时,为高度多态位点[8]。平均 PIC 分别为 0.682,表明本研究所用菌株基因型丰富,遗传多样性较高,同时说明SRAP标记对黑木耳菌株具有较强的鉴别能力。
2.2 遗传相似性分析
根据扩增产物的电泳带型计算出SRAP标记20个菌株间遗传距离为0.122~0.507,ITS序列分析表明20个菌株间遗传距离为0.100~0.650,进一步说明了供试黑木耳菌株具有丰富的遗传多样性。对栽培菌株和野生菌株的遗传距离参数进行比较发现,栽培菌株的遗传距离及其变化范围和变异系数均小于野生菌株,二者的平均遗传距离差异达到显著水平(P<0.05),说明野生菌株的遗传基础较宽,两种分子标记均显示野生菌株之间的遗传距离(SRAP和ITS分别为0.405、0.368)大于栽培菌株间的遗传距离(SRAP和ITS遗传距离分别为0.339、0.320),表明野生菌株遗传多样性优于栽培菌株。如表2所示。
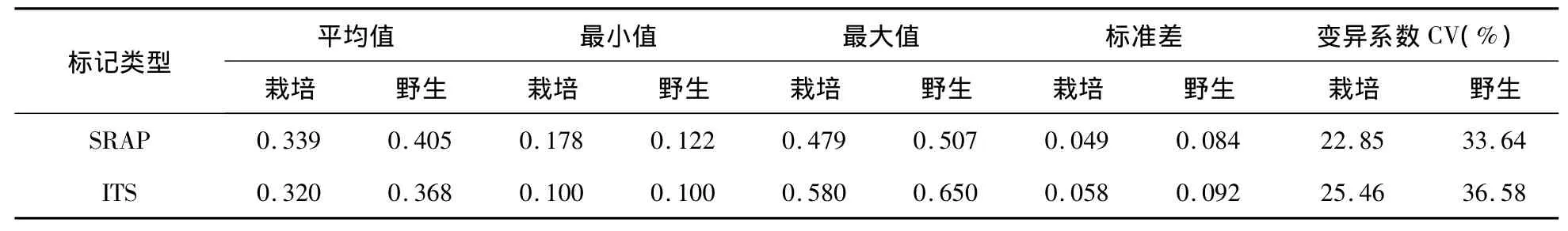
表2 栽培品种与野生品种的遗传距离参数Tab.2 Parameters of genetic distance between cultural and wild strains
2.3 构建遗传进化树
根据SRAP标记遗传距离,采用NTSYS软件对图谱进行聚类分析(图1),ITS序列用最大简约法构建系统发育树(图2)。在图1中可以看出,在系数为0.61水平上,SRAP将20个菌株可以分为2类,不同类菌株间有亲缘关系相对比较近的趋势,如在系数为0.65的水平上1、2、4、5号栽培菌株相对亲缘关系较近。个别野生菌株间亲缘关系较近,如16号与17号之间遗传相似系数为0.878。在图2中可以看出,20个黑木耳菌株聚为2大类,3、4、5、6号与8个野生菌株聚为一类,1、2号与6个野生菌株聚为一类,同样没有表现出野生菌株与栽培菌株各自聚类的趋势。黑木耳菌株栽培品种与野生菌株之间、野生菌株与野生菌株之间遗传多样性丰富,如3号(延明1号)与9号(LY)之间的遗传距离为0.65,同为加格达奇地区采集菌株11号(64)与14号(JGDQ)之间遗传距离为0.63,其余菌株相互间遗传距离均在0.01~0.65。两种方法所建聚类图大体相似,均体现出菌株间遗传多样性比较丰富,因此可为黑木耳由野生菌株选育成为栽培菌株提供较好的育种材料,同时亲缘关系远近可以为菌株间原生质体育种提供理论依据。

图1 SRAP标记遗传关系的聚类图Fig.1 Dendrogram of 20 Auricularia auricula strains generated by SRAP marker based on genetic distance

图2 用MEGA4.1软件分析的黑木耳系统树Fig.2 MP tree of Auricularia auricula analysised by MEGA4.1
3 讨论
目前国内外对野生黑木耳的种植资源研究处于空白状态。黑木耳的研究热点集中在国内人工栽培面积较大的几十个菌种。本研究中所用的48对SRAP引物在20个菌株中所显示的多态性不一致,18对引物多态性较低,21对引物多态性不稳定,9对引物能显示出较高且稳定的多态性,平均PIC值0.682,较高的多态信息含量说明SRAP标记具有较高的鉴别能力,可作为一种很好的品种鉴定手段。13个野生菌株遗传距离在0.0562~0.6937,高于李辉平研究中21个黑木耳菌株遗传距离在0.36~0.55的结果[9],说明野生菌株遗传多样性高于栽培菌株,可能是在人工育种过程中导致野生菌株部分遗传信息消失造成的。通过对14个野生黑木耳菌株的序列分析表明,大兴安岭地区野生黑木耳菌株遗传多样性丰富,ITS区序列信息位点丰富,不同的野生黑木耳类群均有多个特异性的单核苷酸变异位点,当根据黑木耳的形态和性状难以鉴别区分时,采用ITS序列对黑木耳属资源评价和遗传育种研究具有一定指导意义。从结果看,ITS和SRAP都能很好地对黑木耳进行聚类分析,而且产生的结果相似,说明两者相结合能更好地用于黑木耳的遗传多样性分析。
[1] 卯晓岚.中国经济真菌[M].北京:科学出版社,1998:551-552.
[2] Liu L,Guo W,Zhu X,et al.Inheritance and fine mapping of fertility-restoration for cytoplasmic male sterility in Gossypium hirsutum L[J].Theor Appl Genet,2003,(106):461 - 469.
[3]江香梅,温强,叶金山,等.闽楠天然种群遗传多样性的RAPD分析[J].生态学报,2009,29(1):438 -444.
[4] Li G,Quiros CF.Sequence - related amplified polymorphism(SRAP),a new marker system based on a simple PCR reaction:its application to mapping and gene tagging in Brassica[J].Theor Appl Genet,2001,(103):455 -461.
[5] Qian WC,Zhang GH Chen FX,et al.Characteristics of SRAP markers in detecting polymorphism of cucumber genome[J].Hereditas,2006,28(11):1435 -1439.
[6] Tedersoo L,Suvi T,Jairus T,et al.Revisiting ectomycorrhizal fungi of the genus Alnus:differential host specificity,diversity and deter- minants of the fungal community[J].The New Phytologist,2009,182(3):727 -735.
[7] Geml J,Laursen GA,Timling I,et al.Molecular phylogenetic biodiversity assessment of arctic and boreal ectomycorrhizal Lactarius Pers.(Russulales;Basidiomycota)in Alaska,based on soil and sporo- carp DNA[J].Molecular Ecology,2009,18(10):2213-2227.
[8] Botstein D,White RL,Skolnick M,et al.Construction of a genetic linkage map in man using restriction fragment length polymorphisms[J].American Journal of Human Genetics,1980,(32):314-331.
[9]李辉平,黄晨阳,陈强,等.黑木耳栽培菌株的ISSR分析[J].园艺学报,2007,34(4):935 -940.

