南瓜酒抗氧化活性及其与VC、多酚和多糖含量的关系
张靖媛,吴 昊,王凤舞,张宏斌,王成荣,*
(1.青岛农业大学食品科学与工程学院,山东 青岛 266109;2.青岛市农业科学研究院,山东 青岛 266100)
南瓜酒抗氧化活性及其与VC、多酚和多糖含量的关系
张靖媛1,吴 昊1,王凤舞1,张宏斌2,王成荣1,*
(1.青岛农业大学食品科学与工程学院,山东 青岛 266109;2.青岛市农业科学研究院,山东 青岛 266100)
采用1,1-二苯基-2-三硝基苯肼自由基(DPPH自由基)法、羟自由基(•OH)体系和超氧阴离子自由基(O2—•)体系对南瓜酒的抗氧化活性进行研究,并分析南瓜酒中VC、多酚和多糖含量与抗氧化活性之间的相关性。结果表明:南瓜酒对DPPH自由基、•OH和O2—•均具有较强的清除效果,且呈明显的剂量效应关系,其清除效果优于相同用量条件下的南瓜提取液;同时表明VC、多酚和多糖是南瓜酒的主要抗氧化活性成分。
南瓜酒;DPPH自由基;羟自由基;超氧阴离子自由基
研究表明,果蔬中富含的多酚、VC、类胡萝卜素及VE等抗氧化成分具有预防癌症和心血管疾病发生、抑制由过量自由基引起的炎症、衰老等多种疾病的生理作用[1-4]。南瓜果实富含各种维生素、矿物质、果胶、类胡萝卜素、氨基酸、多糖和生物碱等营养成分和活性成分[5-6],具有多种食疗保健作用和药用价值。目前,对新型南瓜精深加工产品üü南瓜酒的研究多集中在加工工艺对其品质的影响[7-9],对其抗氧化活性的研究较少。本实验采用1,1-二苯基-2-三硝基苯肼(DPPH)自由基法、羟自由基(•OH)法和超氧阴离子自由基(O2—•)法对南瓜酒的抗氧化活性进行测定,为南瓜酒的进一步开发和推广提供依据。
1 材料与方法
1.1 材料与试剂
南瓜为小磨盘品种,2010年11月购于青岛城阳蔬菜批发市场;SY酵母(Q/YB.J02.5) 湖北安琪酵母股份有限公司;果胶酶(30000U/g) 天津利华酶制剂技术有限公司;糖化酶(80000U/g) 邢台万达生物工程有限公司;南瓜酒(酒精度8.0%)为自酿。
抗坏血酸(VC)、草酸、2,6-二氯酚靛酚、福林酚、碳酸钠、浓硫酸、苯酚、磷酸氢二钠、磷酸二氢钠、邻菲罗啉、硫酸亚铁、双氧水、邻苯三酚、盐酸、三羟甲基氨基甲烷(Tris)、邻苯三酚等均为国产分析纯;1,1-二苯基-2-三硝基苯肼(DPPH) 美国Sigma公司。
1.2 仪器与设备
SPX-250B-Z型生化培养箱 上海博讯实业有限公司医疗设备厂;HH.S11-1型电热恒温水浴锅 龙口市先科仪器公司;SL-300型榨汁机 天津市达康电器有限公司;MSZ02500正压过滤器 上海摩速器材有限公司;MLS-3750型SANYO立式高压灭菌锅 日本三洋电器集团;754型紫外-可见分光光度计 上海光谱仪器有限公司;TGL-10B高速台式离心机、GL-20C冷冻离心机上海安亭科学仪器厂。
1.3 方法
1.3.1 样品制备
1.3.1.1 南瓜提取液的制备
取新鲜南瓜10g,加入10mL 80%乙醇溶液研磨提取,10000r/min冷冻离心15min,取上清液,残渣重复提取2次,合并上清液定容至50mL。
1.3.1.2 南瓜酒的制备
南瓜酒酿造工艺:南瓜→去皮籽→切片→热烫→打浆→酶解→过滤→灭菌→调整→添加SO2→接种酵母菌→发酵→过滤→除菌→成品。
操作要点:按质量分数0.16%和0.30%添加果胶酶和糖化酶,50℃条件下酶解1.5h;添加蔗糖并用手持式糖度计测定糖度,将初始糖度调整为18%,杀菌后添加80mg/L的SO2,并接种已活化的酵母菌,接种量0.10%,发酵温度25.8℃,于生化培养箱中发酵130h。
1.3.2 VC含量的测定
采用2,6-二氯酚靛酚滴定法[10]进行测定。
1.3.3 多酚含量的测定
采用Folin-Ciocalteau法[11]进行测定,结果以没食子酸计。
1.3.4 多糖含量的测定
采用苯酚-硫酸法[12]进行测定。
1.3.5 南瓜酒的抗氧化能力测定
1.3.5.1 DPPH自由基清除率的测定
参考Shimada[13]、Brandwilliams[14]等的方法并改进。将25mg/L的DPPH自由基醇溶液加入到2mL含有0.4、0.7、1.0、1.3、1.6mL样品的水溶液中。于避光处37℃水浴30min,于517nm波长处测定吸光度。以1g/L的VC作为阳性对照。以蒸馏水作为空白对照。DPPH自由基清除率按式(1)计算。
式中:A0为空白对照在517nm波长处的吸光度;A1为样品在517nm波长处的吸光度。
1.3.5.2 gOH清除率的测定
采用邻二氮菲-金属铁离子-H2O2体系[15-16]。取pH7.4、0.2mol/L的磷酸缓冲液4.0mL和蒸馏水16.0mL于试管中,混匀作为空白管;取4.0mL磷酸缓冲液、3.0mL邻二氮菲(5.0mmol/L,以蒸馏水将50mmol/L邻二氮菲无水乙醇溶液稀释)、2.0mL 7.5mmol/L的FeSO4和11.0mL蒸馏水于试管中,混匀作为未损伤管;取4.0mL磷酸缓冲液、3.0mL邻二氮菲、2.0mL FeSO4、9.0mL蒸馏水和2.0mL质量分数0.1%的H2O2于试管中,混匀作损伤管;取4.0mL磷酸缓冲液、3.0mL邻二氮菲、2.0mL FeSO4、 2.0mL H2O2和9.0mL含有0.4、0.7、1.0、1.3、1.6mL样品的水溶液,混匀作样品管(其中H2O2为最后添加)。将上述各组加样摇匀后于37℃水浴60min,于510nm波长处测定吸光度。以1g/L的VC作为阳性对照。gOH清除率按式(2)计算。
式中:A样品为样品管在510nm波长处的吸光度;A损伤为损伤管在510nm波长处的吸光度;A未损为未损伤管在510nm波长处的吸光度。
1.3.5.3 O2—•清除率的测定
采用邻苯三酚自氧化法[17]。在试管中加入6.0mL pH8.2的Tris-HCl缓冲液,2mL含有0.4、0.7、1.0、1.3、1.6mL样品的水溶液,(25.0f0.5)℃水浴平衡20min后,加入0.6mL 7mmol/L的邻苯三酚准确反应3min,加入1mL 10mol/L HCl溶液终止反应,于420nm波长处测定吸光度。以1g/L的VC作为阳性对照。以蒸馏水作为空白对照。O2—•清除率按式(3)计算。
式中:A0为空白对照液的吸光度;Ai为样品组的吸光度;Aj为样品溶液本身的吸光度,以蒸馏水代替显色剂的吸光度。
1.3.6 数据统计
采用Origin8.1和SPSS18.0软件进行数据处理和统计分析。所有样品均平行测定3次,测定结果以fs表示;相关性分析采用相关系数法,显著性界值为P<0.05,极显著界值为P<0.01。
2 结果与分析
2.1 南瓜酒对DPPH自由基的清除能力

图 1 南瓜酒对DPPH自由基的清除作用Fig.1 DPPH radical scavenging activity of pumpkin wine
DPPH自由基是一种稳定的深紫色自由基,加入抗氧化剂后,抗氧化剂可与其反应生成无色的1,1-二苯基-2-三硝基苯胺[18]。由图1可知,南瓜酒和南瓜提取液对DPPH自由基均具有清除作用,且在用量范围内呈明显的剂量效应关系。在用量为0.4~1.3mL时,南瓜酒对DPPH自由基清除率随用量增加明显增大,增幅为53.83%,当用量进一步增加至1.6mL时,南瓜酒对DPPH自由基清除率增幅不明显,仅为5.10%,但超过了相同用量下VC对DPPH自由基的清除率。当用量0.4mL时,南瓜提取液对DPPH自由基清除率为9.17%,当用量为1.6mL时,清除率达到20.32%,增幅为11.15%。由此可见,南瓜酒对DPPH自由基清除效果明显优于南瓜提取液。
2.2 南瓜酒对•OH的清除能力

OH的清除作用Fig.2 Hydroxyl radical scavenging activity of pumpkin wine图 2 南瓜酒对•
•OH是已知活性最强的氧化剂,在很多缓冲溶液中,只要产生•OH就会与缓冲溶液反应,并且可以和所有细胞成分反应,对机体危害极大[19]。由图2可知,在0.4~1.0mL用量范围内,南瓜酒对•OH清除率随用量增加明显增大,增幅为24.87%,继续增加用量,清除率增幅变缓,在南瓜酒用量超过0.7mL时,对•OH清除率明显高于VC。南瓜提取液在整个实验用量范围内对•OH清除率呈缓慢上升趋势,增幅均小于南瓜酒。由此可见,南瓜酒对•OH清除能力优于南瓜提取液和VC。
2.3 南瓜酒对O2—•的清除能力O2
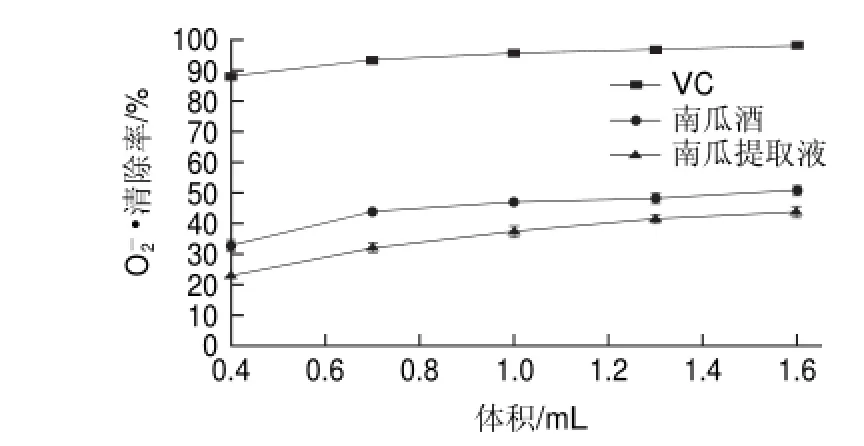
Superoxide anion radical scavenging activity of pumpkin wine的清除作用Fig.3图 3 南瓜酒对O-2g
—•是一种有氧激发的自由基,正常情况下,细胞内超氧化物歧化酶和谷胱甘肽过氧化物酶等抗氧化酶类可以及时将其清除,因此对机体无有害影响。病理条件下,由于O2—•的生成过多和机体抗氧化酶类活性下降,导致体内O2—•大量积累而对细胞造成损伤[20-21]。由图3可知,在实验用量范围内,南瓜酒和南瓜提取液对O2—•清除率呈剂量效应关系。当用量为0.4mL时,其清除率分别为32.62%和23.09%,用量增加到1.6mL时,清除率分别为49.40%和43.73%,前者明显高于后者,但均未超过VC对O2—•的清除率。
邻苯三酚在碱性条件下,能迅速自氧化释放出O2—•,并生成一系列有强烈光吸收的中间产物。由图4的南瓜酒和南瓜提取液在O2—•清除体系中的动力学曲线可知,在3min的反应时间内,加入南瓜提取液的体系其吸光度始终高于加入南瓜酒的体系,说明加入南瓜提取液的体系中邻苯三酚自氧化产物颜色深,O2—•浓度较高,进一步说明南瓜酒对O2—•清除能力优于南瓜提取液。

图 4 吸光度随时间变化的动力学曲线Fig.4 Dynamic changes in the absorbance of pumpkin wine and pumpkin extract over time
2.4 南瓜酒清除不同自由基能力的比较
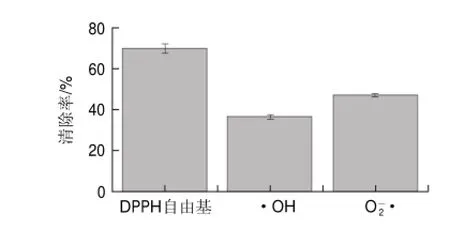
图 5 南瓜酒对3种自由基的清除效果Fig.5Comparison of scavenging activity of pumpkin wine against DPPH, hydroxyl and superoxide anion radicals
由图5可知,在相同的1.0mL用量条件下,南瓜酒对DPPH自由基、•OH、•的清除率明显不同,分别为69.68%、36.46%、46.95%,其对不同自由基清除效果依次为DPPH自由基>•>•OH。
2.5 南瓜酒中VC、多酚、多糖与抗氧化能力及不同抗氧化测定方法间的相关性分析
经测定,南瓜酒中VC、多酚和多糖含量分别为6.75、71.47、10.21mg/L。由表1可知,南瓜酒对DPPH自由基、•OH、O2—•的清除效果与VC、多酚和多糖含量之间存在显著的相关性(P<0.05),其中南瓜酒对DPPH自由基清除效果与VC、多酚和多糖含量以及对•OH清除效果与多糖含量之间均达到极显著水平(P<0.01)。表明南瓜酒的抗氧化作用与其中的VC、多酚和多糖含量之间存在显著相关性,即南瓜酒的抗氧化作用与其中所含的VC、多酚和多糖有关。为明确各成分在清除自由基时是否存在干扰,进行了偏相关性分析,由表2可知,P>0.05,说明3种成分在清除DPPH自由基、gOH及O2—g时不存在显著相关性,即VC、多酚和多糖清除自由基时没有表现出增效作用。

表1 南瓜酒活性物质与抗氧化活性的相关性Table 1 Correlation between active components and radical scavenging activity of pumpkin wine

表 2 南瓜酒抗氧化活性与各活性物质的偏相关性Table 2 Partial correlation between active components and radical scavenging activity of pumpkin wine
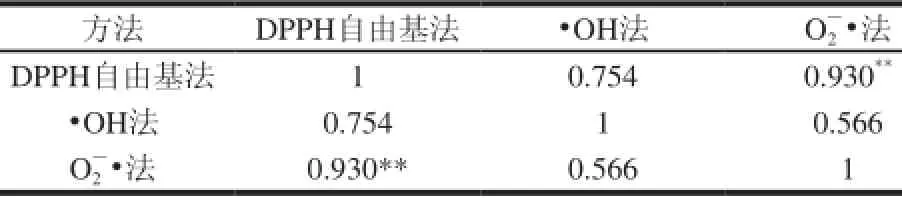
表 3 不同抗氧化性测定方法的相关性分析Table 3 Partial Correlation among scavenging activity of pumpkinwine against DPPH, hydroxyl and superoxide anion radicals
由表3可知,DPPH自由基法与O2—•法分析结果具有极显著正相关性(P<0.01);DPPH自由基法与•OH法分析结果、•OH法与O2—•法分析结果之间的相关系数分别为0.754和0.566,不存在统计学上的相关性(P>0.05)。
3 讨 论
抗氧化活性的研究方法分为体内实验和体外实验两类,其中体外实验简单、快捷,应用较多。体外测定抗氧化及自由基清除能力的方法包括分光光度法、荧光法、化学发光法、色谱法、电子自旋共振法、毛细管凝胶电泳法等。由于作用机理不同,抗氧化剂在不同的体系或介质中显示出不同的抗氧化或促氧化作用,所以对任何一种抗氧化剂的评估都与实验体系紧密相关,单一的体系往往很难全面体现其生物学意义,需要多种体系相互补充,来研究其在不同体系的真实效应[22]。南瓜酒作为一个复杂的混合体系,评估其抗氧化活性也是如此。本实验采用DPPH自由基法、•OH法、O2—•法对南瓜酒的抗氧化性进行综合评价,结果表明,南瓜酒对3种自由基均表现出较强的清除效果,且清除能力明显优于新鲜南瓜提取液,说明南瓜发酵成南瓜酒,能有效提高其抗氧化活性和功能性。
对南瓜酒中活性成分与其抗氧化能力的相关性进行分析后发现,VC、多酚和多糖与DPPH自由基、•OH和O2—•清除能力均存在显著相关性。其中南瓜酒清除DPPH自由基和O2—•时,VC、多酚和多糖均做出了重要贡献;清除•OH时,VC和多糖起主要作用。对其他果蔬和果蔬汁中VC和多酚与抗氧化活性之间关系的研究结果[23-25]与本实验相一致。多酚的抗氧化性与其化学结构密切相关,其主要的活性结构包括羟基、甲基化、聚合度、糖苷化等[26],南瓜酒中究竟是多酚的哪一种或几种活性结构对其抗氧化活性做出了贡献,尚需做进一步的研究。柳红[27]对南瓜提取物多糖清除•OH和O2—•的研究得出了与本实验一致的结果。对不同来源的多糖抗氧化活性研究时发现,多糖分子上的还原性醛羟基和羟基可使具有高度氧化性的自由基还原,阻止自由基的连锁反应[27],说明这2种结构是使多糖表现出抗氧化能力的重要结构。芮海云等[28]研究白芨多糖的抗氧化性时进一步证明了这一观点,即硫酸酯化的白芨多糖能有效抑制反应体系中O2—•的产生,提示化学修饰使原来包裹在内的羟基裸露出来。
南瓜酒中除VC、多酚和多糖几种生理活性成分含量与其抗氧化活性密切相关外,其他成分如自由氨基酸、肽类和美拉德反应产物等对其抗氧化活性是否做出了贡献,有待于进一步的研究。
4 结论
南瓜酒对DPPH自由基、•OH、O2—•均具有较强的清除能力,且清除效果呈明显的剂量效应关系;南瓜酒的抗氧化活性明显优于相同用量条件下的南瓜提取液;VC、多酚和多糖是南瓜酒的主要抗氧化活性成分。
[1] SHUI G H, LEONG L P. Analysis of polyphenolic antioxidants in star fruit using liquid chromatography and mass spectrometry[J]. Journal of Chromatography A, 2004, 10(22): 67-75.
[2] HUXLEY R R, NEIL H A W. The relationship between dietary fl avonol intake and coronary heart disease mortality: a meta-analysis of prospective cohort studies[J]. European Journal of Clinical Nutrition, 2003, 57(8): 904-908.
[3] KNEKT P, KUMPULAINEN J, JARVINEN R, et al. Flavonoid intake and the risk of chronic disease[J]. American Journal of ClinicalNutrition, 2002, 76(3): 560-568.
[4] PESCHEL W, SANCHEZ-RABANEDA F, DIEKMANN W, et al. An industrial approach in the search of natural antioxidants from vegetable and fruit wastes[J]. Food Chemistry, 2006, 97(1): 137-150.
[5] KOWALSKA H, LENART A, LESZCZYK D. The effect of blanching and freezing on osmotic dehydration of pumpkin[J]. Journal of Food Engineering, 2008, 86(1): 30-38.
[6] JUN H, LEE C H, SONG G S, et al. Characterization of the pectic polysaccharides from pumpkin peel[J]. Food Science and Technology, 2006, 39: 554-561.
[7] 黄儒强, 郭倩玉, 陈杰, 等. 南瓜酒发酵工艺条件的研究[J]. 食品科学, 2007, 28(8): 227-230.
[8] 王丽威, 郑彦山, 陶敏慧, 等. 低醇南瓜汁饮料发酵工艺条件的优化[J]. 西北农业学报, 2010, 19(2): 194-197.
[9] 郑海鹏. 南瓜酒发酵工艺及香气成分变化研究[D]. 重庆: 西南大学, 2009.
[10] 曹建康, 姜微波, 赵玉梅. 果蔬采后生理生化实验指导[M]. 北京: 中国轻工业出版社, 2007: 34-37.
[11] SLINKARD K, SINGLETON V L. Total phenol analyses: automation and comparison with manual methods[J]. American Journal Enology and Viticulture, 1977, 28: 49-55.
[12] 严奉伟, 罗祖友, 吴季勤, 等. 菜籽多糖的抗氧化作用与机理研究[J].中国农业科学, 2005, 38(1): 157-162.
[13] SHIMADA K, FUJIKAWA K, YAHAR A, et al. Antioxidative properties of xanthin on autoxidation of soybean oil in cyclodextrin emulsion[J]. Journal of Agricultural and Food Chemistry, 1992, 40: 945-948.
[14] BRANDWILLIAMS W, CUVELIER M E, BERSET C. Use of a freeradical method to evaluate antioxidant activity[J]. Food Science and Technology, 1995, 28(1): 25-30.
[15] LIU Chunhui, WANG Changhai, XU Zhiliang, et al. Isolation, chemical characterization and antioxidant activities of two polysaccharides from the gel and the skin of Aloe barbadensis Miller irrigated with sea water[J]. Process Biochemistry, 2007, 42(6): 961-970.
[16] 金鸣, 蔡亚欣, 赵辉, 等. 邻二氮菲-Fe2+氧化法检测H2O2/Fe2+产生的羟自由基[J]. 生物化学与生物物理进展, 1996, 23(6): 553.
[17] 吴雪辉, 张喜梅, 李延群, 等. 板栗花粗提物的抗氧化活性研究[J].现代食品科技, 2008, 24(1): 14-19.
[18] SOARES A A, de SOUZA C G M, DANIEL F M, et al. Antioxidant activity and total phenolic content of Agaricus brasiliensis (Agaricus blazei Murril) in two stages of maturity[J]. Food Chemistry, 2009, 112: 775-781.
[19] 杜晓丹, 宋纪荣, 徐抗震, 等. 苹果酒抑制自由基的研究[J]. 西北大学学报, 2006, 36(4): 578-582.
[20] GULCIN I, OKTAY M, KIRECCT E, et al. Screening of antioxidant and antimicrobial activities of anise (Pimpinella anisum L.) seed extracts[J]. Food Chemistry, 2003, 83: 371-382.
[21] 阙斐. 黄酒的抗氧化活性及其中的酚类物质[D]. 杭州: 浙江大学, 2006.
[22] 顾海峰, 李春美, 徐玉娟, 等. 柿子单宁的制备及其抗氧化活性研究[J]. 农业工程学报, 2007, 23(5): 241-245.
[23] DU Guorong, LI Mingjun, MA Fengwang, et al. Antioxidant capacity and the relationship with polyphenol and vitamin C in Actinidia fruits[J]. Food Chemistry, 2009, 113: 557-562.
[24] GARDNER P T, WHITE T A C, MCPHAIL D B, et al. The relative contributions of vitamin C, carotenoids and phenolics to the antioxidant potential of fruit juices[J]. Food Chemistry, 2000, 68: 471-474.
[25] 朱玉昌, 周大寨, 焦必宁, 等. 甜橙中不同活性成分与总抗氧化能力关系的研究[J]. 食品科学, 2008, 29(5): 82-86.
[26] 王晓宇. 葡萄酒抗氧化活性及其检测方法的研究[D]. 杨陵: 西北农林科技大学, 2008.
[27] 柳红. 南瓜多糖的修饰、结构分析及抗氧化活性的研究[D]. 西安:陕西师范大学, 2008.
[28] 芮海云, 吴国荣, 陈景耀, 等. 白芨中性多糖抗氧化性作用的实验研究[J]. 南京师范大学学报, 2003, 26(4): 94-98.
Correlation between Antioxidant Activity and Contents of VC, Polyphenols and Polysaccharides in Pumpkin Wine
ZHANG Jing-yuan1,WU Hao1,WANG Feng-wu1,ZHANG Hong-bin2,WANG Cheng-rong1,*
(1. College of Food Science and Engineering, Qingdao Agricultural University, Qingdao 266109, China;2. Qingdao Academy of Agricultural Sciences, Qingdao 266100, China)
The antioxidant potential of pumpkin wine was evaluated by measuring its scavenging activity against DPPH, hydroxyl and superoxide anion radicals and analyzed for its correlation with the contents of VC, polyphenols and polysaccharides. Pumpkin wine had strong scavenging activity against DPPH, hydroxyl and superoxide anion radicals in a dosedependent fashion, and its radical scavenging activity was better than that of pumpkin extract at the same dose. Meanwhile, our results suggested that VC, polyphenols and polysaccharides were the dominant antioxidant components in pumpkin wine.
pumpkin wine;DPPH radical;hydroxyl radical;superoxide anion radical
TS201.4
A
1002-6630(2013)01-0078-05
2011-11-11
山东省现代蔬菜产业技术体系
张靖媛(1987ü),女,硕士研究生,研究方向为果树深加工。E-mail:hollad_1@163.com
*通信作者:王成荣(1958ü),男,教授,研究方向为果蔬深加工及贮藏。E-mail:qauwcr@126.com

