蝉花虫草中核苷类成分的分离纯化和鉴定
陈安徽,陈宏伟,徐 洋,卓 涛,邵 颖*
(徐州工程学院食品生物工程学院,江苏 徐州 221008)
蝉花虫草中核苷类成分的分离纯化和鉴定
陈安徽,陈宏伟,徐 洋,卓 涛,邵 颖*
(徐州工程学院食品生物工程学院,江苏 徐州 221008)
对蝉花虫草子实体中的核苷类成分进行分离纯化,并对获得的组分进行鉴定。结果显示:采用65%乙醇超声波法提取的蝉花虫草子实体提取物于10000r/min离心5min后,经反相HPLC制备液相制备(色谱条件为:流动相为0~100%甲醇,梯度洗脱,洗脱速率为15mL/min,进样量1mL,检测波长260nm),分离得到6种主要化合物,经鉴定,6种化合物均为核苷类产品,分别为胞嘧啶、尿苷、肌苷、鸟苷、腺苷和虫草素。对6种化合物进行纯度验证,结果表明,6种化合物的纯度均在95%以上,说明采用反相HPLC分离制备蝉花虫草中的核苷类成分方法是可行的,并且该方法简便、准确。
蝉花;核苷;分离纯化;鉴定
蝉花(Cordyceps cicadae)隶属真菌门、子囊菌纲、麦角菌目、麦角菌科、虫草属,是一种具有保健功能的大型药食两用真菌,亦是我国传统的名贵中药,富含多糖、核苷、甘露醇、麦角甾醇等多种活性物质[1-2]。许多学者对蝉花生理活性及其活性成分进行过广泛研究。如刘森琴等[3]研究发现,人工蝉花的虫草酸含量和野生蝉花相当,虫草多糖含量则高达110.09mg/g,腺苷含量较野生蝉花低,虫草素未能检出,但4种活性成分总量是野生蝉花的1.55倍。周俐斐等[4]采用水提醇沉法提取水溶性粗多糖,经Sevag法除蛋白、透析和活性炭脱色制备得到蝉花总多糖,采用苯酚硫酸法测定多糖含量,发现该系列纯化方法能有效地去除核酸、蛋白质、小分子物质等杂质成分,使蝉花总多糖的含量达到50%以上,且苯酚-硫酸法测定蝉花总多糖含量简便、准确、重现性好。Odier等[5]发现一种蝉拟青霉培养物中具有抗菌和免疫抑制作用的多球壳菌素Myriocin。另外,药理学研究还表明蝉花虫草具有镇静催眠、提高免疫、抗菌、降低血糖等多种药理活性[6-11]。
虽然对蝉花虫草及其无性型蝉拟青霉的相关研究已有较多的报道,但尚未见对蝉花虫草中核苷类成分的系统研究报道。本研究对采集自浙江省的野生蝉花虫草的65%乙醇提取物中的核苷类成分进行分离纯化,并对获得的成分进行初步鉴定,为蝉花虫草中核苷类活性物质的进一步结构研究及其相关食品、保健品、药品等的开发提供理论依据。
1 材料与方法
1.1 材料
1.1.1 样品来源
蝉花野生虫草子实体由徐州恒源生物工程有限公司提供。
1.1.2 试剂与仪器
核苷类标准品 美国Sigma公司;无水乙醇为国产分析纯;甲醇、乙腈为国产色谱纯。
TUMEN TL-15高速离心机 吉林图们离心机厂;梅特勒AE200型电子天平 上海分析仪器厂;SENCO R-502B型旋转蒸发器 上海申胜生物技术公司;高效硅胶板GF254青岛海洋化工厂分厂;5µm ODS2分析柱(4.6mmh250mm)、5µm ODS2反相C18制备柱(20mmh250mm) 美国Waters公司;UV730D检测器、SP930高压泵、Autochro化学工作站 韩国Younglin公司。
1.2 方法
1.2.1 菌株的培养及样品的准备
准确称取200g样品粉碎(过60目筛),置于2000mL广口瓶中,加入1000mL 65%乙醇溶液超声波浸提(功率550W,频率40kHz)30min,过滤取上清液,溶液经0.45µm微孔滤膜过滤,配成适当浓度溶液进行反相HPLC分析制备。
分别准确称取腺苷、尿苷、鸟苷、肌苷、胞苷、胸苷、腺嘌呤、虫草素各0.0100g,置于10mL的容量瓶,用65%乙醇溶解并稀释至刻度,摇匀。准确吸取适量上述各标准品溶液,分别用65%乙醇稀释成一系列浓度的溶液,得标准溶液。
1.2.2 样品的分离与制备
将样品溶解于适量的甲醇(色谱纯)中,通过反相HPLC进行制备。色谱条件为:0~100%甲醇,梯度洗脱;分析时洗脱速率1mL/min,进样量20μL;制备时洗脱速率为15mL/min,进样量1mL;检测波长260nm。
样品收集:按峰收集。收集到的各个组分用旋转蒸发仪于40℃减压浓缩后用反相HPLC方法在不同洗脱梯度及不同波长条件下进行收集。
1.2.3 核苷类成分的纯度验证及鉴定
取纯化后的样品配制成0.1mg/mL的甲醇溶液进行质谱分析。电离方式为ESI:正离子4000V,碎片能量215,负离子电压—3500V,碎片能量175,干燥气温度均为300℃,喷嘴气压30psi,气流10L/min。DAD检测器进行全波长扫描。根据高分辨HPLC-MS得到的精确分子质量及分子式,从天然产物数据库中搜索,得到其有关性质和结构式。如果活性化合物与相应标准品的高效薄层色谱、HPLC及UV图谱进行比对,发现其Rf值、保留时间及紫外图谱特征完全一致,即可初步判断化合物与标准品为同种成分,则不进行HPLC-MS分析。
2 结果与分析
2.1 蝉花虫草子实体提取物的反相HPLC分析
将蝉花虫草子实体的提取物用65%乙醇配成1mg/mL的溶液,进行反相HPLC分析。分析结果如图1所示。
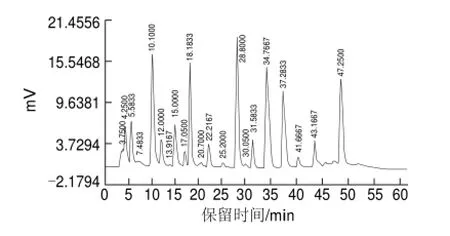
图 1 蝉花虫草子实体提取物的反相HPLC 图Fig.1 HPLC prof i le of nucleoside extract
高效液相色谱分析过程中,在同一色谱条件下,不同物质的出峰时间不同,同一物质在不同波长条件下产生的色谱峰面积大小也不相同,因而可以依据色谱峰的出峰保留时间初步判断化合物的种类。由图1可以看出,在本色谱条件下,各组分间样品分离情况较好,提取物色谱图中有6个主要色谱峰,这说明提取物中含有6种主要成分。
2.2 样品的分离制备
根据2.1节的分析结果,将提取物配成100mg/mL的样品液进行反相HPLC制备,进样量为1mL,分别收集保留时间10.1000、18.1833、28.3000、34.7667、37.2833、47.2500min色谱峰处的洗脱相,为保证样品的纯度,分别收集各洗脱峰中间的洗脱相,出峰初期和后期均不收集,连续制备10次,收集各洗脱相,相同保留时间的洗脱相合并收集到的样品,根据出峰先后顺序依次将样品标记为样品1~6。
2.3 样品的纯度验证
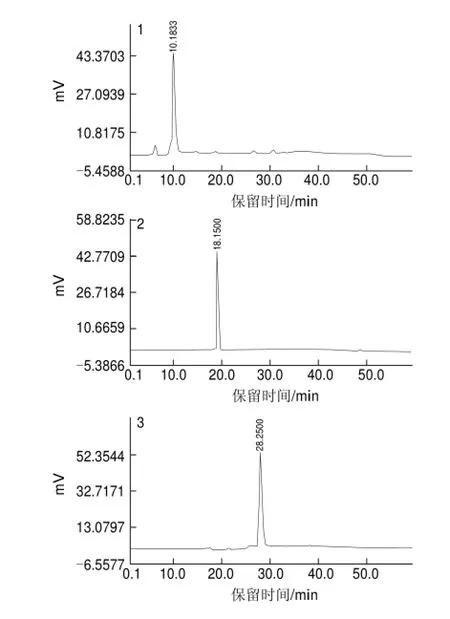
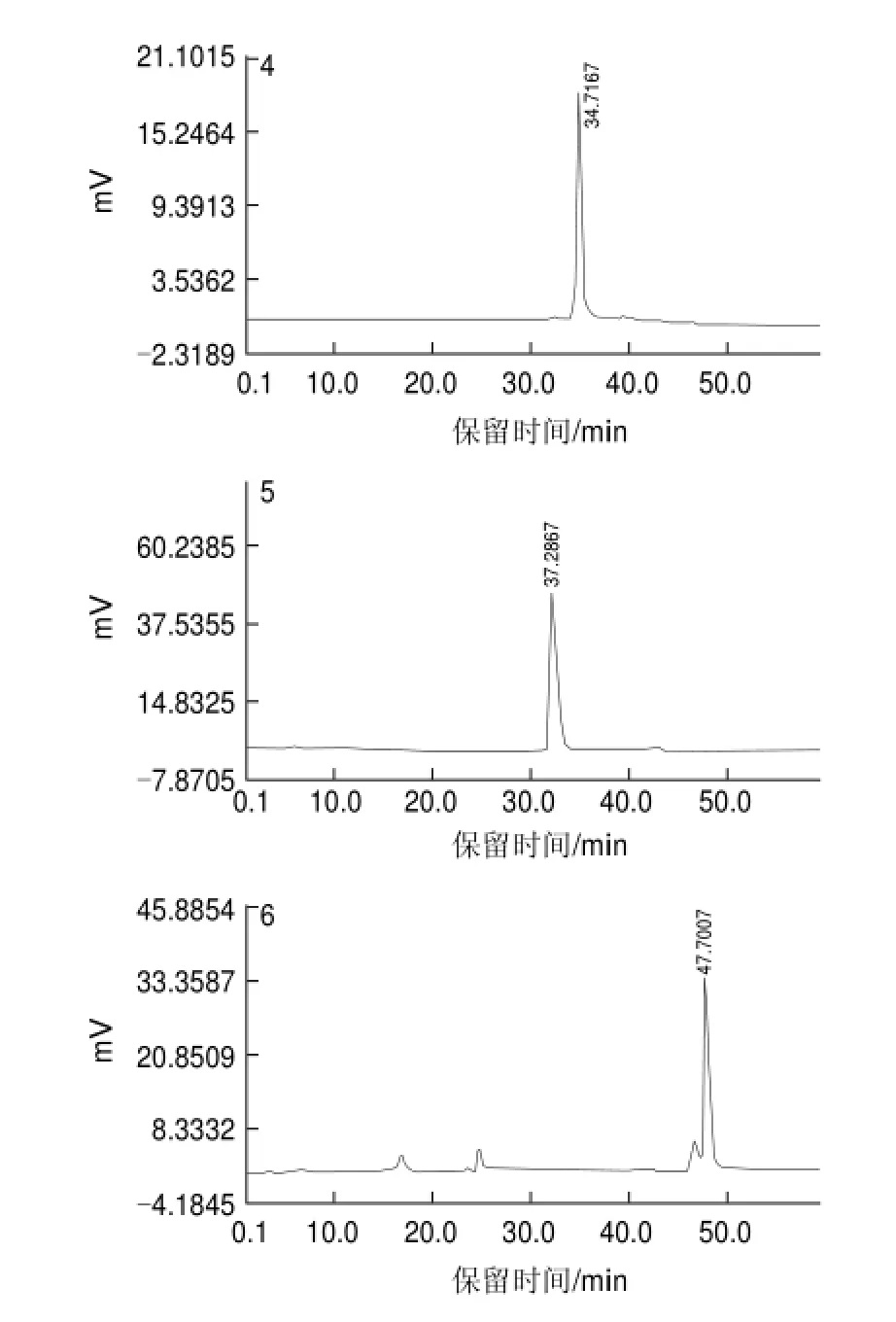
图 2 样品1~6的反相HPLC图Fig.2 HPLC prof i les of samples 1 through 6
由图2可知,经过不同的洗脱条件和波长检测条件下进行反相HPLC分析,其中样品2、3、4、5的色谱图上均只出现一个主峰,初步判定该4种样品为单一成分。样品1和样品6在260nm波长条件下,两样品在色谱图上除一主峰外均有杂峰出现,说明这两组分不纯。对样品1和样品6进行进一步制备,直至在不同条件下色谱图上均出现单一色谱峰。
分别对分离得到的6种样品的液相色谱图进行积分,得出峰面积积分表,分别考察各样品的峰面积百分比,计算各样品的纯度。研究结果表明样品1~6的百分含量分别为98.89%、99.15%、97.99%、98.96%、99.32%和98.68%,这说明通过HPLC多次制备,即可获得纯度较高的分离样品。
2.4 样品的鉴定
将样品液和标准品溶液在同等条件下进行反相HPLC分析,通过比较保留时间和样品液中加标样确认待测成分的峰位,初步判断样品的种类。通过比较分析发现样品2、3、4在同等色谱条件下,保留时间分别与腺嘌呤、肌苷、鸟苷标准品出峰时间完全一致,对此3种样品的高效薄层色谱、UV图谱进行比对,发现其Rf值、紫外图谱特征完全一致,故判断样品2、3、4分别为腺嘌呤、肌苷、鸟苷。在研究过程中发现样品1、5、6保留时间分别与尿苷、腺苷和虫草素标准品的保留时间相近,但不完全一致。在样品液中分别加入保留时间相近的标样进行反相HPLC分析,结果发现色谱图上均只有一条主峰出现。为进一步确定3种样品的种类,对3个样品进行进一步的HPLC-MS分析。
样品1对应的色谱图上有一个色谱峰,其MS阴离子图谱中有较强的离子峰。阴离子仅有质荷比为243.0652的峰,它对应的分子式是C9H11N2O6(误差为2.09h10—6),其对应的峰应该是(M—H)—峰。从其紫外光谱图上可看到,该化合物的特征吸收波长为260nm。由阴离子质谱图,可知该化合物的准确分子式为C9H12N2O6。根据其分子式和紫外吸收性质,并经天然产物数据库查询发现,该化合物与已报道的尿苷分子式完全一致。综合考虑样品1与尿苷的高效薄层色谱及UV图谱进行比对,发现其Rf值及紫外图谱特征完全一致。因此,鉴定样品1为尿苷。
样品5的MS阴离子色谱图上有一个色谱峰,阴离子质荷比为266.0897,对应的分子式为C10H12N5O4(误差0.83),经计算其对应的峰应该是(M—H)—峰。综合考虑样品5与腺苷的高效薄层色谱、反相HPLC及UV图谱的比较分析结果,鉴定样品5为腺苷。
在保留时间13.01min处对应有两个较强离子峰,质荷比分别为134.0475、250.0946,杂质峰信号很弱,通过对阴离子图谱的分析,可知m/z 250.0946的峰为化合物的(M—H)—峰,m/z 134.0475的峰为化合物的(M—H—R)—峰,经软件计算可知m/z 250.0946峰对应的分子式为C10H12N5O3,误差为0.51h10—6。
在保留时间13.01min处对应有3个离子峰,质荷比分别136.0730、252.1192、274.1007,通过对阳离子图谱的分析可知,m/z 252.1192的峰为化合物的(M+H)+峰,m/z 136.0730的峰为化合物的(M+H—R)+峰,m/z 274.1007的峰为化合物的(M+Na)+峰,经计算可知252.1192峰对应的分子式为C10H12N5O3,误差为7.4h10—7,因此该化合物的相对分子质量为251,且分子式为C10H13N5O3,与虫草素分子式相同;从液相色谱图来看,在全波长扫描的条件下,仅有一个峰,说明样品6中只有一个具紫外吸收的化合物,为纯品;在样品6的紫外吸收光谱图上可见样品在260nm波长处有最大吸收峰,与虫草素标准品相同,进一步证明该样品为纯度很高的虫草素。
3 讨 论
核苷类物质特别是腺苷为虫草的主要功效成分之一,在我国药典中就以腺苷含量的高低作为虫草制品的质控指标。文献[12-20]报道腺苷主要具有舒张血管、降低血压、减慢心率、抑制血小板聚焦、松驰血管平滑肌、改善心脑血液循环、防止心律失常、抑制神经递质的释放和调节腺苷酸活化酶活性等的重要药理作用,且该物质广泛存在于虫草真菌的代谢与生物合成中。但野生虫草及其无性型菌株发酵菌丝体间的腺苷含量,以及不同虫草间的腺苷含量及种类均有所差异。如刘波等[21]研究了包含蛹拟青霉、蝉拟青霉、粉被玛利亚霉、细脚拟青霉及古尼拟青霉在内的5种虫草无性型发酵菌丝体中的腺苷类物质,发现5种虫草菌株均能产出腺苷和腺嘌呤,但在蛹草拟青霉菌株中含有虫草菌素,在粉被玛利亚霉和蝉拟青霉菌株中含有N6-(2-羟乙基)腺苷。葛飞等[2]对天然蝉花及其无性型菌株-蝉拟青霉液体发酵菌丝体中的核苷含量进行了分析,发现人工发酵菌丝体中的核苷类物质含量明显高于天然蝉花。
虫草在临床上的补益、增强免疫功能、辅助治疗等作用,似乎与其富含多种核苷类物质有着必然的联系。有效成分的研究是虫草资源开发的基础,如何提取并纯化其中的有效成分,以及如何检验这些成分的药理作用,也是十分重要的研究工作。在本研究选定的色谱条件下,蝉花虫草的65%甲醇提取物,采用反相制备HPLC,以甲醇和水为流动相,经简单的梯度洗脱,即可获得纯度在95%以上的核苷类化合物,该分离方法快速、准确、操作简单,表明该方法是一种快速分离虫草中核苷类成分的现代制备方法。
[1] 王琪, 刘作易. 药用真菌蝉花的研究进展[J]. 中草药, 2004, 34(4): 469-471.
[2] 葛飞, 夏成润, 李春如, 等. 蝉拟青霉菌丝体与天然蝉花中化学成分的比较分析[J]. 菌物学报, 2007, 26(1): 68-75.
[3] 刘森琴, 温鲁, 夏敏, 等. 人工培育蝉花的活性成分含量测定[J]. 安徽农业科学, 2008, 36(2): 429; 467.
[4] 周俐斐, 芦柏震, 蔡菊芬. 蝉花总多糖的提取纯化及含量测定[J]. 江西中医药, 2009, 40(1): 56-57.
[5] ODIER F, VEY A, BUREAU J P. in vitro effect of fungal cyclodepsipeptides on leukemic cells: study of destruxins A, B and E[J]. Biol Cell, 1994, 314(20): 267-271.
[6] 刘广玉, 胡菽英. 天然蝉花和人工培养品镇静镇痛作用的比较[J].现代应用药学, 1991, 8(2): 5-8.
[7] 金丽琴, 吕建新, 袁谦, 等. 蝉拟青霉对大鼠免疫功能和血液生化指标的影响[J]. 温州医学院学报, 2001, 31(6): 344-346.
[8] 谢炜, 郭月芳, 盛雨辰. 蝉花菌丝体对慢性肾功能衰竭大鼠的治疗作用[J]. 中国医药工业杂志, 2011, 42(10): 770-772.
[9] 徐红娟, 莫志宏, 余佳文, 等. 蝉花抗真菌活性成分的分离纯化研究[J]. 天然产物研究与开发, 2010, 22(5): 794-797.
[10] 宋捷民, 陈玲, 陈玮, 等. 蝉花对免疫功能影响的实验研究[J]. 中国中医药科技, 2007, 14(1): 37-38.
[11] 宋捷民, 忻家础, 朱英. 蝉花对小鼠血糖及造血功能影响[J]. 中华中医药学刊, 2007, 25(6): 1144-1145.
[12] 郭海平, 杨智敏. 冬虫夏草药理作用研究进展[J]. 中草药, 1999, 30(3): 231-233.
[13] 马定远, 李萍, 季晖, 等. 冬虫夏草及其菌丝的药理学研究进展[J].中药材, 2001, 24(6): 455-458.
[14] TODA N, OKUNISHI H, TANIYAMA K, et al. Responses to adenine nucleotides and related compounds of isolated dog cerebral, coronay and mesenteric arteries[J]. Blood Vessels, 1982, 19(5): 226.
[15] PELLEG A, PORTER R S. The pharmacology of adenosine[J]. Pharmacotherapy, 1990, 10(1): 157.
[16] LI S P, LI P, LAI C M, et al. Simultaneous determination of ergosterol, nucleosides and their bases from natural and cultured Cordyceps by pressurised liquid extraction and high-performance liquid chromatography[J]. J Chromatography A, 2004, 1036(2): 239-243.
[17] GONG Y X, LI S X, LI P, et al. Simultaneous determination of six main nucleosides and bases in natural and cultured Cordyceps by capillary electrophoresis[J]. J Chromatography A, 2004, 10(5): 215-221.
[18] 米莉莉, 王智华, 洪筱坤. 冬虫夏草及人工菌丝体的核苷类成分的HPLC研究[J]. 中草药, 2003, 34(6): 573-574.
[19] GU Yuxiang, WANG Zunsheng, LI Suxia, et al. Effect of multiple factors on accumulation of nucleosides and bases in Cordyceps militaris[J]. Food Chem, 2007, 102(4): 1304-1309.
[20] TODA N, OKUNISHI H, TANIYAMA K, et al. Responses to adenine nucleotides and related compounds of isolated dog cerebral, coronary and mesenteric arteries[J]. Blood Vessels, 1982, 19(5): 226-236.
[21] 刘波, 康冀川, 雷帮星, 等. 五种虫草无性型菌株产腺苷类物质的分析[J]. 菌物学报, 2012, 31(3): 405-412.
Purif i cation and Identif i cation of Nucleoside Components in Cordyceps cicadae Fruit Bodies
CHEN An-hui,CHEN Hong-wei,XU Yang,ZHUO Tao,SHAO Ying*
(Department of Food and Biology, Xuzhou Institute of Technology, Xuzhou 221008, China)
The aim of this study was to extract, purify and identify nucleoside components of Cordyceps cicadae fruit bodies. Samples were extracted with 65% ethanol by ultrasonic-assisted extraction, and a supernatant was obtained from the resulting extract by centrifugation at 10000 r/min for 5 min and separated by RP-HPLC using 0ü100% methanol as a mobile phase through gradient elution at a fl ow rate of 15 mL/min (1 mL injection volume, 260 nm detection wavelength). As a result, 6 fi nal products were obtained and identif i ed as cytosine, uridine, inosine,guanosine, adenosine and cordycepin, respectively, with a purify exceeding 95%. This study demonstrates that RP-HPLC is a feasible, simple and accurate technique for separating and preparing nucleoside components of Cordyceps cicadae fruit bodies.
Cordyceps cicadae;nucleoside;purif i cation;identif i cation
Q93.331
A
1002-6630(2013)01-0131-04
2012-06-30
江苏省科技计划项目(BN2011017;BN2011022);国家星火计划项目(2010GA730017)
陈安徽(1979—),男,副教授,博士,研究方向为应用微生物学。E-mail:chenah201@163.com
*通信作者:邵颖(1979ü),女,讲师,博士,研究方向为微生物资源开发与应用。E-mail:shyzhbo2005@126.com

