溶氧控制条件对双孢菇发酵产胞外多糖的影响
毛 勇,毛 健*,李华钟,孟祥勇
(1.江南大学食品学院,江苏 无锡 214122;2.江南大学生物工程学院,江苏 无锡 214122)
溶氧控制条件对双孢菇发酵产胞外多糖的影响
毛 勇1,2,毛 健1,*,李华钟2,孟祥勇1
(1.江南大学食品学院,江苏 无锡 214122;2.江南大学生物工程学院,江苏 无锡 214122)
以双孢蘑菇(Agaricus bisporus MJ-0811)为实验菌种,采用5L自控式发酵罐培养研究溶氧控制条件(搅拌转速和通气量)对双孢菇发酵过程的影响,考察发酵过程中菌体生物量、胞外多糖产量、相对溶氧、葡萄糖含量的变化。结果表明:搅拌转速和通气量对双孢菇的菌体生长和胞外多糖分泌具有显著的影响,并得出较佳的培养条件为:温度25℃、搅拌转速160r/min、通气量0.9vvm,此条件下,培养5d,菌体生物量最高达20.81g/L,胞外多糖产量最高达3.75g/L。
双孢菇;搅拌转速;通气量;溶氧;胞外多糖
近年来,随着分子生物技术的发展,微生物多糖的重要生物活性功能已得到越来越多人的重视,如作为免疫调节剂、促进细胞因子生成、抗肿瘤、抗病毒、抗感染、抗消化性溃疡、抗氧化、防衰老、降血糖等[1-5]。其中真菌多糖也已越来越引起研究者的重视。真菌多糖的生物活性已得到国内外众多学者的证实[4,6-10]。双孢菇具有丰富的营养价值,味道鲜美,其多糖更是一种特殊的生物活性物质,具有增强体液免疫和细胞免疫的功能。但现阶段对双孢菇的研究多集中于双孢菇的种植栽培[11],子实体和孢柄多糖的提取、生物活性研究等[9,12-16],也有部分学者研究了双孢菇的液体发酵,但多针进行工艺和活性初步研究[17-19];涉及胞外多糖为生产目的深层发酵工艺并未得到深入研究。
液态深层双孢菇发酵是一个不断耗氧生物降解的过程[19-20]。随着发酵过程的进行,胞外多糖的积累,发酵液中营养物质的含量都受到发酵基质中溶氧的影响,甚至不利于菌体的生长,阻碍代谢产物的积累。因而,提高发酵液的溶氧率是促进发酵进程的一个重要因素。万萍等[21]研究了溶氧调控对Alcaligenes sp.NX-3产威兰胶的影响。结果表明利用高供氧-中供氧-低供氧的策略能使发酵液中威兰胶的含量得到明显提高。彭志坚等[22]研究了供氧方式对发酵生产L-异亮氨酸的影响。结果表明搅拌速度及搅拌方式对L-异亮氨酸产量具有显著影响。然而对双孢菇液体深层发酵的研究相对较少,目前仅有部分文献对双孢菇液态发酵培养基和菌种的研究[18,23-24]进行报道。其中对发酵工艺条件的研究,尤其是溶氧条件对双孢菇液态发酵进程的影响更是鲜有报道。
本实验通过对双孢菇液态发酵过程中的搅拌转速、通气量等溶氧控制条件进行研究,分析比较不同的溶氧控制条件对双孢菇菌丝体及胞外多糖发酵过程的影响,为双孢菇液态发酵的实际生产提供一定的技术参考。
1 材料与方法
1.1 试剂、菌种与培养基
马铃薯、玉米浆 市售;葡萄糖、KH2PO4、MgSO4g 7H2O(均为分析纯)、蛋白胨 北京奥博星生物技术有限责任公司;琼脂 上海信然生物技术有限公司。
双孢蘑菇(Agaricus bisporus MJ-0811),为本实验室保藏菌种。
PDA培养基(g/L):马铃薯200、葡萄糖20、蛋白胨2、KH2PO42、MgSO4g7H2O 1、琼脂20,pH值自然,121℃灭菌15min;种子培养基(g/L):葡萄糖20、蛋白胨2、KH2PO42、MgSO4g7H2O 1、玉米浆 15,pH值自然,121℃灭菌15min;发酵培养基(g/L):葡萄糖 20、蛋白胨2、KH2PO42、MgSO4g7H2O 1,121℃灭菌15min,pH 5.0。
1.2 仪器与设备
PHB-4型酸度计 上海精科实业有限公司;隔水式电热恒温培养箱 上海市跃进医疗器械一厂;SIGMA高速离心机 美国Sigma公司;LS-B50型立式圆形压力蒸汽灭菌 上海医用核子仪器厂;R-200旋转蒸发仪 瑞士Buchi公司。
1.3 方法
1.3.1 培养基培养条件
种子培养:在活化后的菌种中,选取黄豆粒大小的小块,接到250mL三角瓶(装液量50mL培养基),置于恒温摇床上,160r/min、30℃培养3d。
5L发酵罐培养条件:装料系数为0.7,接种量为10%,发酵罐培养温度为25℃、初始pH5.0,通气量和搅拌转速需要实验确定。每个实验水平重复3次。在发酵过程中,每天取样,观察菌体形态,测定菌体生物量、多糖含量。
1.3.2 胞外多糖的提取和测定
发酵液经6000r/min离心10min后得上清液,再将上清液浓缩,然后加入3倍体积95%乙醇,剧烈搅拌,4℃沉淀过夜。沉淀过夜后,6000r/min离心20min,弃去上清液,沉淀用60℃热水溶解,溶液于50℃经旋转蒸发浓缩到原来体积的1/3。然后以料液比1:5(V/V)加入氯仿-戊醇(5:1,V/V),混合物振摇30min,使蛋白质与氯仿-戊醇生成凝胶物而分离,3000r/min离心10min,分去水层和溶剂层交界处的变性蛋白质。重复多次直至两相交界处无变性蛋白质。然后将样品进行冷冻干燥,即为胞外粗多糖。采用硫酸苯酚法测定多糖的含量[4]。
1.3.3 菌体生物量的测定
采用干质量法测菌体生物量:取发酵液100mL,于4℃、10000r/min离心10min,收集沉淀物置于100目纱布上,用蒸馏水反复冲洗,然后置于干燥箱中在70℃条件下烘干至恒质量。
1.3.4 葡萄糖含量的测定
采用3,5-二硝基水杨酸比色法(DNS法)[25]测定。
2 结果与分析
2.1 搅拌转速对双孢菇发酵生产胞外多糖的影响
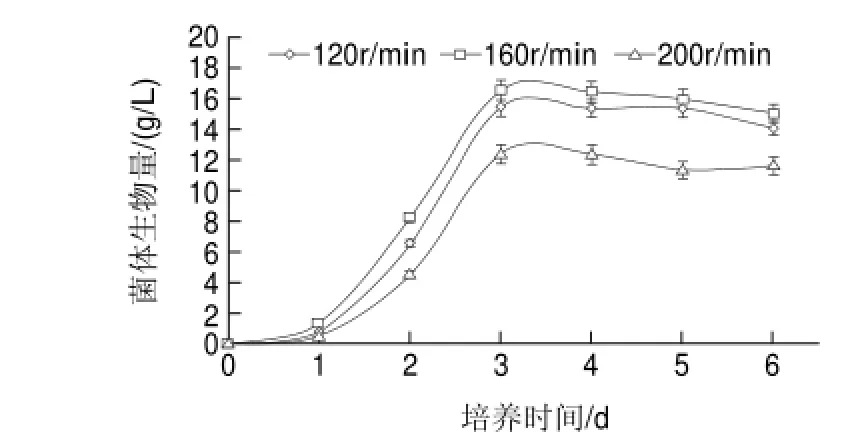
图 1 搅拌转速对双孢菇菌体生物量的影响Fig.1 Effect of stirring speed on mycelial biomass
微生物发酵不仅决定于菌种本身,还与菌种的生长环境有关。在深层发酵过程中,搅拌不仅影响着基质中营养素的传递,而且影响溶氧水平,对深层发酵有着重要的影响[26]。在通风量一定(1.0vvm)的情况下,考察了搅拌转速对双孢菇菌体生物量、胞外多糖、溶氧水平、残糖的影响。由图1可知,搅拌转速在120~160r/min内,随着搅拌速率的增加菌丝体量不断提高。其中当搅拌转速为160r/min时,菌体生长最快,并且菌体生物量最高,发酵到第3天时菌体生物量达到16.56g/L。但当搅拌转速超过200r/min后,菌体生物量下降,低于120r/min和160r/min转速条件下菌体生物量,原因可能在于较高搅拌转速作用下,剪切作用力较大,菌丝体容易被打断,造成细胞损伤,不利于菌体生长。

图 2 搅拌转速对双孢菇胞外多糖产量的影响Fig.2 Effect of stirring speed on exopolysacharide production
由图2可知,经过近3d的培养适应期,双孢菇开始大量分泌胞外多糖。其中转速在160r/min条件下,胞外多糖积累的速度大于其他两种考察搅拌转速。在转速160r/min条件下培养5d,双孢菇胞外多糖产量达到最大2.92g/L,而其他转速(120、200r/min)条件下,胞外多糖的最大产量分别为2.17g/L和2.53g/L,胞外多糖的积累并未随着搅拌速度的提高而增加。过高或过低的搅拌转速都不利于双孢菇胞外多糖的分泌。由此可以说明,恰当的搅拌转速对双孢菇的整个发酵过程非常重要,既要求有利于发酵前期菌体的生长,又要有利于中后期发酵产物胞外多糖的积累。
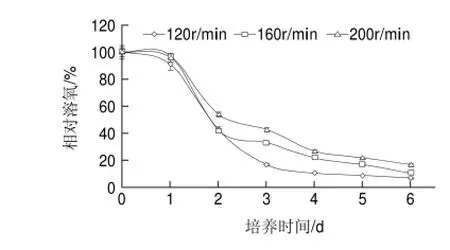
图 3 搅拌转速对双孢菇发酵液相对溶氧的影响Fig.3 Effect of stirring speed on dissolved oxygen concentration
由图3可知,发酵过程中各转速条件下,发酵液中相对溶氧规律基本相似。在发酵前期,双孢菇生长处于迟滞期,相对溶氧水平变化小;进入快速生长期后,相对溶氧迅速下降,此时菌体细胞的耗氧速率明显高于发酵液中的供氧速率。进入稳定期后,相对溶氧一直保持在较低的水平,原因可能在于在发酵的后期,由于菌体的大量生长,消耗大量的溶氧。
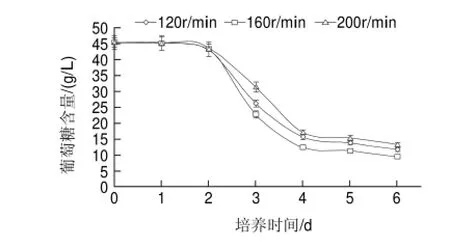
图 4 搅拌转速对双孢菇发酵过程中葡萄糖含量的影响Fig.4 Effect of stirring speed on residual glucose concentration
在发酵过程中,随着菌体的生长,还原糖的消耗也相应地增加。由图4可知,搅拌转速对发酵液中还原糖消耗的影响。在发酵前2d还原糖的消耗基本稳定,随着发酵时间的延长,由于菌体的生长造成糖的消耗逐渐增大。在搅拌转速为160r/min时,还原糖的消耗速率最快,这也跟双孢菇菌丝体生物量增加相对应。160r/min培养5d时,葡萄糖含量为11.36g/L,而其他转速(120、200r/min)条件下,葡萄糖含量分别为13.85g/L和15.40g/L。
2.2 通气量对双孢菇发酵生产胞外多糖的影响
在好氧菌的培养过程中,培养液中溶解氧水平是一个非常关键的因素。通气可以使培养液中营养基质、代谢产物、副产物和氧气得到更好的传递利用并且使有关的微生物细胞发挥更好的作用,特别是对丝状真菌发酵的影响更为显著。通气量对发酵液中的溶氧水平起到尤其直接的作用。在搅拌转速一定(150r/min)的情况下,考察了通气量对菌体生物量、胞外多糖、溶氧水平、葡萄糖含量的影响。由图5可知,在通气量为0.6、0.9、1.2vvm时,最大菌体生物量分别为12.87、13.98、16.37g/L,表明较高的通气量比较有利于菌体的生长。通气量充足的条件下,充足的空气有利于细胞生长所需O2的供给,这对菌体生物量的增加是非常重要的。并且在微生物代谢过程中,充足的通气还有利于去除代谢过程中产生的废气和促进细胞内微环境的副产品代谢。但是继续增加通气会使发酵液中溶氧过多,不仅影响糖和相关酶的合成,而且还会造成酶的氧化,引起酶的失活;最终当通气量增加到一定程度时,发酵过程中胞外多糖的分泌反而减少[27]。

图 5 通气量对双孢菇菌体生物量的影响Fig.5 Effect of aeration speed on mycelial biomass
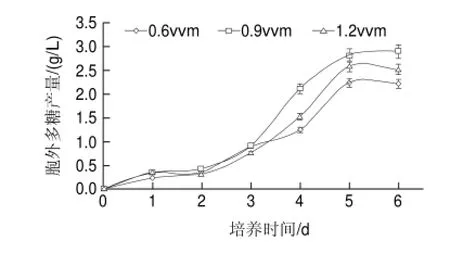
图 6 通气量对双孢菇胞外多糖产量的影响Fig.6 Effect of aeration speed on exopolysacharide production
由图6可知,当通气量为0.9vvm时,经过5d的培养,发酵液中胞外多糖的最大得率2.82g/L;当通气量0.6、1.2vvm时,最大胞外多糖的得率分别为2.24、2.69g/L,均低于通气量为0.9vvm时的胞外多糖得率。当通气量为0.6vvm时,不足量的O2供给明显地不利于使双孢菇胞外多糖的积累,原因可能是在此供氧条件下,只有局部环境下的微生物细胞能够在进行正常的代谢活动并进行生物活性物质的积累与转化,而更多的细胞只能勉强维持自身的生存;但是在1.2vvm的通气量下,过量的O2供给也能导致双孢菇胞外多糖得率的降低(2.69g/L)。可以看出较高或较低的通气量均不利于胞外多糖的分泌。原因可能在于,随着通气量的增加,发酵液中的溶氧水平也相应增加;但是过高的溶氧会导致发酵液中副产物的增加,从而抑制了双孢菇菌体生长和胞外多糖的生成[28]。

图 7 通气量对双孢菇发酵液相对溶氧的影响Fig.7 Effect of aeration speed on dissolved oxygen concentration
由图7可知,对于双孢菇发酵过程溶氧水平的变化,基本与搅拌转速的影响趋势类似。随着通气量的加大,发酵液中溶氧水平增加,与双孢菇菌体生物量及胞外多糖得率的增加相对应。随着发酵过程的进行,发酵液中的溶解氧水平不断下降;尤其是当发酵过程进行到1~3d时,发酵液中的溶解氧下降较为迅速,原因在于在这个时期由于菌体大量生长和营养基质的大量消耗,消耗的氧气较多,氧气消耗速率大于氧气供给率,呈现出迅速下降的状态。双孢菇发酵进入稳定期后,通气量维持在0.6vvm时,相对溶氧维持在较低水平(小于10%),不能满足菌体生长和胞外多糖生成所需氧量;而当通气量维持在0.9vvm和1.2vvm时相对溶氧水平基本维持在20%~30%之间,基本满足菌体生长和胞外多糖的合成分泌。
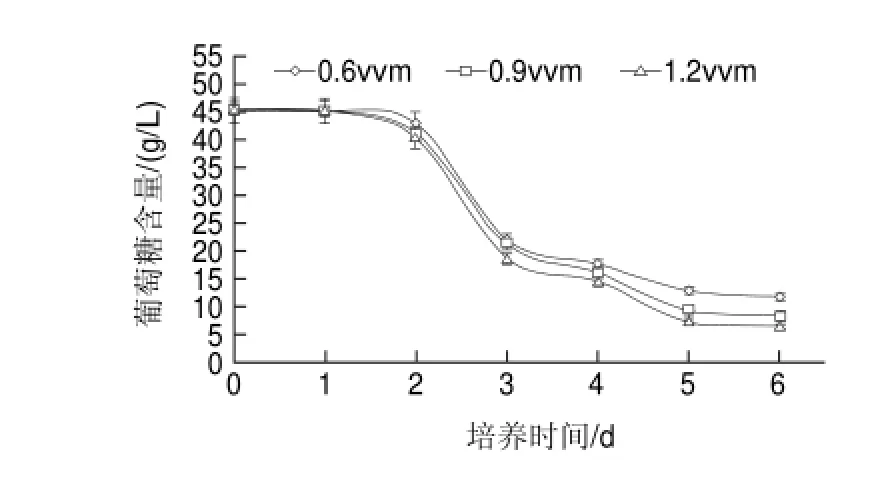
图 8 通气量对双孢菇发酵过程中葡萄糖含量的影响Fig. 8 Effect of aeration speed on residual glucose concentration
由图8可知,在双孢菇发酵过程中,随着通气量的加大,氧气供给充足,发酵液中还原糖消耗的更为彻底,与双孢菇菌丝体及胞外多糖得率的增加相对应。在通气量为1.2vvm时,还原糖的消耗速率最快,这也跟蘑菇菌丝体生物量增殖相对应。当通气量维持在1.2vvm时,经过5d的培养,发酵液中的葡萄糖含量为7.36g/L,而在0.6、0.9vvm通气量条件下,发酵液中葡萄糖含量分别为12.85g/L和9.40g/L。
2.3 验证实验
通过以上对通气量和搅拌转速的研究,初步得出较优的溶氧条件:搅拌转速160r/min、通气量0.9vvm;在初步优化的参数条件下:温度25℃、搅拌转速160r/min、通气量0.9vvm,培养5d,双孢菇菌体生物量最高达到20.81g/L,胞外多糖产量最高达到3.75g/L,相对溶氧为10.35%,葡萄糖含量为9.37g/L,较优化前双孢菇菌体生物量16.37g/L和双孢菇胞外多糖2.82g/L分别提高了27.1%和33.4%。
3 结 论
本实验研究发现,在搅拌转速为160r/min时,双孢菇菌体生长较好,转速过大或过小都不利于菌体的生长。过低导致发酵液中的溶氧供给不足,不利于菌体的生长;转速过高,产生的剪切力较大,菌丝容易被打断,引起菌体细胞的损伤,不利于菌体的生长。适宜的搅拌转速能够增加双孢菇胞外多糖的分泌积累,搅拌转速过高或过低都对胞外多糖的分泌不利。菌体生物量随着通气量的增加而增加,原因在于通气量的增加提高了发酵液中的溶氧水平,供氧充足有利于菌体的生长。但过高或过低的通气量都不利于胞外多糖的分泌,通气量过低,代谢过程中产生胞外多糖的所需氧气不足;通气量过大,过多的氧气会引起胞外多糖的降解。通过对通气量和搅拌转速的研究,初步得出较优的溶氧条件为:搅拌转速160r/min、通气量0.9vvm;在优化的参数条件下(温度25℃、搅拌转速 160r/min、通气量0.9vvm)培养5d,双孢菇菌体生物量最高达到20.81g/L,胞外多糖产量最高达到3.75g/L,相对溶氧为10.35%,葡萄糖残留量为9.37g/L,较优化前双孢菇菌体生物量16.37g/L和双孢菇胞外多糖2.82g/L分别提高了27.1%和33.4%。
[1] 李平作, 章克昌. 灵芝胞外生物活性多糖的pH控制发酵[J]. 微生物学通报, 2000, 27(1): 5-8.
[2] 刘丽平. 紫球藻及其胞外多糖降血糖和提高免疫活性的研究[D]. 福州: 福建师范大学, 2005.
[3] 金玉妍. 灰树花胞外多糖的分离纯化及降血糖作用研究[D]. 天津:天津科技大学, 2009.
[4] 魏兆媛. 竹黄菌液态发酵产胞外多糖及其分离纯化和特性研究[D].无锡: 江南大学, 2009.
[5] TIAN Yuting, ZENG Hongliang, XU Zhenbo, et al. Ultrasonic-assisted extraction and antioxidant activity of polysaccharides recovered from white button mushroom (Agaricus bisporus)[J]. Carbohydrate Polymers, 2012, 88(2): 522-529.
[6] 崔凤杰. 灰树花深层发酵条件优化及其菌丝体抗肿瘤糖肽的研究[D]. 无锡: 江南大学, 2006.
[7] 罗成, 鲁晓翔, 周达. 鸡油菌多糖降血糖作用研究[J]. 食品工业科技, 2010, 31(12): 333-334.
[8] 陈旭健, 张原琪. 红菇多糖的提取及其降血糖、血脂作用研究[J].食品科学, 2010, 31(9): 255-258.
[9] SMIDERLE F R, RUTHES A C, ARKEL J V, et al. Polysaccharides from Agaricus bisporus and Agaricus brasiliensis show similarities in their structures and their immunomodulatory effects on human monocytic THP-1 cells[J]. BMC Complementary & Alternative Medicine, 2011, 11: 58.
[10] YE M, QIU T, PENG W, et al. Purification, characterization and hypoglycemic activity of extracellular polysaccharides from Lachnum calyculiforme[J]. Carbohydrate Polymers, 2011, 86(1): 285-290.
[11] 黄爱荣. 姬菇和双孢蘑菇液体菌种发酵及栽培效果的研究[D]. 武汉: 武汉工业学院, 2008.
[12] 熊泽, 邵伟, 黄艺. 双孢磨菇多糖提取工艺优化研究[J]. 三峡大学学报: 自然科学版, 2007(4): 367-370.
[13] 谢建华, 庞杰, 李志明, 等. 微波辅助提取双孢蘑菇柄中多糖的工艺研究[J]. 北京工商大学学报: 自然科学版, 2011(5): 30-35.
[14] 张强, 宫璐婵, 孟凡荣, 等. 双孢菇多糖抗氧化活性的研究[J]. 中国林副特产, 2010(1): 16-19.
[15] XIE Jianhua, PANG Jie, LI Zhiming, et al. Microwave-assisted technology for extracting polysaccharides from root of Agaricus bisporus stipe[J]. Journal of Beijing Technology and Business University (Natural Science Edition), 2011, 29(5): 30-36.
[16] JEONG S C, JEONG Y T, YANG B K, et al. White button mushroom (Agaricus bisporus) lowers blood glucose and cholesterol levels in diabetic and hypercholesterolemic rats[J]. Nutrition Research, 2010, 30(1): 49-56.
[17] 黄爱荣, 缪礼鸿, 边银丙. 双孢蘑菇液体菌种发酵工艺研究[J]. 食用菌, 2009(5): 12-13.
[18] 王广耀, 佟彤. 双孢蘑菇液体培养基的优化研究[J]. 食用菌, 2011(3): 11-12.
[19] KIM K, CHOI B, LEE I, et al. Bioproduction of mushroom mycelium of Agaricus bisporus by commercial submerged fermentation for the production of meat analogue[J]. Journal of the Science of Food and Agriculture, 2011, 91(9): 1561-1568.
[20] CHO E J, OH J Y, CHANG H Y, et al. Production of exopolysaccharides by submerged mycelial culture of a mushroom Tremella fuciformis[J]. Journal of Biotechnology, 2006, 127(1): 129-140.
[21] 万萍, 李会, 徐浩, 等. 溶氧调控策略对Alcaligenes sp. NX-3产威兰胶发酵过程的影响[J]. 食品与发酵工业, 2011, 37(4): 7-11.
[22] 彭志坚, 房峻, 李江华, 等. 发酵法生产L-异亮氨酸的溶氧控制策略[J]. 工业微生物, 2009, 39(3): 11-16.
[23] 张福元, 曹瑞秀, 乔君毅. 双孢蘑菇优良菌株筛选及制种技术的研究[J]. 食用菌, 2009, 31(3): 18-19.
[24] KURBANOGLU E B, ALGUR O F, ZULKADIR A. Submerged production of edible mushroom Agaricus bisporus mycelium in ram horn hydrolysate[J]. Industrial Crops and Products, 2004, 19(3): 225-230.
[25] 卫功元, 李寅, 堵国成, 等. 溶氧及pH对产朊假丝酵母分批发酵生产谷胱甘肽的影响[J]. 生物工程学报, 2003, 19(6): 734-739.
[26] 姜俊云, 贾士儒, 董惠钧, 等. 搅拌转速和pH对ε-聚赖氨酸发酵的影响[J]. 生物加工过程, 2004, 2(2): 60-63.
[27] 许晓娟. 通过发酵策略及诱变选育来提高谷氨酰胺转胺酶酶活[D].无锡: 江南大学, 2009.
[28] 朱会霞. 灰树花多糖深层发酵pH值及溶氧条件控制研究[J]. 中国酿造, 2012, 31(1): 116-118.
Effect of Dissolved Oxygen Controlling Conditions on Production of Extracellular Polysaccharides by Agaricus bisporus MJ-0811
MAO Yong1,2,MAO Jian1,*,LI Hua-zhong2,MENG Xiang-yong1
(1. School of Food Science and Technology, Jiangnan University, Wuxi 214122, China;2. School of Biotechnology, Jiangnan University, Wuxi 214122, China)
Agaricus bisporus MJ-0811 was cultured in a 5 L automatic fermenter to explore the effect of dissolved oxygen controlling conditions (stirring speed and aeration) on mycelial biomass, extracellular polysaccharide production, dissolved oxygen concentration, and residual glucose concentration. The results showed that stirring speed and aeration rate had signif i cant impact on the growth of Agaricus bisporus MJ-0811 and the production of extracellular polysaccharides. The highest mycelial biomass (20.81 g/L) and extracellular polysaccharides (3.75 g/L) were obtained when Agaricus bisporus MJ-0811 was cultured for 5 d at 25 ℃ with a stirring speed of 160 r/min and an aeration rate of 0.9 vvm.
Agaricus bisporus;stirring speed;aeration;dissolved oxygen;extracellular polysaccharides
TS201.3
A
1002-6630(2013)01-0155-05
2012-09-12
国家自然科学基金项目(31271839)
毛勇(1972ü),男,博士研究生,研究方向为食品生物技术。E-mail:mxysong@yahoo.cn
*通信作者:毛健(1970ü),男,教授,博士,研究方向为食品生物技术。E-mail:biomao@263.net

