巴西松子中蛋白酶的分离纯化及酶学性质
肖 丽,应铁进*,蔡路昀,韩晓旭
(浙江大学生物系统工程与食品科学学院,浙江 杭州 310029)
巴西松子中蛋白酶的分离纯化及酶学性质
肖 丽,应铁进*,蔡路昀,韩晓旭
(浙江大学生物系统工程与食品科学学院,浙江 杭州 310029)
在单因素试验基础上,通过正交试验研究pH值、提取时间和料液比3个因素对巴西松子中蛋白酶活力的影响,得出巴西松子中蛋白酶的最佳提取缓冲液为pH9.0的硼酸-硼砂缓冲液、提取时间为60min、料液比为1:8(m/V);采用(NH4)2SO4沉淀、DEAE-Sepharose FF阴离子交换层析分离纯化巴西松子中的一种蛋白酶,结果表明:纯化后蛋白酶比活力提高到了8.61倍,回收率为21.65%。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析表明:该蛋白酶分子质量为33kD。酶学性质结果表明:该蛋白酶最适pH值为9.0,属碱性蛋白酶;反应的最适温度为50℃;金属离子Mn2+对该蛋白酶活性有强烈的激活作用,而Ca2+、Mg2+和Cu2+对酶活性有抑制作用。
巴西松子;蛋白酶;分离纯化;酶学性质
巴西松子(Araucaria angustifolia (Bert) O. Ktze),是一种重要的国际性贸易商品,主要分布在喜马拉雅山区[1],如阿富汗东部、巴基斯坦北部、印度查谟克什米尔地区以及我国的西藏。松子含有人体必需的多种营养,如VA、VE、磷脂、多糖、黄酮等,并且富含不饱和脂肪酸[2-3],在全世界范围内广泛应用于甜食、糕点或者色拉的配料中,备受历代医家和营养学家的推崇。
巴西松子一季采收,周年供应,因此,需要进行商业性的长期贮藏。贮藏过程中的品质劣变是制约贮藏寿命的重要因素。除了油脂氧化,产生蛤喇味外,由寡肽、氨基酸含量变化导致的鲜度下降也是品质劣变的一个重要方面。蛋白酶参与松子贮藏过程中蛋白质的代谢过程,因而直接影响到松子的营养与品质变化。国内外对松子油[3-6]、松仁过敏性[7-9]和松仁蛋白[10-11]已经有所研究,但未见对松子中蛋白酶的研究报道。因此,本实验研究松子中蛋白酶的分离纯化,对于了解松子的品质劣变机制、改进松子贮藏条件具有重要的意义,并可为该酶进一步应用于食品、医药等方面提供有价值的理论基础。
1 材料与方法
1.1 材料与仪器
巴西松子产自巴基斯坦,保存于―3℃;DEAESepharose FF 北京鼎国生物技术有限责任公司;福林酚(分析纯) 上海源聚生物科技有限公司;低、高分子质量SDS-PAGE蛋白标准品 美国Bio-Rad公司;牛血清白蛋白(BSA,生化纯) 北京普博斯生物科技有限公司。
722E型可见分光光度计 上海光谱仪器有限公司;AKTAprime plus低压层析系统 通用电气(中国)医疗集团;CHRIST冷冻干燥机 上海汇分电子科技有限公司;EPS-300垂直电泳仪 上海天能科技有限公司。
1.2 方法
1.2.1 巴西松子蛋白酶提取
取5g经过石油醚萃取完全脱脂的巴西松子果仁粉,加入40mL缓冲液,在4℃条件下研磨充分后,静置60min,离心(4℃、8000r/min、30min),取上清液,缓慢加入(NH4)2SO4至80%饱和度,于4℃冰箱中静置2h后,再次离心取沉淀,溶解于原缓冲液,得到粗酶液。采用对比实验对缓冲液pH值、提取时间和料液比进行初步筛选,将提取时间分别设置为20、40、60、80、100min,料液比(m/V)为1:4、1:6、1:8、1:10、1:12,pH值分别调整为8.0、9.0、10.0、11.0,采用正交试验获得最佳提取工艺条件。
1.2.2 蛋白酶纯化
采用(NH4)2SO4沉淀法粗步纯化蛋白酶,将盐析后得到的粗酶液经过DEAE-Sepharose FF层析柱[12-13](1.6cmh40cm)进一步分离纯化,用含0~1mol/L NaCl的硼酸-硼砂缓冲液(pH9.0)线性梯度洗脱[14],流速2mL/min,5mL/管分别收集,280nm波长处检测,计算在活性峰范围内每管蛋白酶活性、总蛋白含量。挑选出纯化倍数高的样品,真空冻干得到样品粉末,在―70℃保存,用于电泳分析及蛋白酶性质研究。
1.2.3 SDS-PAGE电泳
纯化后的蛋白酶按文献[15]的方法进行SDS-PAGE电泳。其中分离胶和浓缩胶的体积分数分别采用10%和5%[16]。电泳完毕后,小心取出胶片,置于固定液中固定30min,再用考马斯亮蓝R250染色至少2h,最后用脱色液脱色至凝胶背景透明后保存在保存液中,测定其纯度及分子质量[17]。
1.2.4 蛋白质含量的测定
采用考马斯亮蓝法测定蛋白酶的蛋白质含量,以BSA作为标准蛋白。用紫外-可见分光光度计依次测定每管收集液在280nm波长处[18]的吸光度,得到蛋白质含量。
1.2.5 蛋白酶活力的测定
以2%酪蛋白为底物,按照福林酚测定法[14,19]并加以改进。取3支试管编号,分别加入1.0mL酶液,于40℃水浴锅中预热2~3min,加入1.0mL 40℃预热的2%酪蛋白,于40℃反应10min,再加入2.0mL 0.4mol/L三氯醋酸反应15min过滤,取滤液1.0mL放入盛有5mL Na2CO3溶液的试管中,加入1.0mL 福林-酚试剂于40℃水浴发色20min。同时做空白对照,即加入酶液后直接用2.0mL 0.4mol/L三氯醋酸沉淀酶并使酶失活,然后再加入2%的酪蛋白。酶活力单位定义为1mL酶液在40℃和pH9.0的条件下,1min水解酪蛋白产生1μg酪氨酸为1个酶活力单位,以U表示。
1.2.6 蛋白酶的酶学特性
1.2.6.1 酶的热稳定性
将1mL酶液分别置于20~90℃水浴锅中分别保温20、30、40、50、60min,再测定酶活性。
1.2.6.2 最适反应温度
将反应温度分别设为20~90℃,根据1.2.6.1节的结果,测定酶活性。
1.2.6.3 最适pH值
将酶反应液的pH值分别调整为3.0~11.0(pH3.0~5.0用0.05mol/L乳酸盐缓冲液,pH7.0~8.0用0.05mol/L磷酸盐缓冲液,pH9.0~11.0用0.05mol/L硼酸盐缓冲液),根据1.2.6.2节的结果,在最适反应温度条件下测定酶活性。
1.2.6.4 金属离子对酶活性的影响
在硼酸-硼砂缓冲液中分别加入浓度为10mmol/L的Na+、Mg2+、K+、Ca2+、Mn2+和Cu2+,根据1.2.6.2节的结果,在最适反应温度条件下测定酶活性。
2 结果与分析
2.1 巴西松子果仁中蛋白酶的分离提取
2.1.1 不同pH值缓冲液对蛋白酶活力的影响
重蒸水、乳酸盐缓冲液、磷酸盐缓冲液、硼酸盐缓冲液和Tris-HCl缓冲液,这5种浸提溶剂常用于提取蛋白酶[20-22],为探讨不同的提取方法对酶活力的影响程度,实验取5g脱脂松子果仁粉分别加入30mL的上述5种浸提溶剂,混合匀浆,粗滤后于4℃、8000r/min离心30min,取上清液得粗蛋白酶液,测定蛋白酶活力。

表 1 不同提取溶剂提取液的酶活力Table 1 Effect of different solvents on the extraction eff i ciency of protease activity

图 1 pH值对巴西松子蛋白酶活力的影响Fig.1 Effect of solvent pH on the extraction eff i ciency of protease activity
由表1可知,对巴西松子来源的蛋白酶提取效果为硼酸-硼砂缓冲液>Tris-HCl缓冲液>磷酸盐缓冲液>蒸馏水>乳酸盐缓冲液,因此选用硼酸盐缓冲液效果最好。为了进一步研究硼酸盐缓冲液pH值对酶活力的影响,用NaOH溶液将硼酸-硼砂缓冲液的pH值分别调整为8.0、9.0、10.0、11.0,在料液比为1:6、提取时间为30min条件下,测定蛋白酶活力。
由图1可知,随着pH 值升高,巴西松子蛋白酶活力先增大后减小。在pH8.0~9.0范围内,蛋白酶活力急速升高,在pH9.0时达到最大值,之后开始下降。故选取pH9.0的硼酸-硼砂缓冲液提取蛋白酶比较适宜,这与蒋丽萍等[10]研究表明碱提松子蛋白质的最佳pH值为10.0相接近。
2.1.2 提取时间对蛋白酶活力的影响

图 2 提取时间对巴西松子蛋白酶活力的影响Fig.2 Effect of extraction time on the extraction eff i ciency of protease activity
从植物中提取蛋白酶,提取效果与提取溶剂和提取时间有关。时间太短导致酶不能充分溶解到提取溶剂中,时间太长会降低酶活力测定效率。在料液比为1:6、pH9.0条件下,测定不同提取时间的蛋白酶活力。由图2可知,在20~60min,随着提取时间延长,蛋白酶活力也随之增加,当60min时达到最大值,此后随着时间延长酶活力略微上升,提取时间为80min和100min差别不大,说明60min时,蛋白酶已经基本提取饱和。因此选取提取时间为60min。
2.1.3 料液比对蛋白酶活力的影响
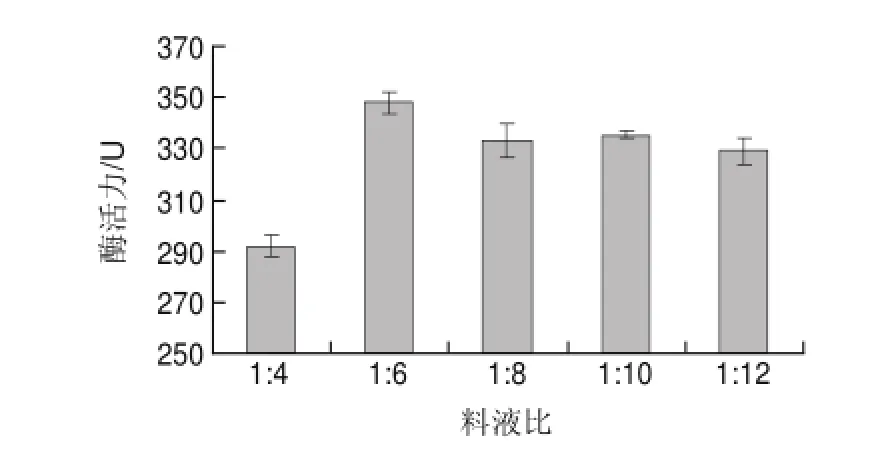
图 3 料液比对巴西松子蛋白酶活力的影响Fig.3 Effect of solid-to-solvent ratio on the extraction eff i ciency of protease activity
料液比如果太低,酶不能充分溶解,会影响蛋白酶提取效果,进而导致酶活力下降;料液比如果太高,又会增加后处理负担。为了寻找较佳提取松子蛋白酶的料液比,分别选取料液比1:4、1:6、1:8、1:10、1:12,缓冲液pH9.0,在4℃提取60min条件下,测定蛋白酶活力。由图3可知,当料液比从1:4降低到1:6时蛋白酶活力不断升高,此后随着料液比进一步降低,酶活力略微波动,总体趋于稳定,因此选取料液比1:6进行提取比较适宜。
2.2 正交试验优化巴西松子蛋白酶提取工艺结果
在单因素试验基础上,进行正交试验可以进一步确定最佳工艺参数[10],以提取时间、缓冲液pH值和料液比为试验因素,进行三因素三水平正交试验,优化提取巴西松子蛋白酶的最佳工艺参数,试验因素与水平设计见表2,并应用SAS软件进行方差分析,见表3。
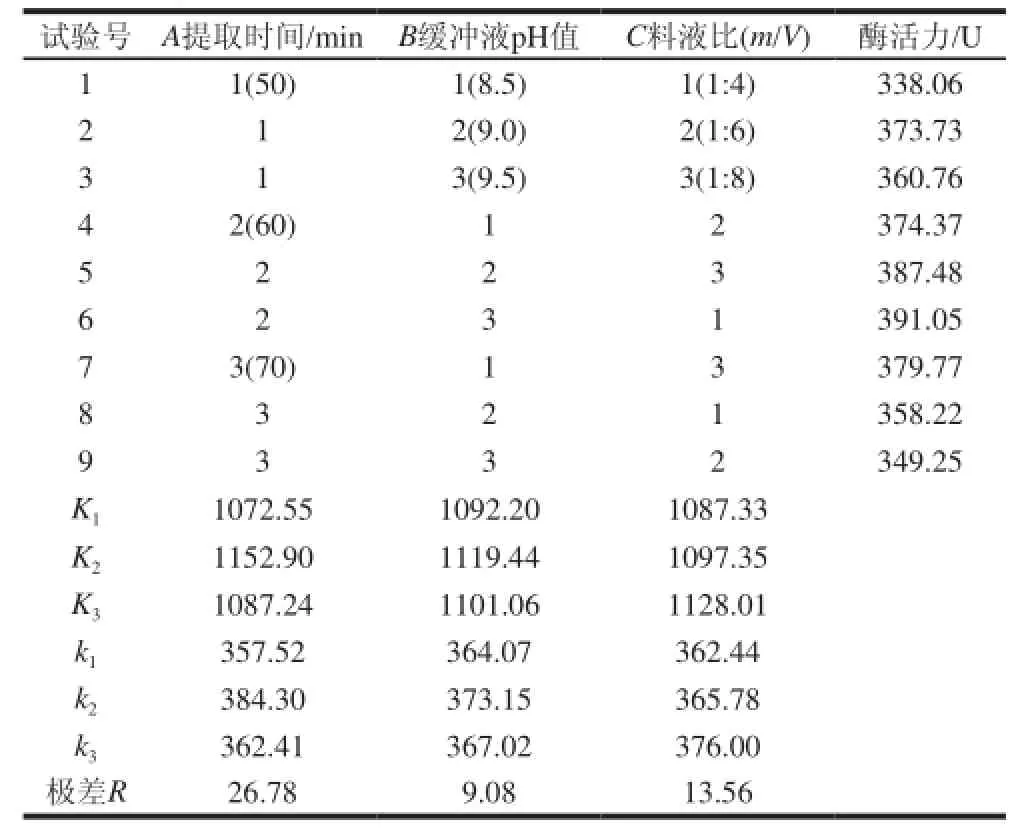
表 2 正交试验结果Table 2 Orthogonal array design and results
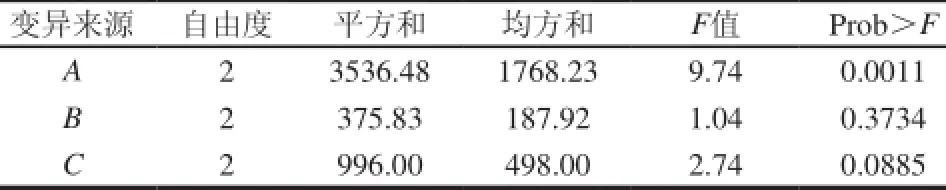
表 3 正交试验结果方差分析Table 3 Analysis of variance for the experimental results of orthogonal array design
由表2极差分析可知,影响巴西松子蛋白酶活力的因素顺序为A>C>B,因素A(提取时间)为显著影响因素,综合考虑提取效率与成本,提取的最优水平组合为A2B2C3。即巴西松子蛋白酶在pH9.0的硼酸-硼砂缓冲液中以料液比为1:8、提取60min为最佳提取条件。在此条件下,蛋白酶活力为387.48U。提取时间对酶活力影响最显著,与表3方差分析结果吻合。
2.3 巴西松子蛋白酶的纯化
2.3.1 (NH4)2SO4沉淀
硫酸铵沉淀法可从大量粗制剂中浓缩和部分纯化蛋白质,因其溶解度大、温度系数小和不易使蛋白质变性而广泛应用于酶的分离提纯中[14,22-23]。当溶液盐浓度增加时上清液中蛋白酶的溶解度减少,盐浓度太高时,会发生盐析现象,因此合适的盐浓度对纯化蛋白酶十分必要。采用饱和度分别为20%~90%的硫酸铵分别将蛋白酶提取液盐析,4℃静置过夜后,8000r/min离心30min,收集上清液,再用福林酚法分别检测上清液的蛋白酶活力,并与盐析前提取液蛋白酶活力进行比较,见图4。

图 4 不同硫酸铵饱和度对上清液蛋白酶活力的影响Fig.4 Effect of saturation degree of ammonium sulfate on the recovery of protease activity
盐析分级沉淀结果表明,当硫酸铵饱和度<20%时,上清液中酶活力跟原液相差不大。当硫酸铵饱和度为80%时,上清液中几乎检测不到酶活力,即80% (NH4)2SO4饱和度可有效沉淀目标蛋白酶。因此,实验采用80%饱和度硫酸铵沉淀目标蛋白酶。这与黄光荣等[14]采用80%的(NH4)2SO4盐析提取嗜热芽孢杆菌HS08结果相似,而曾小波等[23]研究的酱油曲蛋白酶最佳饱和度是85%。这说明了同一种盐浓度对不同蛋白酶表面水化膜的破坏程度不一样,蛋白质的溶解度也不一样。
2.3.2 DEAE-Sepharose FF层析
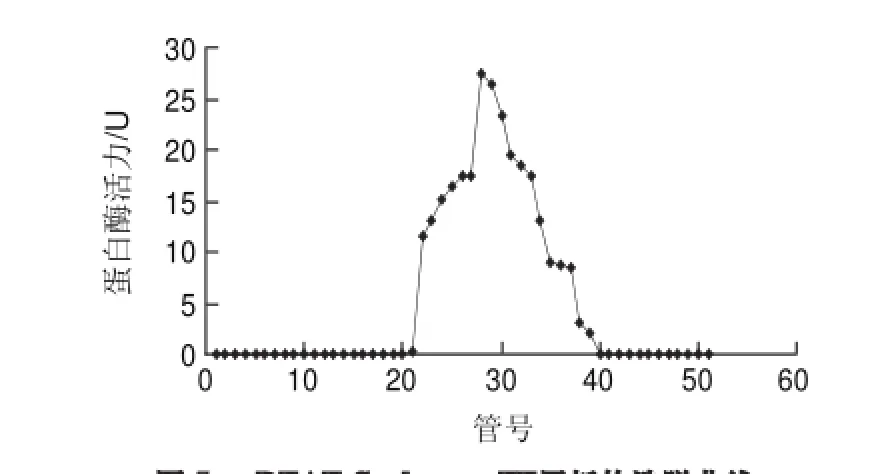
图 5 DEAE-Sepharose FF层析的洗脱曲线Fig.5 Elution prof i le of protease on DEAE-Sepharose FF column
将(NH4)2SO4沉淀后得到的粗酶液,于0.05mol/L 硼酸-硼砂缓冲液中4℃透析脱盐12h(透析袋截留相对分子质量为7000)[24],除去过量盐离子对下一步层析的影响。透析完成后,体积会扩大50%,因此需要采用真空冷冻干燥成粉末浓缩样品,再将粉末溶解于10mL缓冲液,经DEAE-Sepharose FF柱层析洗脱得到2个峰,但只有1个峰有蛋白酶活性,检测每管收集液的酶活力从而得到洗脱曲线(图5),将活性洗脱峰收集浓缩后,采用SDS-PAGE的方法检测其纯度。结果表明,该活性峰的纯度较高,蛋白质分子质量为33kD左右(图6)。
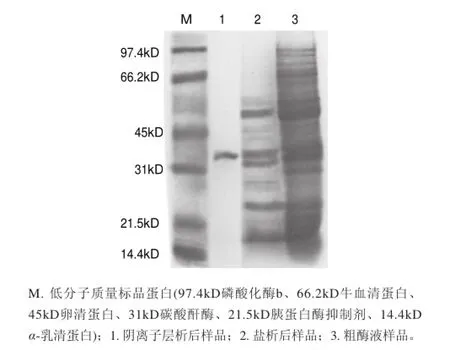
图 6 DEAE-Sepharose FF纯化后巴西松子蛋白酶的SDS-PAGE图谱Fig.6 SDS-PAGE of crude and purif i ed protease
2.3.3 分离纯化效率
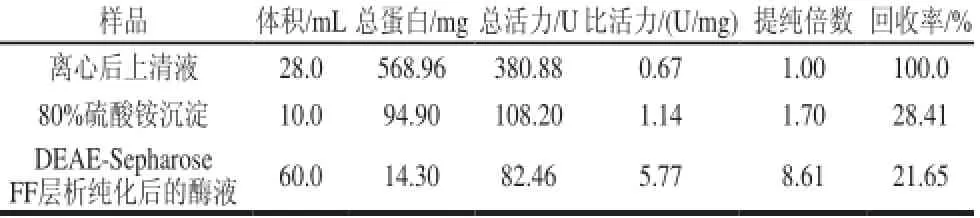
表 4 巴西松子蛋白酶的分离纯化Table 4 Isolation and purif i cation of Brazilian pine nut protease
在粗提蛋白酶的分离纯化过程中,各步骤的分离纯化效率见表4。结果表明,该蛋白酶经分离后纯化倍数达到8.61倍,回收率为21.65%。
2.4 巴西松子蛋白酶的酶学性质
2.4.1 酶的热稳定性

图 7 温度对巴西松子蛋白酶活力的影响Fig.7 Heat stability of protease from Brazilian pine nut
图7表明,蛋白酶在20~50℃保温20~60min后酶活力损失较小,在40℃时保温50min,酶活力最高。但温度高于50℃时,酶活力迅速降低,当温度超过80℃时,酶迅速变性,活力丧失80%以上。因此该酶属于不耐热范围。
2.4.2 酶反应的最适温度
图8表明,随着温度升高,巴西松子蛋白酶的活力逐渐升高,在50℃时达到最大值。之后随着温度升高,酶活力逐渐下降,70~80℃变化不明显,当温度在90℃时,酶活力下降最显著,因为酶的化学本质是蛋白质,适当的温度有利于酶促反应,但温度过高会导致酶变性。

图 8 温度对巴西松子蛋白酶活力的影响Fig.8 Optimum reaction temperature for protease from Brazilian pine nut
2.4.3 酶反应的最适pH值
适宜的pH值是维持酶活力的重要因素。蒋丽萍[10]、吴晓红[25]等研究松子的等电点分别为4.6和4.2,推测pH值在4.0左右,酶活力偏低是因为缓冲液的pH值与目标蛋白的等电点一致,导致蛋白的溶解度减少而引起聚集。由图9可知,巴西松子蛋白酶最适pH值为9.0,该酶在pH<4.0的酸性条件时,酶活力偏低。pH>10.0的碱性条件时,酶活力下降不明显。因此,该酶属于碱性蛋白酶。

图 9 pH值对巴西松子蛋白酶活力的影响Fig.9 Effect of pH on the activity of protease from Brazilian pine nut
2.4.4 金属离子对酶反应的影响

表 5 金属离子对巴西松子蛋白酶活力的影响Table 5 Effect of metal ions on the activity of protease from Brazilian pine nut
表5表明,Na+和K+对该蛋白酶活性有轻微激活作用,Mn2+的促进作用最强,高达167.68%,而Ca2+和Mg2+对酶活性有较弱的抑制作用,几乎可以忽略不计,Cu2+的抑制效果最强为25.19%。因此,该酶是Mn2+激活蛋白酶。
3 结 论
通过正交试验研究pH值、提取时间和料液比3个因素对巴西松子中蛋白酶提取效果的影响,得出巴西松子中蛋白酶的最佳提取缓冲液为pH9.0的硼酸-硼砂缓冲液、提取时间为60min、料液比为1:8;通过硫酸铵沉淀和离子交换层析等方法可将该蛋白酶纯化到单峰,纯化后蛋白酶的比活力为5.77U/mg,纯化倍数为8.61倍,回收率为21.65%。SDS-PAGE电泳进一步确定其分子质量为33kD,推测该酶由均一的亚基组成。该蛋白酶的最适温度为50℃,最适pH值为9.0,因此,该酶属于不耐热的碱性蛋白酶。10mmol/L Mn2+对该蛋白酶有强烈的激活作用,达到2.68倍,而Ca2+、Mg2+和Cu2+对蛋白酶活性有微弱抑制作用,因此推测该蛋白酶为一种Mn2+激活蛋白酶。
[1] SINGH N B, CHAUDHARY V K. Variability, heritability and genetic gain in cone and nut characters of Chilgoza pine (Pinus gerardiana Wall.)[J]. Silvae Genetica, 1993, 42(2/3): 61-63.
[2] VENKATACHALAM M, SATHE S K. Chemical composition of sel ected edible nut seeds[J]. Journal of Agricultural and Food Chemistry, 2006, 54(13): 4705-4714.
[3] DESTAILLATS F, CRUZ-HERNANDEZ C, GIUFFRIDA F, et al. Identification of the botanical origin of pine nuts found in food products by gas-liquid chromatography analysis of fatty acid prof i le[J]. Journal of Agricultural and Food Chemistry, 2010, 58(4): 2082-2087.
[4] SAGRERO-NIEVES L. Fatty acid composition of mexican pine nut (Pinus cembroides) oil from three seed coat phenotypes[J]. Journal of the Science of Food and Agriculture, 1992, 59(3): 413-414.
[5] LEE J W, LEE K W, LEE S W. Selective increase in pinolenic acid(all-cis-5,9,12-18:3)in Korean pine nut oil by crystallization and its effect on LDL-receptor activity[J]. Lipids, 2004, 39(4): 383-387.
[6] ZHANG Ying, WANG Zhenyu, CHEN Xiaoqiang. Ultrasoundassociated extraction of seed oil of Korean pine[J]. Journal of Forestry Research, 2005, 16(2): 140-142.
[7] MENAYA G, GONZALO-GARIJO M A, MONEO I, et al. A 17-kDa allergen detected in pine nuts[J]. Allergy, 2000, 55(3): 291-293.
[8] FINE A J. Hypersensitivity reaction to pine nuts (pinon nuts-pignolia) [J]. Ann Allergy, 1987, 59(3): 183-184.
[9] MARINAS D L, VILA L, SANZ L. Allergy to pine nuts[J]. Allergy, 1998, 53(2): 220-222.
[10] 蒋丽萍, 高吉喆. 松子仁蛋白提取工艺的研究[J]. 中国科技信息, 2005(23): 101.
[11] NERGIZ C, DONMEZ I. Chemical composition and nutritive value of Pinus pinea L. seeds[J]. Food Chemistry, 2004, 86(3): 365-368.
[12] 母智深, 白英, 赵广华, 等. 荧光假单胞杆菌胞外蛋白酶的纯化及热稳定性[J]. 高等学校化学学报, 2008, 29(4): 762-766.
[13] 潘滨, 谢月霞, 戴君勇. 凡纳滨对虾蛋白酶的分离纯化及生化特性[J]. 水产科学, 2009, 28(12): 763-766.
[14] 黄光荣, 应铁进, 戴德慧, 等. 嗜热芽孢杆菌蛋白酶HS08的分离纯化研究[J]. 食品科学, 2007, 28(4): 179-181.
[15] AUSUBEL F M, BRENT R, KINGSTON R E, et a1. Current protocols in molecular biology[M]. Hoboken: John Wiley & Sons Inc, 1997: 1024-1068.
[16] 魏群. 分子生物学实验指导[M]. 2版. 北京: 北京高等教育出版社, 2007: 100-102.
[17] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J]. Anal Biochem, 1976, 72(1/2): 248-254.
[18] 戴志远, 任明, 张燕平. 电泳和层析方法对梅鱼蛋白酶解产物的分离分析[J]. 中国食品学报, 2007, 7(4): 101-105.
[19] 周景祥, 王桂芹, 余涛. 蛋白酶和淀粉酶活性检测方法探讨[J]. 中国饲料, 2001(11): 23-24.
[20] 刘铭, 胡先成, 韩强, 等. 河川沙塘鳢胚胎、仔鱼发育过程中蛋白酶活性的变化[J]. 淡水渔业, 2008(5): 39-41.
[21] 郝欣, 肖冬光, 郭学武, 等. 纯生啤酒中酸性蛋白酶测定方法的优化[J]. 酿酒科技, 2007(11): 98-99.
[22] 刘忠义. 草鱼肠道胰蛋白酶(GT-A)的纯化及其部分理化性质初探[J]. 西北农林科技大学学报: 自然科学版, 2007, 35(10): 189-195.
[23] 曾小波, 伍丽瑜, 宋小焱, 等. 酱油曲蛋白酶的分离及催化性质研究[J]. 中国调味品, 2010, 35(1): 50-52.
[24] 喇文军. 蛋白质、蛋白酶以及短肽类的分离提纯技术及应用[J]. 食品工程, 2008(1): 15-18.
[25] 吴晓红, 华美玲, 石媛, 等. 响应面法优化脱脂松仁水溶性蛋白提取工艺[J]. 中国油脂, 2010, 35(8): 34-37.
Purif i cation and Properties of Protease from Brazilian Pine (Araucaria angustifolia (Bert) O. Ktze) Nuts
XIAO Li,YING Tie-jin*,CAI Lu-yun,HAN Xiao-xu
(College of Biosystems Engineering and Food Science, Zhejiang University, Hangzhou 310029, China)
An orthogonal array design was used to optimize conditions for the extraction of protease from Brazilian pine nuts. Boric acid-borate buffer was found to be the best solvent for the extraction of protease, and its optimum pH was 9.0. The optimum extraction time and solid-to-solvent ratio were 60 min and 1:8 (m/V), respectively. Pure protease was obtained from crude extract using salting out with ammonium sulfate followed by DEAE-Sepharose FF column chromatography. After purif i cation, the specif i c activity of protease increased 8.61-fold and the activity recovery was 21.65%. As shown by SDS-PAGE, the molecular mass of the enzyme was 33 kD. Enzymatic characterization demonstrated that it was an alkaline and its optimum reaction pH and temperature were 9.0 and 50 ℃, respectively. In addition, Mn2+had a strong activating effect on the enzyme, whereas Ca2+, Mg2+and Cu2+could inhibit its activity.
Brazilian pine nut;protease;purif i cation;protease activity
Q814.1
A
1002-6630(2013)01-0239-05
2011-11-03
肖丽(1986ü),女,硕士,研究方向为农产品加工与保鲜。E-mail:sichuanxiaoli@163.com
*通信作者:应铁进(1958ü),男,教授,博士,研究方向为果蔬采后分子生物学、果蔬贮运技术。E-mail:tjying@zju.edu.cn

