冷鲜鹅加工及冷藏过程中的微生物污染分析
张维益,徐幸莲*,王思丹,周光宏
(南京农业大学 国家肉品加工与质量控制教育部重点实验室,江苏 南京 210095)
冷鲜鹅加工及冷藏过程中的微生物污染分析
张维益,徐幸莲*,王思丹,周光宏
(南京农业大学 国家肉品加工与质量控制教育部重点实验室,江苏 南京 210095)
研究商业屠宰对冷鲜鹅胴体天然菌落的影响。分别对工人手、案板、车间空气、刀具、预冷水及屠宰过程中的鹅胴体取样,进行常见腐败菌及致病菌的微生物传统培养、计数;同时研究冷鲜鹅贮藏过程中的菌落总数变化。结果表明:空气、预冷水与加工过程中的各类接触面都是冷鲜鹅潜在的污染源,都对样品造成了不同程度的污染,但总体上,整个加工过程还是减少了鹅胴体表面各种微生物的污染,加工后鹅胴体表面的各类微生物数量均显著低于生产过程中的。净膛工序使鹅胴体污染程度达到最大,但是冲洗和预冷工序都能有效地减少这一过程的污染。预冷池后段水和包装是鹅胴体二次污染的主要原因,直接导致冷鲜鹅在冷藏7~9d后的腐败。
冷鲜鹅;加工;微生物污染;菌相变化
我国消费者对畜禽产品的要求将向低脂肪、低胆固醇、高蛋白、营养平衡、安全保健的方向发展。鹅肉产品的营养特性符合消费者的需求,并且鹅肉中无(或低)药物残留,属于天然绿色食品[1]。我国是世界第一鹅业生产大国,2009年我国肉鹅出栏量6.47亿只,占世界的93.5%,鹅肉产量约148t,占全球的94.36%[2]。在我国肉类消费中,鹅肉的消费比从10年前的1%上升到现在的4%,而且这一比重还在增加。鹅肉产品市场潜力巨大,使得人们开始关注鹅肉消费的安全性,这就要求产品必须在良好的加工、贮藏和销售环境中,否则就会被微生物污染,其中以屠宰分割过程微生物污染机会最大。进入商业屠宰场的禽类羽毛、皮肤、爪子以及消化道都大量携带各种天然菌群[3],污染是不可避免的。所以正确的操作、进一步改善肉表面卫生进而抑制有害微生物的生长,才能延长货架期,保证产品的安全质量[4]。
屠宰过程包括放血、烫毛、净膛、预冷等多个工序,尽管总的来说,屠宰加工过程减少了胴体的微生物污染[5],但是胴体、加工用水和设备的交叉污染可能会增加胴体的污染水平[6-7]。浸烫和去毛工序去除了活禽羽毛和皮肤上携带的大量微生物,然而这些工序可能导致交叉污染,并且使得其他种类的微生物在后续的净膛和预冷工序中有新的附着表面,污染胴体,并且导致产品的腐败变质[6]。生产车间的空气也会成为污染来源之一,空气中的微生物可能来源于禽本身、未及时清理的加工废弃物以及没有定期消毒的物体表面[8]。
近年来,传统的屠宰工艺一直在不断改进以避免细菌污染,并引用栅栏技术和HACCP控制体系。宋超[9]在冷却猪肉生产中引入了无菌栅栏技术,减少了胴体的污染程度,延长了冷却肉保质期。随着国外先进技术的引进,我国在冷却肉和肉鸡生产中都建立了完整的HACCP控制体系,但是在鹅屠宰及加工技术上目前我国甚至全球还无人开展过系统而深入的研究,制约了我国鹅肉产业的发展。
本研究的目的在于研究冷鲜鹅加工过程中的微生物多样性和动态变化,研究加工过程中各工序和生产环境对产品的污染程度;旨在了解微生物的来源和种群构成,为确定科学的生产车间控菌措施和生产规范提供理论依据,为建立冷鲜鹅HACCP控制体系提供有用信息。
1 材料与方法
1.1 材料、试剂与仪器
原料鹅肉从大型鹅屠宰加工企业生产线上随机取样。取各工序后样品立即冰运至实验室,使用前于(4f1)℃保存不超过1h。
平板计数琼脂(PCA)培养基、MRS培养基、甘露醇氯化钠琼脂(MSA)培养基、结晶紫中性红胆盐琼脂、假单胞分离琼脂、肠道菌计数琼脂 北京陆桥技术有限责任公司。
BCD-208KBS变频冰箱 青岛海尔集团;SPX-250B-Z 型生化培养箱 上海益恒实验仪器有限公司;DGG-9240A型电热恒温鼓风干燥箱 上海柏欣仪器设备厂;LDZX-50KB立式压力蒸汽灭菌锅 上海申安医疗器械厂;HT-1300-U洁净工作台 苏净集团苏州安泰公司。
1.2 方法
1.2.1 样品与处理
1.2.1.1 冷鲜鹅屠宰工序
收鹅→宰杀→沥血(3~5min)→浸烫(58~65℃、2min)、脱毛→浸蜡(65~70℃,18s)、脱蜡→人工去小毛→开膛、净膛→喷淋冲洗→预冷消毒(两段式螺旋推进式预冷池,0~4℃、40min,80mg/L氯酸钠)→包装→冷藏
1.2.1.2 屠宰环境污染源采样点
环境空气(挂鹅间、放血烫毛间、去小毛间、净膛间、预冷间、内脏处理间、包装间);接触面(包装案板、净膛案板、净膛工人手、去小毛工人手);刀具(放血刀、开膛刀、去翅刀);预冷水(前段、后段)。
1.2.1.3 屠宰、冷藏过程中胴体污染样品
生产过程中胴体污染样品采样点分别为打毛后、去小毛后、净膛后、预冷后。每次在上述4个工序点各随即取6个胴体,20min内冰运至实验室,当即检测。
取预冷后的鹅胴体18只,分别割取鹅胸肉,其中3个立即检测,其余15个样品真空包装,(4f1)℃冷藏,分别于1、3、5、7、9d检测菌落总数。
1.2.2 取样及微生物检测
1.2.2.1 空气沉降菌落总数测定
在生产前、生产中和生产后分别取样。取样方法参照GB/T 182041ü2000《公共场所空气微生物检验方法-细菌总数测定》中的自然沉降法。计数每块平板上生长的菌落数,求出全部采样点的平均菌落数。以每平皿菌落数(CFU/皿)报告结果。
1.2.2.2 加工工序中接触处面及刀具
每类接触面随即取3个样品。采用50cm2专用取样器,将沾有无菌生理盐水的灭菌棉棒在取样器范围内反复擦拭10次。取样后迅速将棉棒放入装有50mL无菌生理盐水的无菌密闭三角瓶中,立即送至实验室,摇床(60r/min)30min,然后按要求做10倍梯度稀释,选择3个合适的稀释度接种后培养计数。
1.2.2.3 预冷水
在生产中期取冷却水10mL,冰运至实验室,从中取1mL进行接种培养。
1.2.2.4 屠宰工序中胴体表面
在鹅胸处取样,取样方法同1.2.2.2节。
1.2.2.5 冷藏过程中鹅胸肉样品
在无菌环境下,每个样品剪取10g肉样,剪碎后置于装有90mL无菌生理盐水的密闭三角瓶中,摇床(60r/min)30min,静置5min后取1mL上清液,并由此制备10倍梯度稀释。
1.2.2.6 微生物培养计数
选择性培养的微生物种类和方法见表1。

表 1 微生物选择性培养基及培养条件Table 1 Selective media and culture conditions for different bacteria
1.3 数据分析
根据菌落计数结果计算样品单位面积(体积)中各种菌的数量,使用SPSS.16.0对数据进行单因素方差(One-way ANOVA)分析。
2 结果与分析
2.1 屠宰环境污染情况调查
2.1.1 车间空气污染情况
由表2可知,生产前,去小毛间和预冷间空气沉降菌落总数分别为0.77(lg(CFU/皿))和0.83(lg(CFU/皿)),空气污染程度明显(P<0.05)低于其他房间,其余5个生产车间细菌总数均在1.10(lg(CFU/皿))左右。
生产中,各车间空气沉降菌落总数平均上升了1.20(lg(CFU/皿))左右,污染程度均显著高于生产前(P<0.05)。其中,生产前区(挂鹅和放血烫毛间)空气沉降菌落总数多不可计,污染最严重,而生产后区空气污染情况则远低于前区,空气污染严重程度依次为:净膛间>内脏加工间>去小毛间≈预冷间>包装间;生产后,挂鹅间空气沉降菌落总数依然是多不可计,去小毛间2.20(lg(CFU/皿)),污染最严重,高于生产中(P<0.05),其他车间空气沉降数量均显著低于生产中(P<0.05)。总体上来说,车间空气污染程度生产中>生产后>生产前。
表 2 不同车间空气沉降菌落总数(±s)Table 2 Microbiological examination (aerobic bacterial count) of air samples from different workshops±s)
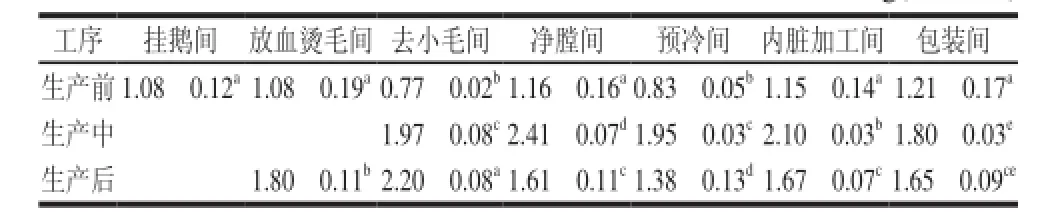
表 2 不同车间空气沉降菌落总数(±s)Table 2 Microbiological examination (aerobic bacterial count) of air samples from different workshops±s)
注: ü表示菌落总数(CFU)多不可计;同行或同列内不同字母表示差异显著(P<0.05)。
工序挂鹅间放血烫毛间去小毛间净膛间预冷间内脏加工间包装间生产前1.08f0.12a1.08f0.19a0.77f0.02b1.16f0.16a0.83f0.05b1.15f0.14a1.21f0.17a生产中üü1.97f0.08c2.41f0.07d1.95f0.03c2.10f0.03b1.80f0.03e生产后ü1.80f0.11b2.20f0.08a1.61f0.11c1.38f0.13d1.67f0.07c1.65f0.09ce
2.1.2 接触面污染状况及菌相结构
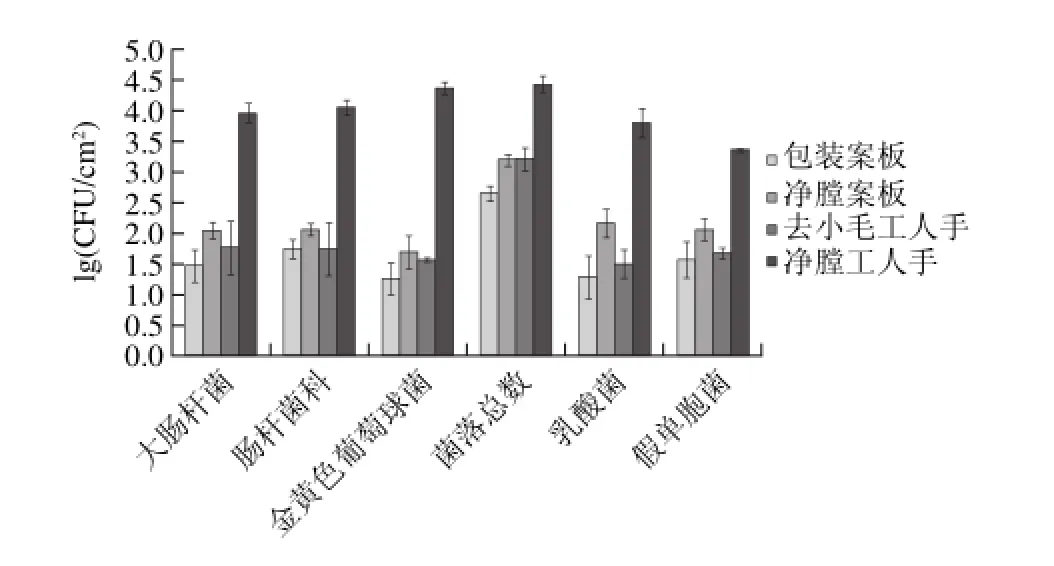
图 1 屠宰加工过程中胴体接触面污染程度及菌相变化Fig.1 Changes in the microf l ora on the surface of chopping boards and workers’hands during processing
由图1可见,净膛工人手表面各种细菌数量均在3.75(lg(CFU/cm2))左右,明显高于其他接触面,其中除了菌落总数外,金黄色葡萄球菌数量最多,在4.5(lg (CFU/cm2))左右,假单胞菌最少,为3.3(lg(CFU/cm2))。净膛案板也是污染较严重的接触面,菌落总数最多,为3.1(lg(CFU/cm2)),其他菌数量均在2.0(lg(CFU/cm2))左右。包装案板污染相对最小,均在1.5(lg(CFU/cm2))左右,去小毛工人手表面各种细菌数量均比包装案板略高。
2.1.3 加工过程中刀具污染状况及菌相构成
由图2可见,微生物对刀具的污染程度为:去翅刀>开膛刀>放血刀。去翅刀污染最严重,菌落总数和肠杆菌科数量最多,在3.0(lg(CFU/cm2))左右,金黄色葡萄球菌最少;开膛刀上金黄色葡萄球菌略高于去翅刀,其他菌数量均低于去翅刀;放血刀污染程度最小,除菌落总数外,金黄色葡萄球菌和乳酸菌最多,为2.3(lg(CFU/cm2)),大肠杆菌和假单胞菌最少,为1.0(lg(CFU/cm2))。

图 2 加工过程中刀具污染程度及菌相变化Fig.2 Changes in the microf l ora on various cutting tools during processing
2.1.4 预冷水污染状况及菌相构成
预冷池分前后两段,两段都为流动的冷凝水,换水量保持在每只鹅3L。一般前段预冷水温控制在≤10℃,后段≤4℃,前段内消毒剂次氯酸钠质量浓度为80mg/L胴体在预冷池内与水流逆向移动,预冷总时间不少于40min。
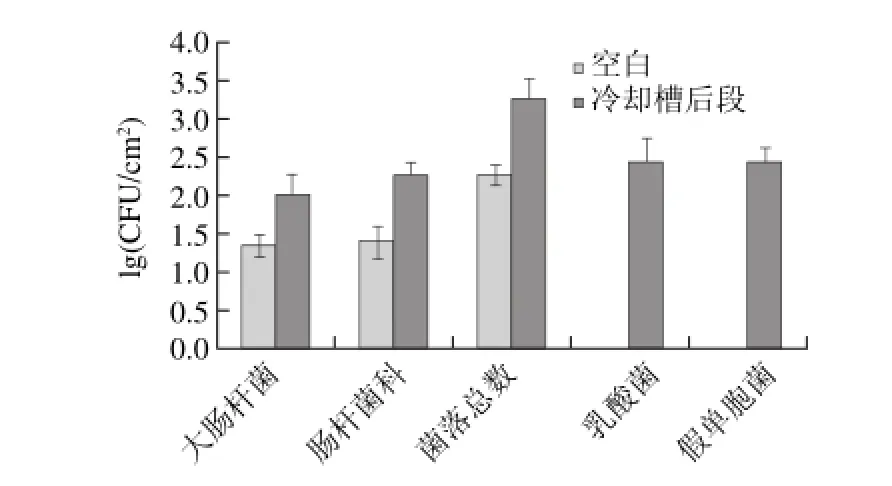
图 3 预冷水污染情况及菌相构成Fig.3 Bacterial contamination and microf l ora of pre-chilling water
由图3可见,自来水本身含有一定数量的大肠杆菌、肠杆菌科,菌落总数最多,为2.3(lg(CFU/cm2))。预冷池前段水中各种细菌均未检出。预冷池后段水中菌落总数为3.2(lg(CFU/cm2)),金黄色葡萄球菌未检出,其余4种菌数量都在2.0~2.5(lg(CFU/cm2))之间。
2.2 加工过程中鹅胴体污染状况及菌相构成
图4反映的是主要加工工序中各种细菌对胴体表面的污染情况。打毛后鹅屠体表面菌落总数为3.4(lg(CFU/cm2)),假单胞菌未检出。去小毛后屠体表面大肠杆菌、肠杆菌科和假单胞菌数量较打毛后均有显著增加,其中假单胞菌增长幅度最大,而金黄色葡萄球菌和菌落总数减少了约30%,乳酸菌变化不大。
净膛后鹅胴体表面除乳酸菌外各种菌数量均有显著增长,菌落总数最多,达到4.3(lg(CFU/cm2)),其他种类菌数量在2.4(lg(CFU/cm2))左右。预冷后鹅胴体表面大肠杆菌、肠杆菌科、菌落总数和假单胞菌数量比净膛后较少了50%,乳酸菌较少了30%左右,金黄色葡萄球菌没有检出。

图 4 加工过程中鹅胴体污染状况及菌相构成Fig.4 Bacterial contamination and micro fl ora of goose carcasses during processing
2.3 冷藏过程中鲜冷鹅菌落总数变化情况

图 5 冷藏过程中冷鲜鹅菌落总数变化Fig.5 Aerobic bacterial count change of chilled goose during refrigerated storage
由图5可见,鲜冷鹅的初始菌落总数为2.0(lg(CFU/g)),在冷藏的第一天就进入对数生长期,迅速繁殖,增长至4.5(lg(CFU/g))。在随后3~7d的冷藏期间,菌落总数缓慢增长,到第7天末,菌落总数为5.2(lg(CFU/g)),此后,细菌再次加快繁殖速度,到第9天末达到6.1(lg(CFU/g))。
虽然样品菌落总数到第9天还保持在鲜肉标准范围之内,但感官品质变化明显,贮藏后期表现出腐败变质特征。样品冷藏至第7天时样品出现肉质变软、肉色变暗、汁液渗出较多的现象,表现出腐败的特征,到第9天时开始腐败,异味加重,肉质松软。
3 讨 论
空气中微生物是禽类生产中不可忽视的污染来源之一。生产过程中,前区(挂鹅间、放血烫毛间)污染最严重,这些细菌主要来自鹅本身的皮肤和羽毛,空气中的高污染程度可能是由于挂鹅时鹅翅拍打挣扎造成灰尘散布以及鹅粪便未及时清理,放血烫毛间由于烫毛水造成的雾气以及打毛机扬起的灰尘和绒毛,并且车间温湿度较高,这样的环境适宜微生物的生长繁殖,使得空气中菌落总数较高。生产准洁净区空气污染程度降低,其中净膛间和内脏加工间污染严重,这可能是由于一些胴体的肠道破损,肠道内容物流出,并且没有及时清理,使微生物大量繁殖,污染了车间环境;去小毛车间和预冷间由于操作都在流动水中进行,所以污染相对较低。生产后车间内清洁人员的走动及冲洗可能导致一些细菌扬起,并且没有及时沉降,使得空气中仍有较多的细菌。各车间的污染程度不同,但存在相同的问题,即未采取彻底有效的环境消毒措施。Cundith等[16]研究表明,静电沉淀过滤与紫外线对小型肉类加工厂控制空气中的微生物量有很好的效果。
屠宰加工过程中与产品直接接触的潜在污染源中,净膛工人手部污染最严重,这和李虹敏[17]的研究结果一致,其中金黄色葡萄球菌最多,假单胞菌最少。这是由于在掏膛时工人手套上会粘有一些血迹和肠道内容物,加上没有及时清洗,所以微生物大量繁殖,并且污染胴体,同时这些污染物也污染了净膛案板。由于烫毛、打毛和去小毛过程中鹅屠体分别经过了65℃的水浴和70℃的石蜡,高温消除了部分污染微生物,所以鹅屠体表面污染程度较轻,并且假单胞菌很少,打毛后鹅屠体表面未检出假单胞菌。但是经过净膛工序后,各种细菌数量均有显著增加,这是由于净膛操作不当引起的交叉污染。由此可见,净膛工序是整个屠宰加工过程的关键控制点,必须采取有效措施降低交叉污染。
调查表明,案板、加工刀具等接触面也是污染胴体的主要来源。尤其是包装案板,由于与胴体直接接触,并且后续过程没有减菌措施,直接包装贮藏,直接影响冷鲜鹅的初始菌数,进而限制产品的货架期和安全性。除乳酸菌外,包装案板表面各类菌数量均略高于预冷后胴体,并检出金黄色葡萄球菌,可能影响产品的食用安全。由于刀具与胴体直接接触,刀具上的微生物将会对胴体表面造成交叉污染[18]。有资料表明[19]刀具上的微生物含量在4.0(lg(CFU/cm2)),说明刀具对胴体和鲜肉的污染是非常严重的。文献[20]报道对屠宰工序上的刀具进行调查,有的细菌总数在4.23~6.26(lg(CFU/cm2))之间,有的在3.5~4.7lg(CFU/cm2)之间[21],还有的达到9.1h104[22],本实验调查结果中,3类刀具菌落总数在2.9~3.4(lg(CFU/cm2))之间,其他种类菌也都在较低的水平,说明刀具对胴体的污染较小。这可能是因为在禽类屠宰加工过程中,刀具使用时接触面相对较小,并且经常清洗,所以污染较小。刀具在使用一段时间后,表面都会粘满屠宰过程残留的污物。这些污物是微生物生长的良好培养基,在外界条件适宜的情况下,短时间内微生物大量繁殖,再与胴体接触就会造成交叉污染[23]。因此建立良好的刀具防污染控制措施是保证冷鲜鹅生产的重要环节。
预冷过程对消除胴体微生物污染起着重要的作用,通过水的冲洗能冲洗掉胴体表面黏附的大部分细菌,并且水中一定浓度的消毒剂能抑制绝大多数嗜温细菌的繁殖。经过预冷,胴体表面各种细菌数量都显著下降,金黄色葡萄球菌未检出。胴体表面与预冷池后段水中各种菌的数量和菌相构成基本一致,而预冷池前段水中各类细菌均未检出,因此可以看出,前段预冷水中一定浓度的消毒剂虽然起到了一定的减菌效果,约减少了50%的细菌,但是仍有一部分细菌黏附在胴体表面,污染了后段水,并引起交叉污染,成为贮藏过程中的潜在污染菌,这和Hinton等[23]的研究结果一致。因此在生产过程中,必须经常更换预冷用水,减少预冷水与胴体的交叉污染;并定时补充消毒剂浓度,使前段预冷水保持较高的减菌效率。
冷鲜鹅冷藏过程中菌落总数显著增加,这些细菌主要来自于包装案板及后段预冷水。样品的初始菌落总数为102CFU/g,从第7天开始有腐败迹象,第9天达到106CFU/g,样品开始腐败。有资料表明[24],冷却肉初始菌落总数为102CFU/g时货架期为15d,当菌落总数达到106CFU/g时冷却肉开始腐败,这和本实验的结果基本一致。
4 结 论
空气、预冷水与加工过程中的各类接触面都是冷鲜鹅潜在的污染源,都对产品造成了不同程度的污染。但是总的来说,整个加工过程还是减少了鹅胴体表面各种微生物的污染,产品表面的各类微生物都显著低于生产过程中。净膛工序使胴体污染程度达到最大,但是后续的冲洗和预冷工序都能有效得减少这一过程的污染。预冷池后段水和包装过程是鹅胴体二次污染的主要原因,直接导致真空包装产品在冷藏7~9d后的腐败。
[1] 曹宏, 蒋云升. 鹅肉食用前景和消费市场初探[J]. 安徽农业科学, 2005, 33(12): 2480.
[2] 侯水生. 中国鹅业发展面临的困境及技术措施建议[C]// 2010全国鹅业大会. 济南: 山东省农业科学院, 2010: 1-3.
[3] KOTULA K L, PANDYA Y. Bacterial contamination of broiler chickens before scalding[J]. Journal of Food Protection, 1995, 58: 1326-1329.
[4] AHMED S N, CHATTOPADYAY U K, SHERIKAR A T, et al. Chemical sprays as a method for improvement in microbiological quality and shelf-life of fresh sheep and goat meats during refrigeration storage (5ü7 ℃) [J]. Meat Science, 2003, 63: 339-344.
[5] GEORNARAS I, von HOLY A. Bacterial counts associated with poultry processing at different sampling times[J]. Journal of Basic Microbiology, 2000, 40: 343-349.
[6] THOMAS C J, MCMEEKIN T A. Contamination of broiler carcass skin during commercial processing procedures: an electron microscopic study[J]. Applied and Environmental Microbiology, 1980, 40: 133-144.
[7] FRIES R, GRAW C. Water and air in two poultry processing plants’chilling facilities: a bacteriological survey[J]. British Poultry Science, 1999, 40: 52-58.
[8] RUSSELL S M, FLETCHER D L, COX N A. Spoilage bacteria of fresh broiler chicken carcasses[J]. Poultry Science, 1996, 75: 2041-2047.
[9] 宋超. 冷却猪肉生产中无菌栅栏技术研究[D]. 郑州: 河南农业大学, 2009.
[10] 中华人民共和国卫生部. GB 4789.3ü2010食品微生物学检验 大肠菌群计数[S].
[11] 中华人民共和国国家进出口商品检验局. SN/T 0738ü1997出口食品中肠杆菌科检验方法[S].
[12] 中华人民共和国卫生部. GB 4789.10ü2010食品微生物学检验金黄色葡萄球菌检验[S].
[13] 中华人民共和国卫生部. GB 4789.2ü2010食品微生物学检验-菌落总数测定[S].
[14] 中华人民共和国卫生部. GB 4789.35ü2010食品微生物学检验-乳酸菌检验[S].
[15] ISO 13720ü2010 Meat and meat products: enumeration of presumptive Pseudomonas spp.[S].
[16] CUNDITH C J, KERTH C R, JONES W R. Air-cleaning system effectiveness for control of airborne microbes in a meat-processing plant[J]. Food Science, 2002, 67: 1170-1173.
[17] 李虹敏. 肉鸡屠宰加工及冷藏中的微生物污染来源及菌相分析[J].肉类工业, 2008(6): 33-38.
[18] 李殿鑫. 肉牛屠宰分割生产线HACCP体系的建立[D]. 南京: 南京农业大学, 2005.
[19] 白凤翎. 生猪屠宰过程中的微生物污染及控制[[J]. 中国兽医杂质, 2004, 40(10): 50-51.
[20] 甘伯中. HACCP 在冷却分割猪肉生产中的应用[J]. 甘肃农业大学学报, 2003(2): 188-193.
[21] 彭梅仙, 黄裕. 肉联厂屠宰过程中肉品的致病性细菌污染分析及关键控制点[J]. 肉品卫生, 2002(8): 25-26.
[22] 许益民. 生肉的微生物污染和对策[[J]. 中国动物保健, 2000(9): 26-27.
[23] HINTON A, Jr, CASON J A, INGRAM K D. Enumeration and identif i cation of yeasts associated with commercial poultry processing and spoilage of refrigerated broiler carcasses[J]. Journal of Food Protection, 2002, 65: 993-998.
[24] GILL C O. Extending the storage life of raw chilled meats[J]. Meat Science, 1996, 43(1): 99-109.
Analysis of Bacterial Contamination during Processing and Refrigerated Storage of Chilled Goose
ZHANG Wei-yi,XU Xing-lian*,WANG Si-dan,ZHOU Guang-hong
(Key Laboratory of Meat Processing and Quality Control, Ministry of Education, Nanjing Agricultural University, Nanjing 210095, China)
The effect of commercial processing on the natural microf l ora of chilled goose was studied. Common spoilage bacteria and pathogenic bacteria from workers’ hands, chopping boards, cutting tools, goose carcasses and workshop air environments and chilling water were cultured by traditional methods and counted. Meanwhile, changes in aerobic plate count during refrigerated storage were explored. Although air, chilling water and various contact surfaces were all potential sources of bacterial contamination for chilled goose, in general, various bacterial contaminants showed a downward trend during the whole processing process. Bacterial contamination of goose carcasses was maximized during the stage of evisceration but effectively reduced by spray rinsing and pre-chilling. The second stage of pre-chilling and packaging were main causes of secondary contamination of goose carcasses and as a result, the shelf life of chilled goose spoiled was only 7ü9 days during refrigerated storage.
chilled goose;processing;microbial contamination;microf l ora changes
Q939.97
A
1002-6630(2013)01-0290-05
2011-10-23
江苏省科技成果转化专项资金项目(BA2008088)
张维益(1986ü),男,硕士研究生,研究方向为肉品质量安全控制。E-mail:2009108061@njau.edu.cn
*通信作者:徐幸莲(1962ü),女,教授,博士,研究方向为肉品质量安全控制。E-mail:xlxu@ njau.edu.cn

