马氏珠母贝糖胺聚糖毒理学安全评价
范秀萍,吴红棉*,叶庆俊,钟 敏,胡雪琼,雷晓凌
(广东海洋大学食品科技学院,广东 湛江 524006)
马氏珠母贝糖胺聚糖毒理学安全评价
范秀萍,吴红棉*,叶庆俊,钟 敏,胡雪琼,雷晓凌
(广东海洋大学食品科技学院,广东 湛江 524006)
目的:研究珠母贝糖胺聚糖作为保健食品使用的毒理学安全性。方法:利用大鼠急性毒性实验、小鼠骨髓细胞微核实验、小鼠精子畸变实验、Ames实验和大鼠30d喂养实验进行毒理学研究与评价。结果:急性毒性实验结果表明珠母贝糖胺聚糖对雌、雄大鼠急性经口最大耐受量(MTD)均大于20.0g/kg,其剂量大于人体推荐量的300倍,说明受试物属于无毒级物质。小鼠骨髓细胞微核实验、小鼠精子畸变实验、Ames实验3项遗传毒性实验的结果皆为阴性,未显示出致突变性。30d喂养实验表明,珠母贝糖胺聚糖高、中、低3个剂量组(分别为2.5、1.25、0.625g/kg)动物的身体、脏器的生长发育及血液生化指标等均无明显不良影响。结论:珠母贝糖胺聚糖具有较好的安全性,可作为保健食品使用。
珠母贝糖胺聚糖;急性毒性;遗传毒性; 30d喂养实验
马氏珠母贝(Pinctada martensii Dunder)是我国南海珠母贝的主要贝种,在广东、广西部分地区养殖量极大。珠母贝全脏器俗称珍珠贝肉,价格低廉(约3~4元/kg),在珍珠养殖地区如广东省的雷州市及徐闻县、广西壮族自治区的北海市及钦州市、海南省的部分地区,当地珠农及居民常以珠母贝全脏器用作食疗食品,北部湾沿海有服用珍珠贝肉治疗乙肝的传统方法,也有食用珍珠贝肉汤以退发烧的,效果甚佳[1]。
珠母贝糖胺聚糖(glycosaminoglycan from Pinctada martensii,CPG)是从马氏珠母贝全脏器中分离提取出来的一种酸性多糖,糖胺聚糖含量为33%,结构与硫酸软骨素类似,具有显著的免疫增强作用与抗肿瘤作用[2-4]。本研究依据《保健食品检验与评价技术规范》[5]对其进行毒理学安全性评价,旨在为珠母贝糖胺聚糖用作保健食品及药品提供科学的参考。
1 材料与方法
1.1 材料、实验动物与菌株
珠母贝糖胺聚糖,灰白色粉末,糖胺聚糖含量为33%,由本实验室提取制备。
SPF级KM小鼠(合格证号:2007A006)、SPF级SD大鼠(合格证号:SCXK(粤)2007A015),均由广东省医学实验动物中心提供。实验动物室温度:22~25℃,相对湿度:55%~70%。
鼠伤寒沙门氏菌突变型菌株(Salmonella typhimurium) TA97、TA98、TA100和TA102,来源于华中科技大学同济医学院武汉环境医学研究所。
1.2 试剂与仪器
敌克松(DAPA)、2-乙酰氨基芴(2-AAF)、大鼠肝微粒体酶复合物(S9) 广州市疾病预防控制中心;伊红 广州市中南化工有限公司;丙氨酸氨基转移酶(ALT)、总蛋白(TP)、尿素氮(BUN)、总胆固醇试剂(T-CHO)、天冬氨酸转氨酶(AST)、甘油三酯(TG)、肌酐(Crea)、白蛋白(ALB)、葡萄糖(GLU) 上海复旦张江生物医药股份有限公司;血常规稀释液(DH-640:050929)、血常规清洗液(DH-520:050817)、血常规溶血剂(DH-680:20050507) 日本光电公司。
全自动血液生化分析仪 意大利Echo公司;MEK-7222K全自动血球计数仪 日本光电公司;TS-12N生物组织全自动脱水机、BM-VII生物组织包埋机及冷冻机、CS-VI摊片烤片机、RS-18生物组织全自动染色机 湖北孝感医用仪器有限公司;RM2135轮转切片机 德国Leica公司。
1.3 方法
1.3.1 急性毒性实验
选取18~22g健康KM小鼠20只,雌雄各半。根据最大耐受剂量法,珠母贝糖胺聚糖粉末质量浓度为0.25g/mL。灌胃前24h禁食,于次日分4次灌胃(每次灌胃量为20mL/kg),灌胃总量达20g/kg,连续观察14d,记录中毒症状及死亡情况。1.3.2 遗传毒性实验
1.3.2.1 Ames实验
选用经鉴定符合要求的鼠伤寒沙门氏组氨酸缺陷型TA97、TA98、TA100、TA102共4株实验菌株,采用平板掺入法,分加与不加S9混合液两种。受试物加热灭菌后,共设4个剂量组,分别为每皿1.25、2.50、5.00、10.00mg/mL。同时设空白对照、阳性对照(DAPA、2-AAF),每组均做3个平行皿。在37℃条件下培养48h,计数每皿回变菌落数,重复实验1次,求出每组平均菌落数。当受试物回变菌落数超过自发回变的2倍以上并有剂量-反应关系时即可判定为阳性。
1.3.2.2 小鼠精子畸形实验
SPF级KM小鼠(25~30g)50只,随机分为5组。对照组给予相同体积蒸馏水;阳性对照组为环磷酰胺(CY,50mg/kg);CPG高、中、低剂量组分别为2.5、1.25、0.625g/kg(为人可能摄入量的100、50、25倍)。各组均按20mL/kg经口灌胃,每日1次,连续5d。首次给药35d后颈椎脱臼法处死小鼠,制备精子标本, 1%伊红染色。高倍镜下观察,每只动物计数1000个精子,记录畸形精子数,计算精子畸变率()。
1.3.2.3 小鼠骨髓红细胞微核实验
SPF级KM小鼠(25~30g)50只,随机分为5组。对照组给予相同体积蒸馏水;阳性对照组为环磷酰胺(50mg/kg);CPG高、中、低剂量组分别为2.5、1.25、0.625g/kg。采用2次经口给受试物,中间间隔24h,于第2次给受试物6h后处死动物,取一侧股骨制备骨髓涂片。Gimsa染色后镜检计数嗜多染红细胞中的微核发生率()。
1.3.3 大鼠30d喂养实验
选取SPF级SD大鼠(100~130g)88只,雌雄各半,随机分为4组,每组22只。对照组给予蒸馏水,CPG高、中、低剂量组分别为2.5、1.25、0.625g/kg,各组均按10mL/kg经口灌胃,每日定时灌胃1次,连续30d。动物自由进食和饮水,每天观察并记录动物的一般表现,每周称体质量及进食量,最后计算食物利用率。
实验结束时,摘眼球取血,用全自动生化分析仪测定血清生化指标。用全自动血细胞计数仪测定血液学指标。然后将实验动物脱颈椎处死,进行大体解剖,观察有无异常,取肝、肾、脾、睾丸(卵巢)用福尔马林固定,进行组织病理学检查[5-6]。
1.4 数据处理
2 结果与分析
2.1 急性毒性实验
在14d的观察期内,动物的活动及体质量增长正常,无一动物死亡;外观、体征、行为活动、精神状态、饮食、大小便等均未有异常改变;口、眼、鼻等处也无异常分泌物。经解剖小鼠,肉眼观察其心、肝、脾、肺、肾、肠等脏器,与正常小鼠比较,皆未发现明显病变和差异。表明该受试物对雌、雄小鼠经口最大可耐受剂量(MTD)≥20g/kg。根据《保健食品检验与评价技术规范》附录D急性毒性剂量分级表的规定,珠母贝CPG属无毒级,可用于食品生产。
2.2 遗传毒性实验
2.2.1 鼠伤寒沙门氏菌/哺乳动物微粒体酶实验(Ames实验)结果
由表1可知,CPG 4个剂量组在添加活化系统(+S9)和未添加(—S9)的情况下,实验菌株TA97、TA98、TA100和TA102的回变菌落数与阴性对照组近似,无倍量关系,CPG组间无剂量-反应关系;而阳性对照组的回变数明显高于阴性对照组,且符合标准诱变剂的测试结果。因此,依据Ames实验的结果判定原则可知:阳性对照物致使鼠伤寒沙门氏菌的突变型发生回复突变;而CPG未显示明显的致突变性。且重复实验结果一致,表明CPG没有明显的致突变性。
2.2.2 小鼠精子畸形实验由表2可知,与对照组相比,CY组的畸变率有极显著性升高(P<0.01);CPG剂量组中,0.625g/kg剂量组与对照组相比畸变率有显著性降低(P<0.05);其他两组无显著性差异(P>0.05)。说明,CPG无致小鼠精子畸形作用。
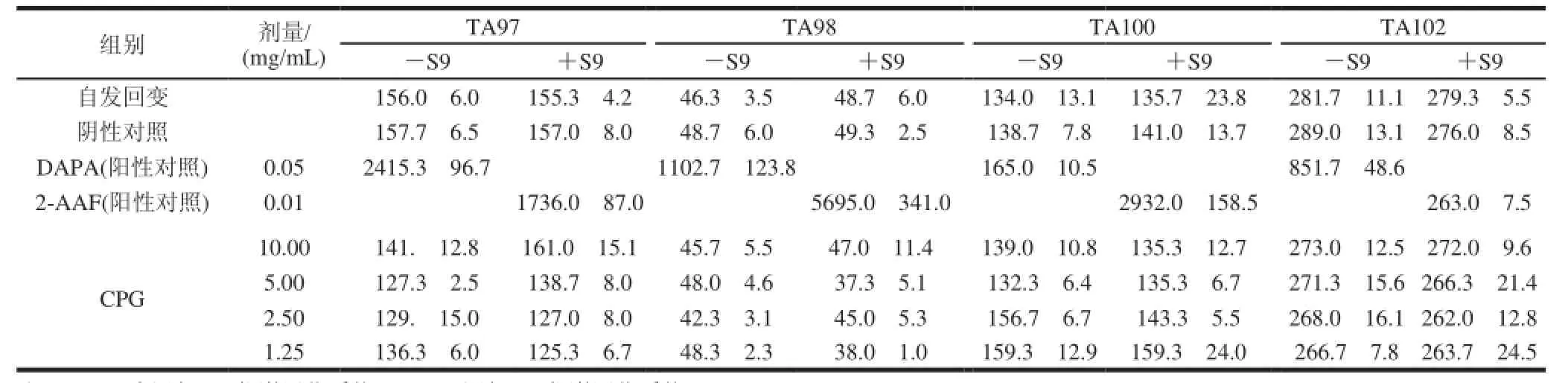
表 1 Ames实验结果(x±s,n=3)Table 1 Results of Ames test(x ±s,n=3)
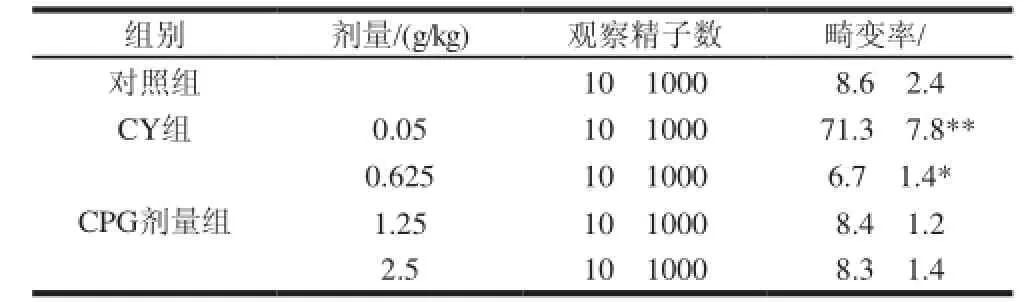
表 2 珠母贝CPG对小鼠精子畸形的影响(x±s,n=10)Table 2 Effect of CPG on mouse sperm abnormality (x±s,n=10)
2.2.3 小鼠骨髓细胞微核实验
表 3 珠母贝CPG对小鼠骨髓细胞微核的影响(±s,n=10)Table 3 Effect of CPG on micronucleus rate of mouse bone marrow polychromatic erythrocytes (±s,n=10)

表 3 珠母贝CPG对小鼠骨髓细胞微核的影响(±s,n=10)Table 3 Effect of CPG on micronucleus rate of mouse bone marrow polychromatic erythrocytes (±s,n=10)
性别组别剂量/(g/kg)微核率/PCE/RBC雄对照组0.7f1.01.12 CY组0.0522.4f2.8**0.91 CPG剂量组0.6251.3f1.51.13 1.251.1f1.11.11 2.50.5f0.81.11雌对照组0.3f0.51.10 CY组0.0525.7f2.2**0.87 CPG剂量组0.6251.0f0.91.12 1.250.7f0.51.15 2.50.5f0.51.13
由表3可知,在两性小鼠中CPG各剂量组的嗜多染红细胞数/成熟红细胞(PCE/RBC)与相应对照组相比无显著性差异;而且也未少于对照组的20%,表明CPG未对骨髓细胞分裂产生抑制。与对照组相比,两性小鼠的CY组微核率均有极显著性差异(P<0.01),表明发生了突变;两性小鼠的CPG各剂量组微核率均无显著性变化(P>0.05),且无剂量-反应关系。结果表明,CPG对两性小鼠骨髓嗜多染红细胞的微核发生率无影响。
2.3 30d喂养实验
2.3.1 一般状况
珠母贝CPG连续喂养30d,SD大鼠外观体征无异常改变,行为活动正常;实验组和对照组动物毛色均有光泽且紧贴身体,口、眼、耳、鼻均无异常分泌物;呼吸规则,粪便成形无黏液,无稀烂。
表 4 珠母贝CPG 30d喂养SD大鼠体质量的影响(±s,n=11)Table 4 Effect of CPG on body weight of SD rats±s,n=11)
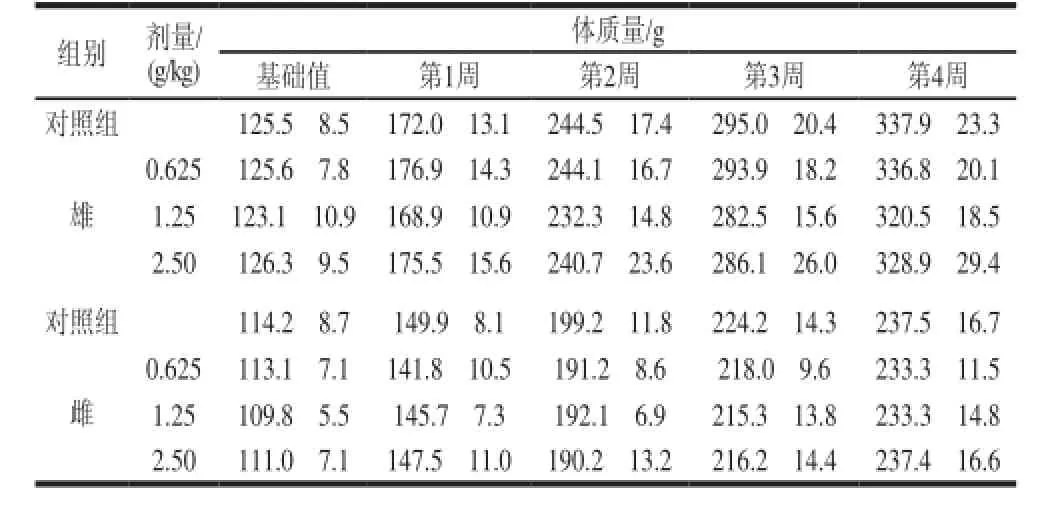
表 4 珠母贝CPG 30d喂养SD大鼠体质量的影响(±s,n=11)Table 4 Effect of CPG on body weight of SD rats±s,n=11)
体质量/g基础值第1周第2周第3周第4周对照组125.5f8.5172.0f13.1244.5f17.4295.0f20.4337.9f23.3组别剂量/ (g/kg) 0.625125.6f7.8176.9f14.3244.1f16.7293.9f18.2336.8f20.1 1.25123.1f10.9168.9f10.9232.3f14.8282.5f15.6320.5f18.5 2.50126.3f9.5175.5f15.6240.7f23.6286.1f26.0328.9f29.4对照组114.2f8.7149.9f8.1199.2f11.8224.2f14.3237.5f16.7雄雌0.625113.1f7.1141.8f10.5191.2f8.6218.0f9.6233.3f11.5 1.25109.8f5.5145.7f7.3192.1f6.9215.3f13.8233.3f14.8 2.50111.0f7.1147.5f11.0190.2f13.2216.2f14.4237.4f16.6
由表4可知,连续喂养30d,各剂量组大鼠体质量呈正常增长,与对照组比较,无显著性差异(P>0.05)。由表5、6可知,各剂量组摄食量及食物利用率、饮水量与对照组比较均未见明显异常。
表 5 珠母贝CPG 30d喂养对SD大鼠平均进食量的影响(±s,n=24)Table 5 Effect of CPG on average daily feed intake of SD rats (±s,n=24)
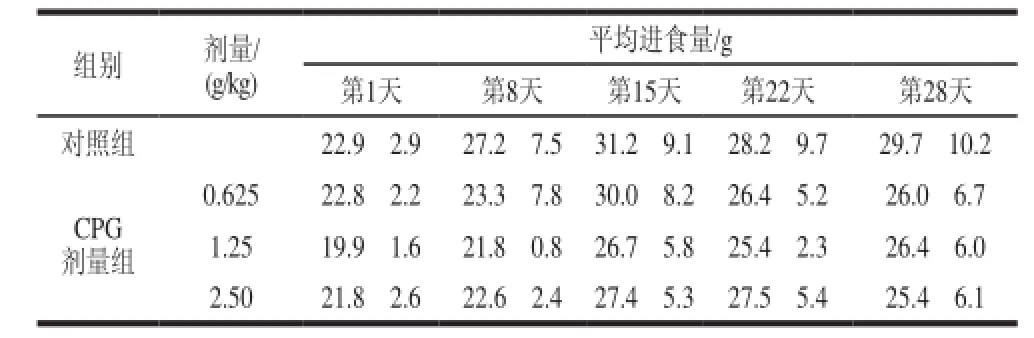
表 5 珠母贝CPG 30d喂养对SD大鼠平均进食量的影响(±s,n=24)Table 5 Effect of CPG on average daily feed intake of SD rats (±s,n=24)
组别剂量/ (g/kg)平均进食量/g第1天第8天第15天第22天第28天对照组22.9f2.927.2f7.531.2f9.128.2f9.729.7f10.2 CPG剂量组0.62522.8f2.223.3f7.830.0f8.226.4f5.226.0f6.7 1.2519.9f1.621.8f0.826.7f5.825.4f2.326.4f6.0 2.5021.8f2.622.6f2.427.4f5.327.5f5.425.4f6.1
表 6 珠母贝CPG 30d喂养对大鼠食物利用率的影响±s,n=11)Table 6 Effects of CPG on feed conversion ratio of male SD rats (±s,n=11)
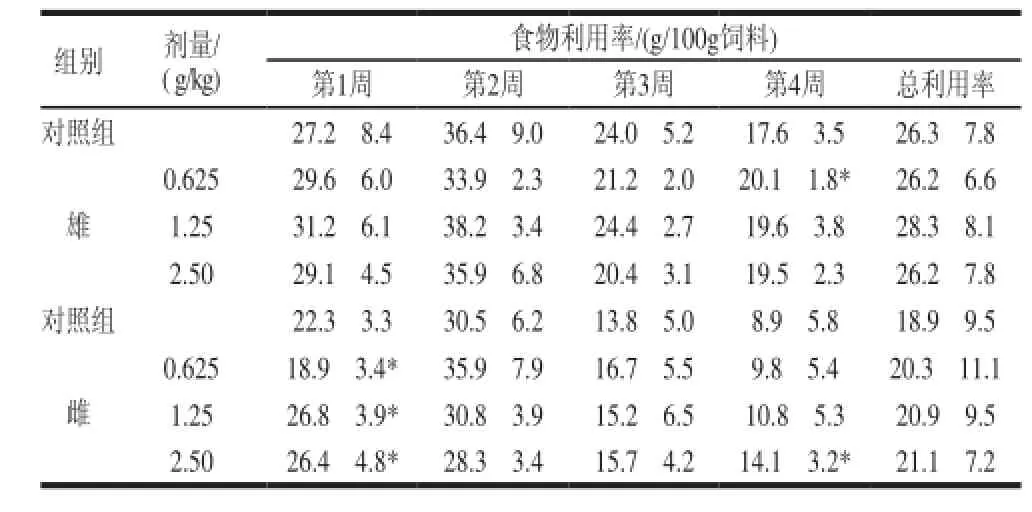
表 6 珠母贝CPG 30d喂养对大鼠食物利用率的影响±s,n=11)Table 6 Effects of CPG on feed conversion ratio of male SD rats (±s,n=11)
食物利用率/(g/100g饲料)第1周第2周第3周第4周总利用率对照组27.2f8.436.4f9.024.0f5.217.6f3.526.3f7.8组别剂量/ ( g/kg) 0.62529.6f6.033.9f2.321.2f2.020.1f1.8*26.2f6.6 1.2531.2f6.138.2f3.424.4f2.719.6f3.828.3f8.1 2.5029.1f4.535.9f6.820.4f3.119.5f2.326.2f7.8对照组22.3f3.330.5f6.213.8f5.08.9f5.818.9f9.5雄雌0.62518.9f3.4*35.9f7.916.7f5.59.8f5.420.3f11.1 1.2526.8f3.9*30.8f3.915.2f6.510.8f5.320.9f9.5 2.5026.4f4.8*28.3f3.415.7f4.214.1f3.2*21.1f7.2
从表6可知,珠母贝CPG连续30d喂养雄性大鼠,低剂量组动物在第4周的食物利用率与对照组比较,具有显著性差异(P<0.05);对雌性大鼠,低剂量组、中剂量组和高剂量组动物在第1周的食物利用率与对照组比较,具有显著性差异(P<0.05)。高剂量组动物在第4周的食物利用率与对照组比较,具有显著性差异(P<0.05),其余各剂量组动物在各周的食物利用率与对照组比较,无显著性差异(P>0.05)。低、中、高剂量组对雌雄小鼠在30d喂养期间的总食物利用率与对照组比较均无显著性差异(P>0.05)。
2.3.2 对大鼠血液血常规的影响
从表7可知,珠母贝CPG连续30d喂养雄性大鼠,中剂量组和高剂量组动物血清中的血红蛋白(HGB)与对照组比较,具有显著性差异(P<0.05),但在正常范围值内,无病理学意义(HGB:120~175g/L)。其余各剂量组动物血清中的红细胞(RBC)、血红蛋白(HGB)、血小板(PLT)、白细胞(WBC)及分类与对照组比较,无显著性差异(P>0.05)。对雌性大鼠,各剂量组动物血清中的红细胞(RBC)、血红蛋白(HGB)、血小板(PLT)、白细胞(WBC)及分类与对照组比较,无显著性差异(P>0.05)。2.3.3 对大鼠血液生化的影响
CPG连续30d喂养雄性大鼠,低剂量组动物的葡萄糖(GLU)含量与对照组比较,具有显著性差异(P<0.05)。中剂量组动物血清中总胆固醇(TC)、甘油三酯(TG)、总蛋白(TP)、白蛋白(ALB)含量与对照组比较,具有显著性差异(P<0.05)。高剂量组动物血清中的总胆固醇(TC)、甘油三酯(TG)、总蛋白(TP)、尿素氮(BUN)含量与对照组比较,具有显著性差异(P<0.05),但均在正常范围值内,无病理学意义。
对雌性大鼠,低剂量组动物的葡萄糖(GLU)含量与对照组比较,具有显著性差异(P<0.05)。中剂量组动物血清中总胆固醇(TC)含量、天冬氨酸转氨酶(AST)活力、尿素氮(BUN)含量、总蛋白(TP)含量与对照组比较,具有显著性差异(P<0.05)。高剂量组动物血清中的总胆固醇(TC)含量、天冬氨酸转氨酶(AST)活力、葡萄糖(GLU)含量与对照组比较,具有显著性差异(P<0.05)。但均在正常范围值(GLU:4.4~8.39mmol/L;TC:1.0~2.76mmol/L;TG:0.2~1.49mmol/L;ALB:25.9~38.5g/L;TP:43.3~80.5μmol/L;BUN:4.05~8.46mmol/L;AST:71.51~196.98U/L[7])内,无病理学意义。
表 7 珠母贝CPG 30d喂养对SD大鼠血常规指标的影响(±s,n=11)Table 7 Effects of CPG on hematological indexes of SD rat±s,n=11)
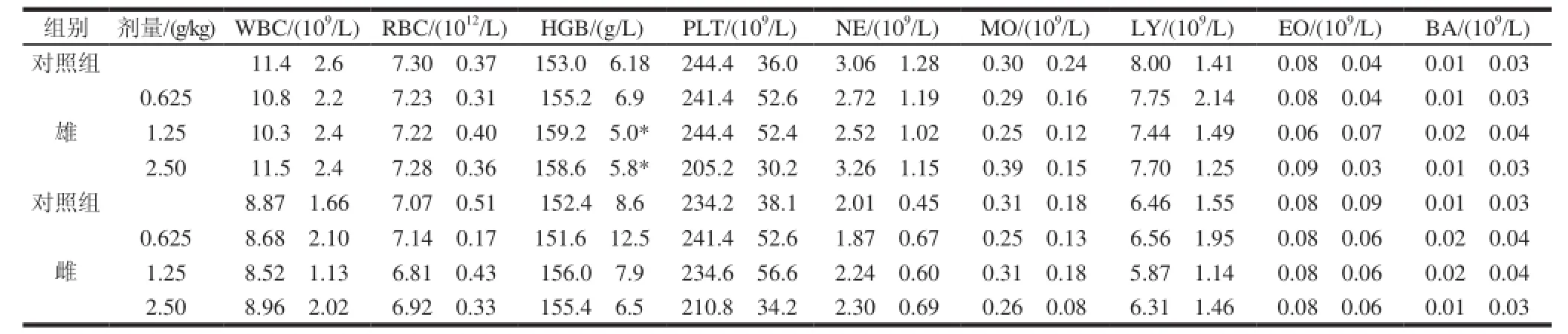
表 7 珠母贝CPG 30d喂养对SD大鼠血常规指标的影响(±s,n=11)Table 7 Effects of CPG on hematological indexes of SD rat±s,n=11)
注:WBC.白细胞;RBC.红细胞;HGB.血红蛋白;PLT.血小板;NE.中性粒细胞;MO.单核细胞;LY.淋巴细胞;EO.嗜酸性粒细胞;BA.嗜碱性粒细胞。
组别剂量/(g/kg)WBC/(109/L)RBC/(10/L)HGB/(g/L)PLT/(10/L)NE/(10/L)MO/(10/L)LY/(10/L)EO/(109/L)BA/(109/L)对照组11.4f2.67.30f0.37153.0f6.18244.4f36.03.06f1.280.30f0.248.00f1.410.08f0.040.01f0.03 0.62510.8f2.27.23f0.31155.2f6.9241.4f52.62.72f1.190.29f0.167.75f2.140.08f0.040.01f0.03 1.2510.3f2.47.22f0.40159.2f5.0*244.4f52.42.52f1.020.25f0.127.44f1.490.06f0.070.02f0.04 2.5011.5f2.47.28f0.36158.6f5.8*205.2f30.23.26f1.150.39f0.157.70f1.250.09f0.030.01f0.03对照组8.87f1.667.07f0.51152.4f8.6234.2f38.12.01f0.450.31f0.186.46f1.550.08f0.090.01f0.03雄0.6258.68f2.107.14f0.17151.6f12.5241.4f52.61.87f0.670.25f0.136.56f1.950.08f0.060.02f0.04 1.258.52f1.136.81f0.43156.0f7.9234.6f56.62.24f0.600.31f0.185.87f1.140.08f0.060.02f0.04 2.508.96f2.026.92f0.33155.4f6.5210.8f34.22.30f0.690.26f0.086.31f1.460.08f0.060.01f0.03雌
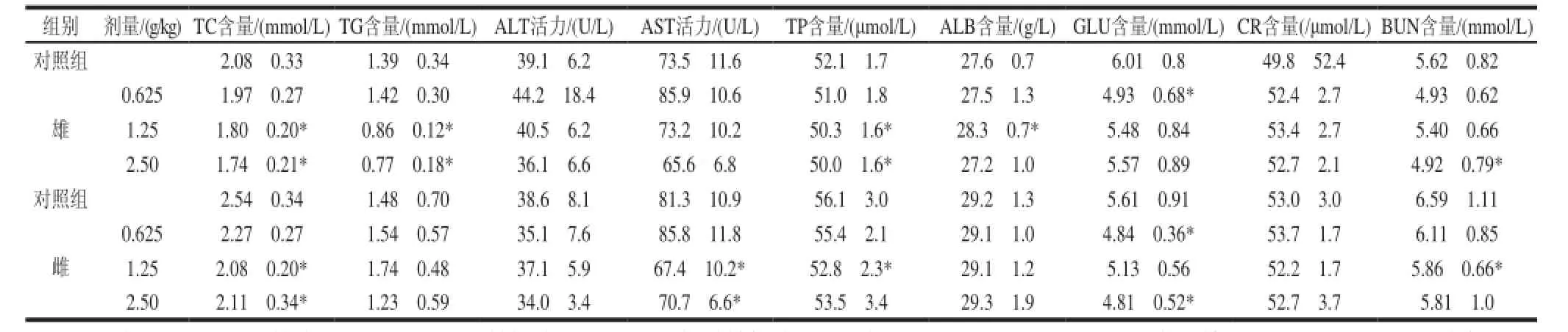
表 8 珠母贝CPG30d喂养对SD大鼠血生化指标的影响(x±s,n=11)Table 8 Effects of CPG on blood biochemical indexes of SD rat (x±s,n=11)
表 9 珠母贝CPG 30d喂养对SD大鼠脏器指数的影响(±s,n=11)Table 9 Effects of CPG on organ/body weight ratios of SD rat (±s,n=11)
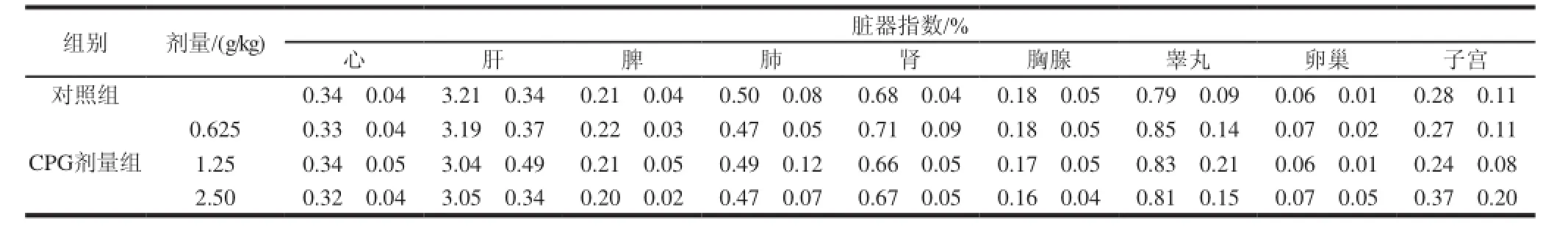
表 9 珠母贝CPG 30d喂养对SD大鼠脏器指数的影响(±s,n=11)Table 9 Effects of CPG on organ/body weight ratios of SD rat (±s,n=11)
胸腺睾丸卵巢子宫对照组0.34f0.043.21f0.340.21f0.040.50f0.080.68f0.040.18f0.050.79f0.090.06f0.010.28f0.11组别剂量/(g/kg)脏器指数/%心肝脾肺肾CPG剂量组0.6250.33f0.043.19f0.370.22f0.030.47f0.050.71f0.090.18f0.050.85f0.140.07f0.020.27f0.11 1.250.34f0.053.04f0.490.21f0.050.49f0.120.66f0.050.17f0.050.83f0.210.06f0.010.24f0.08 2.500.32f0.043.05f0.340.20f0.020.47f0.070.67f0.050.16f0.040.81f0.150.07f0.050.37f0.20
2.3.4 病理学检查
2.3.4.1 系统尸解与脏器指数
珠母贝CPG连续30d喂养后,各实验组动物主要脏器大小正常,表面光滑,无肿胀,无出血点,无异常分泌物,弹性良好,无包块,无结节等。胃肠黏膜无糜烂,无缺损等改变。与对照组比较,均未见异常改变。由表9可知,珠母贝CPG连续喂养30d后,各剂量组的脏器指数与对照组比较,无显著性差异(P>0.05)。
2.3.4.2 组织病理学检查
对高剂量组雌雄大鼠进行肝脏、肾脏、脾脏、胃、肠、睾丸、卵巢的组织病理学检查。均未见由受试物引起的中毒性病理变化。
由30d喂养实验相关指标,可得出结论:马氏珠母贝糖胺聚糖在本实验剂量范围内(0.625~2.5g/kg),对实验动物的生长发育、食物利用率、血液学、心、肝、脾、肾以及糖脂代谢均无不良影响。但在一定剂量内能够增加食物利用率,并且中、高剂量具有降低血清胆固醇的作用(P<0.05)。
3 讨 论
海洋动物中的多糖类物质具有较好的生物活性与应用价值,如已经开发成产品的有:美国GNC的鲨鱼软骨片(其主要成分为硫酸软骨素)、海参多糖胶囊、注射剂等。国内对海洋动物中多糖活性的研究也较为深入,如文蛤多糖[8]、鲍鱼多糖[9]、乌贼墨多糖[10]、扇贝裙边糖胺聚糖[11]等,吴涓等[12]也对贻贝多糖胶囊进行了安全毒理学的评价研究,但对其他动物多糖的安全毒理学的研究还未见详细报道。本课题组一直对马氏珠母贝糖胺聚糖进行研究,结果表明其具有显著的抗肿瘤作用[13-14]。本研究从毒理学角度出发,以马氏珠母贝糖胺聚糖粗品为研究对象,对其急性毒性、遗传毒性和大鼠30d喂养实验进行了研究,为其作为功能食品开发的安全性提供依据。
急性毒性实验中采用最大耐受剂量法,结果表明:马氏珠母贝糖胺聚糖对KM小鼠LD50大于20g/kg(以体质量计),且动物活动正常,未发现不良症状,说明该受试物属于无毒级物质。
根据对遗传物质作用终点的差别,并兼顾原核细胞与真核细胞、体内实验与体外实验以及体细胞和生殖细胞相配套原则,进行了3项遗传毒性实验,即Ames实验、小鼠骨髓细胞微核实验、小鼠精子畸变实验。Ames实验主要是针对生物的基因突变进行评估;小鼠骨髓细胞微核实验主要是对染色体结构完整性变化进行评估,小鼠精子畸变实验所反映的遗传学终点主要是对生殖细胞的遗传毒性进行评估,而且精子畸形率升高表示具有一定的生殖毒性[15]。实验结果表明3项遗传毒性实验结果皆为阴性,未表现出致突变性。且低剂量组的精子畸形率显著降低(P<0.05)。
30d喂养实验显示,马氏珠母贝糖胺聚糖在2.5、1.25、0.625g/kg剂量时,对动物的身体、脏器以及血液学、血液生化指标等均无明显不良影响,说明马氏珠母贝糖胺聚糖对动物的生长发育、造血功能、肝肾等功能均无损害作用。在研究中发现,中、高剂量可显著降低血清胆固醇水平,提示该受试物具有潜在的降脂、调脂功能,这与海洋贝类多糖具有降血脂功能结果一致[16]。
依据中华人民共和国卫生部《保健食品检验与评价技术规范》中保健食品毒理学评价程序的有关规定,综合各项安全毒理学的研究结果,可以认为马氏珠母贝糖胺聚糖作为保健食品是安全的。
[1] 曹彩, 刘鸿萍. 珍珠实用百汇[M]. 北京: 中医古籍出版社, 1993: 58; 73.
[2] 吴红棉, 雷晓凌, 洪鹏志, 等. 珠母贝糖胺聚糖的结构初探及其生理活性[J]. 水产学报, 2001, 25(2): 166-170.
[3] 陈方, 吴铁, 艾春媚, 等. 马氏珠母贝全脏器提取物糖胺聚糖抗肿瘤作用的实验研究[J]. 中国临床药理学与治疗学, 2002, 7(6): 511-514.
[4] 范秀萍, 吴红棉, 雷晓凌, 等. 珠母贝氨基多糖的分离纯化及其抗肿瘤活性的初步研究[J]. 中国海洋药物, 2005, 24(2): 32-36.
[5] 中华人民共和国卫生部. 保健食品检验与评价技术规范[S]. 2003: 177-242.
[6] HUTADILOK-TOWATANA N, REANMONGKOL W, PANICHAYUPAKARANANT P. Evaluation of the toxicity of Arthrospira(Spirulina) platensis extract[J]. J Appl Phycol, 2010, 22: 599-605.
[7] 徐淑云,卞廉如, 陈修. 药理实验方法学[M]. 2版. 北京: 人民卫生出版社, 1991.
[8] 窦昌贵, 黄芳, 黄罗生, 等. 文蛤多糖抗癌免疫药理作用的研究[J].中国海洋药物, 1999(2): 15-19.
[9] ZHU Beiwei, WANG Lisha, ZHOU Dayong, et al. Antioxidant activity of sulfated polysaccharide conjugates from abalone (Haliotis discus hannai Ino)[J]. Eur Food Res Technol, 2008, 227: 1663-1668.
[10] CHEN Shiguo, WANG Jingfeng, XUE Changhu, et al. Sulfation of a squid ink polysaccharide and its inhibitory effect on tumor cell metastasis[J]. Carbohydrate Polymers, 2010, 81: 561-566.
[11] 于囡, 刘赛, 王海桃, 等. 扇贝裙边糖胺聚糖体外抗I型单纯疱疹病毒实验研究[J]. 中国药理学通报, 2008, 24(2): 210-213.
[12] 吴涓, 孙倩, 储智勇, 等. 贻贝多糖胶囊毒理学安全性研究[J]. 中国卫生检验杂志, 2011, 21(1): 97-100.
[13] 吴红棉, 蒋巧俊, 范秀萍, 等. 珠母贝糖胺聚糖对鸡胚绒毛尿囊膜血管生成的影响[J]. 中国药理学通报, 2008, 24(3): 300-302.
[14] 吴红棉, 金晓石, 范秀萍, 等. 珠母贝糖胺聚糖PG-Ⅱ诱导人宫颈癌HeLa细胞凋亡的研究[J]. 食品科学, 2012, 33(3): 238-242.
[15] 昭日格图, 娜日苏, 韩景芬, 等. 黄芪多糖的安全性研究[J]. 食品科学, 2009, 30(19): 309-313.
[16] 储智勇, 毛俊琴, 李铁军, 等. 贻贝多糖对大鼠高脂血症的影响[J].解放军药学学报, 2008(3): 213-215.
Toxicity Evaluation of Glycosaminoglycan from Pinctada martensii
FAN Xiu-ping,WU Hong-mian*,YE Qing-jun,ZHONG Min,HU Xue-qiong,LEI Xiao-ling (School of Food Science and Technology, Guangdong Ocean University, Zhanjiang 524006, China)
Objective: To evaluate the toxicological safety of glycosaminoglycan from Pinctada martensii (CPG) as a health food. Methods: Rat acute toxicity test, mouse bone marrow cell micronucleus test, mouse sperm aberration test, Ames test and 30-day rat feeding test were used. Results: Acute toxicity test showed that the acute oral maximum tolerated doses (MTD) of CPG to male and female rats were both more than 20.0 g/kg body weight, which were over 300 times higher than the recommended human dose, indicating that CPG was non-toxic. The results of genotoxicity tests, including mouse bone marrow cell micronucleus test, mouse sperm aberration test and Ames test, were all negative and without mutations. In addition, no obvious negative impact on body weight, the growth and development of visceral organs or blood biochemical indicators was observed during 30 days of feeding at doses of 2.50, 1.25 g/kg and 0.625 g/kg body weight. Conclusion: It is safe to eat CPG as a dietary supplement.
glycosaminoglycan from Pinctada martensii (CPG);acute toxicity;genotoxicity;subchronic oral toxicity
R114
A
1002-6630(2013)01-0295-05
2011-10-07
广东省科技厅科技计划项目(2005B204012)
范秀萍(1979ü),女,讲师,硕士,研究方向为海洋生物活性物质。E-mail:fanxp08@163.com
*通信作者:吴红棉(1953ü),男,教授,硕士,研究方向为海洋生物活性物质。E-mail:hxwz247@163.com

