一组生物活性多糖对人NK 细胞免疫活性的影响
李 琦,梅其柄,张明杰,黄庆生,*
(1.西北工业大学生命学院,空间生物实验模拟技术重点实验室,陕西 西安 710072;2.西北工业大学生命学院实验中心,陕西 西安 710072)
一组生物活性多糖对人NK 细胞免疫活性的影响
李 琦1,2,梅其柄1,张明杰1,黄庆生1,*
(1.西北工业大学生命学院,空间生物实验模拟技术重点实验室,陕西 西安 710072;2.西北工业大学生命学院实验中心,陕西 西安 710072)
目的:探讨体外环境中灰树花、香菇、灵芝、枸杞多糖和酵母葡聚糖对人自然杀伤(NK)细胞的形态、增殖、细胞毒活性和IFN-γ分泌水平的影响。方法:采用经体外扩增的高纯度人NK细胞为模型,将5种多糖以100mg/L和50mg/L两个质量浓度组分别对其作用72h后检测NK细胞的形态、增殖、细胞毒活性和IFN-γ分泌水平。结果:经过多糖处理后的NK细胞增殖情况与对照组相比并未发生明显改变,但细胞形态有一定的变化,且细胞毒活性和IFN-γ分泌水平有所提高。其中100mg/L和50mg/L的灵芝多糖处理能将NK细胞毒活性分别提高5.89%和9.1%(P<0.05),且50mg/L的灰树花多糖和枸杞多糖也能将NK细胞毒活性分别提高5.7%和6.9%(P<0.05)。另外50mg/L的灰树花多糖与香菇多糖处理能将NK细胞IFN-γ的分泌水平分别提高255pg/mL和202pg/mL(P<0.05)。结论: 灰树花、灵芝和枸杞多糖在体外实验中能在一定程度上提高NK细胞的细胞毒活性,但这种作用并不是通过促进细胞增殖实现的。另外灰树花和香菇多糖也能通过促进NK细胞对IFN-γ的分泌,影响NK细胞的免疫调节功能。
人NK细胞;多糖;细胞毒活性;IFN-γ
多糖是醛糖或(和)酮糖通过糖苷键链接在一起的多聚物,广泛存在于动物细胞膜和植物、真菌的细胞壁中,其中食(药)用多糖被称为生物应答效应物(biological response modifier,BRM),是能够增强人体免疫功能的生物活性物质。近年来,食(药)用多糖的结构、功能、生物活性、作用靶点等得到国内外学者的广泛研究,成为分子生物学、医学、食品科学等领域的研究热点之一。灰树花(Grifola frondosa)又名舞茸,是新近开发的一种食药两用菌,灰树花多糖(Grifola frondosa polysaccharide,GFP),是从灰树花菌的子实体或菌丝体中分离得到的一类富含β-1, 6-及β-1,3-糖苷键的真菌多糖,具有显著的防癌抗癌,提高免疫力之功效[1]。香菇(Lentinula edodes)是传统食用菌,香菇多糖(lentinan,LNT)是从香菇的子实体中分离得到的具β- 1, 6-支链和β-1,3-支链的β-1,3葡聚糖,分子式为(C6H10O5)n,具有刺激干扰素(interferon,IFN)形成、抗病毒和抗肿瘤等功能[2]。灵芝(Ganoderma lucidum)是著名的药用真菌,灵芝多糖(Ganoderma lucidum polysaccharide,GLP) 结构中单糖之间的连接方式,主链以β-1,3-、β-1,4-糖苷键连接,支链以β-1,6-糖苷键连接。现代药理学研究认为GLP具有较强的提高免疫力和抗肿瘤的作用[3-4]。枸杞(Lycium chinense Miller)是我国传统名贵中药,其提取物枸杞多糖(Lycium barbarum polysaccharide,LBP)是由阿拉伯糖、鼠李糖、葡萄糖等6种多糖组成的杂多糖同多肽或蛋白质构成的复合多糖,其糖链呈多分枝的复杂结构,具有增强免疫力、防衰老、增强造血功能、防止遗传损伤等作用[5]。酵母葡聚糖(yeast glucan,YG)的主要成分是β-1,3-D-葡聚糖,约占酵母细胞壁干质量的20%。YG是一种极富生物活性的多糖,它表现出很强的刺激免疫力、抗肿瘤、抗病毒、抗辐射等活性和降血糖降血脂等多种功效[6]。上述5种多糖具有突出的提高免疫力和抗肿瘤等生物活性,近年来得到广泛关注,相关研究和应用成果层出不穷。
自然杀伤(nature killer,NK)细胞是一种大颗粒淋巴细胞,无需预先致敏和抗体参与即可识别和杀灭肿瘤细胞、病毒感染细胞和较大的病原体(如真菌和寄生虫),并能分泌IFN-γ等可溶性细胞因子,通过活化中性粒细胞、巨噬细胞和树突状细胞触发特异性免疫应答[7]。NK细胞在肿瘤的发生和发展过程中具有重要的免疫监控作用,也是人体抵御外来微生物入侵的第一道防线。因此,寻找和开发能够提高NK细胞免疫活性的因子或药物有着重要的理论与实践意义。
考虑到NK细胞在人体非特异和特异性免疫过程中所起的重要作用,上述5种多糖在发挥提高免疫力和抗肿瘤等功效时是否涉及对NK细胞功能的影响就成为一个有趣的问题。本研究通过体外实验,检测了GFP、LNT、GLP、LBP和YG对NK细胞的形态、增殖、细胞毒活性及IFN-γ分泌水平的影响,以期找寻其中能够上调NK细胞免疫活性的成分,为多糖的深入开发提供理论依据。
1 材料与方法
1.1 材料与试剂
人外周抗凝血分别来自8位健康献血者(男3人,女5人)其中年龄最大49岁,最小25岁,平均年龄33岁;K562细胞株(人髓源白血病细胞株,CCTCC编号:GDC037)购于中国典型培养物保藏中心;K562D3工程细胞株,由本研究室构建(采用基因工程的方法,在K562细胞株上同时表达IL-15、IL-18和4-1BBL基因,用于NK细胞的体外扩增,详见文献[8])。
GFP、LNT、GLP、LBP(纯度均≥60%) 浙江方格药业有限公司;羧甲基化的酵母葡聚糖(纯度≥99%)珠海天添生物工程技术有限公司;RPMI-1640完全培养基 美国Gibco公司;小牛血清 杭州四季青公司;淋巴细胞分离液 上海华精生物高科技有限公司;cell counting Kit-8 活细胞计数试剂盒 日本Dojindo公司;IL-2 美国Peprotech公司;人IFN-γ ELISA检测试剂盒美国R&D公司;抗人CD56-PE、CD3-FITC特异性抗体及同型对照 美国BD Biosciences公司;其他常用试剂均为分析纯。
1.2 仪器与设备
二氧化碳培养箱 美国Thermo公司;倒置显微镜重庆光学仪器厂;超净工作台 苏州净化设备厂;TD5A-WS大容量台式低速离心机 上海卢湘仪离心机仪器有限公司;多功能酶标仪 美国BioTek公司;高压灭菌设备 日本三洋电机公司;BD FACSCalibur流式细胞仪 美国BD公司。
1.3 方法
1.3.1 NK细胞的扩增培养
新鲜抽取的人外周抗凝血,用淋巴细胞分离液分离外周血单核细胞(peripheral blood mononuclear cell,PBMC),灭菌PBS洗3次,用含10% FBS和1h106U/L可溶性IL-2的RPMI-1640培养液将细胞悬浮,加入6孔板中,每孔约1h107个细胞。随后每孔加入经γ射线照射灭活的K562D3细胞1h107个,37℃、5% CO2培养箱培养。从培养的第2周起每2d对培养孔中的液体进行半换液。培养21d后收获细胞,取其中少量细胞进行流式分析,确定其中CD56+CD3—(NK)细胞的比例(NK细胞扩增方法详见文献[8])。
1.3.2 5种多糖的处理
5种多糖分别用RPMI-1640无血清培养基配成质量浓度为10g/L和5g/L的100h储存液,一次性滤器过滤除菌。将扩增培养好的NK细胞取出,灭菌PBS洗3遍,用含10% FBS、不含IL-2的RPMI-1640培养基重悬(为了摒除IL-2对NK细胞的影响,除扩增用培养基外,所有实验用1640培养基均不含IL-2),调整细胞密度为2h107个/mL。使用24孔板,每孔中加入1mL细胞悬液,再加入1%体积的多糖溶液,使各种多糖的终质量浓度分别为100mg/L和50mg/L,每次实验均设不含任何多糖的阴性对照组。将所有细胞于37℃、5% CO2培养箱中培养72h。
1.3.3 NK细胞增殖情况检测
将多糖处理后的各组NK细胞悬液充分混匀,每组取出100μL (约2h106个细胞)加入1.5mL EP管并离心,用灭菌PBS洗2次后重新加入新培养基200μL充分混匀。使用96孔板,将每个EP管中的200μL细胞悬液加入96孔板中,每孔再加入20μL cell-counting试剂,37℃、5% CO2培养箱中培养2h,于450nm波长处测定吸光度(A),比较实验组与空白对照组的A450nm。
1.3.4 NK细胞杀伤率检测
将多糖处理后各孔剩余NK细胞分别取出离心,收集上清备用,离心下来的细胞用灭菌PBS洗2次,活细胞计数。NK细胞的细胞毒活性以NK细胞对K562细胞的杀伤率表示:使用96孔板,每个反应孔加入2h106个NK细胞和4h105个K562细胞,使NK细胞:K562细胞(效靶比) = 5:1(每个反应孔重复3次),并设单独的NK细胞孔和单独K562细胞孔。将每孔的培养基体积补至200μL。细胞加好后于37℃、5% CO2培养箱培养4h后取出,每孔再加入20μL cell-counting试剂,继续培养2h,450nm波长处测定吸光度(A),计算NK细胞的杀伤率。
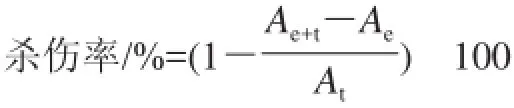
式中:Ae为NK细胞孔的吸光度;At为K562细胞孔的吸光度;Ae+t为NK细胞+K562细胞孔的吸光度。
1.3.5 NK细胞IFN-γ分泌水平检测
将前面收集的各实验组NK细胞培养上清液取出,按照人IFN-γ ELISA试剂盒说明书上的步骤测定上清液中IFN-γ的含量。将标准品吸光度用Curve Expert软件作出曲线,利用曲线将实验组吸光度换算成IFN-γ的质量浓度值。比较实验组与空白对照组IFN-γ的质量浓度。
1.3.6 NK细胞的形态学变化
获得多糖处理前后NK细胞的光镜照片,并观察NK细胞形态变化。
1.3.7 统计学方法
2 结果与分析
2.1 扩增培养后NK细胞的纯度
流式分析结果(图1,举例说明)显示,经体外扩增培养21d后,NK (CD56+CD3—)细胞占细胞总数的平均值为(96.67f3.54)% (n=4),说明PBMC中的其他细胞经过21d的体外培养已基本死亡,所获得的NK细胞纯度能够达到实验要求。
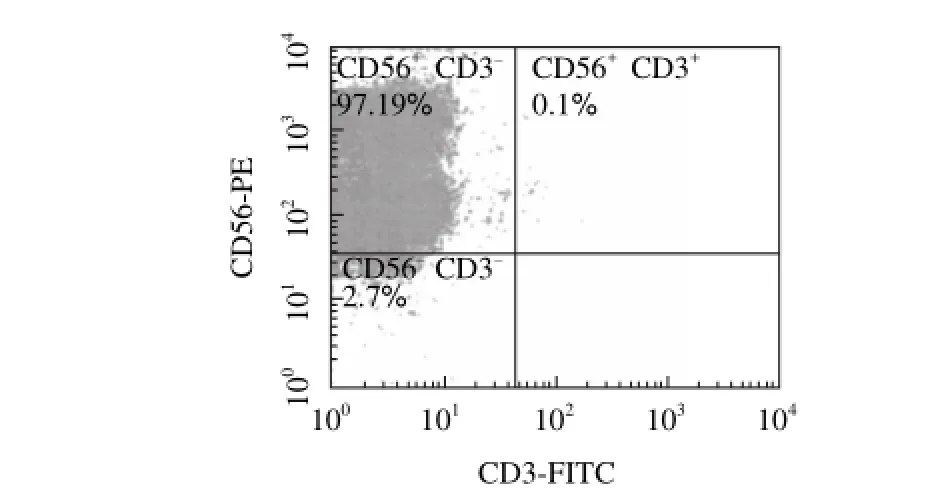
图 1 扩增后的PBMC流式分析结果Fig.1 Flow cytometry analysis of PBMCs after expansion
2.2 5种多糖对NK细胞增殖的影响
表 1 5种多糖处理后NK细胞的吸光度(±s,n=8)Table 1 Effect of fi ve polysaccharides on the proliferation of NK cells±s,n=8)
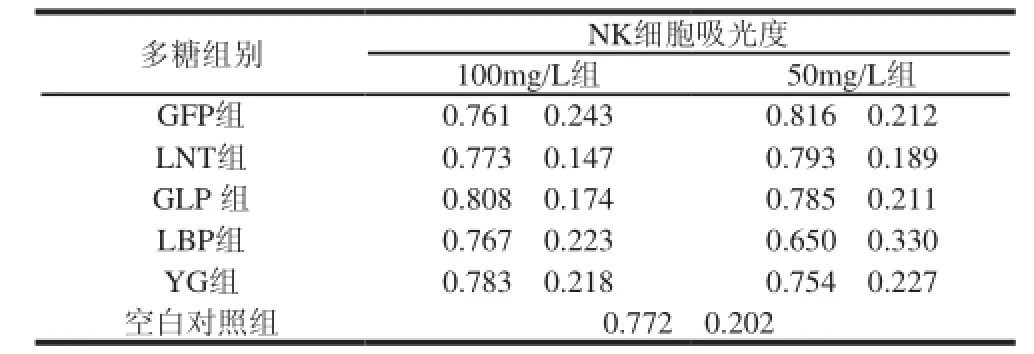
表 1 5种多糖处理后NK细胞的吸光度(±s,n=8)Table 1 Effect of fi ve polysaccharides on the proliferation of NK cells±s,n=8)
多糖组别NK细胞吸光度100mg/L组50mg/L组GFP组0.761f0.2430.816f0.212 LNT组0.773f0.1470.793f0.189 GLP 组0.808f0.1740.785f0.211 LBP组0.767f0.2230.650f0.330 YG组0.783f0.2180.754f0.227空白对照组0.772f0.202
由表1可见,在5种多糖100mg/L和50mg/L 两种质量浓度条件下分别处理72h后,NK细胞的吸光度与空白对照组相比并没有明显的差异(P>0.05)。由此可知,两种质量浓度的多糖体外处理不会对NK细胞产生明显的促进增殖或毒性作用。
2.3 5种多糖对NK细胞毒活性的影响
表 2 5种多糖处理后NK细胞的杀伤率(±s, n=8)Table 2 Effect of fi ve polysaccharides on the cytotoxicity of NK cells (±s,n=8)
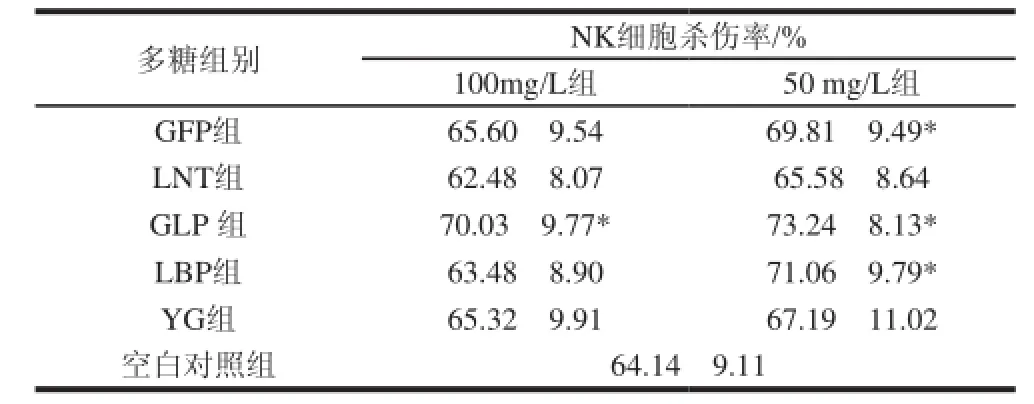
表 2 5种多糖处理后NK细胞的杀伤率(±s, n=8)Table 2 Effect of fi ve polysaccharides on the cytotoxicity of NK cells (±s,n=8)
注:*.与空白对照组比较有显著性差异(P<0.05)。下同。
多糖组别NK细胞杀伤率/% 100mg/L组50 mg/L组GFP组65.60f9.5469.81f9.49* LNT组62.48f8.0765.58f8.64 GLP 组70.03f9.77*73.24f8.13* LBP组63.48f8.9071.06f9.79* YG组65.32f9.9167.19f11.02空白对照组64.14f9.11
由表2可见,经过72h的处理,100mg/L和50mg/L的GLP、50mg/L的GFP和LBP对NK细胞的细胞毒活性有一定的增强作用(P<0.05)。其中50mg/L和100mg/L的GLP能将NK细胞毒活性分别提高9.1%和5.89%,50mg/L的GFP和LBP能将NK细胞毒活性分别提高5.7%和6.9%(P<0.05) 。
2.4 5种多糖对IFN-γ分泌水平的影响
由表3可见,经过72h的处理,50mg/L的GFP和LNT能将NK细胞的IFN-γ分泌水平分别上调255pg/mL和202pg/mL(P<0.05),对其免疫活性有一定的增强作用。
表 3 5种多糖处理后NK细胞的IFN-γ分泌水平(±s,n=8)Table 3 Effect of fi ve polysaccharides on the IFN-γsecretion of NK cells (s,n=8)
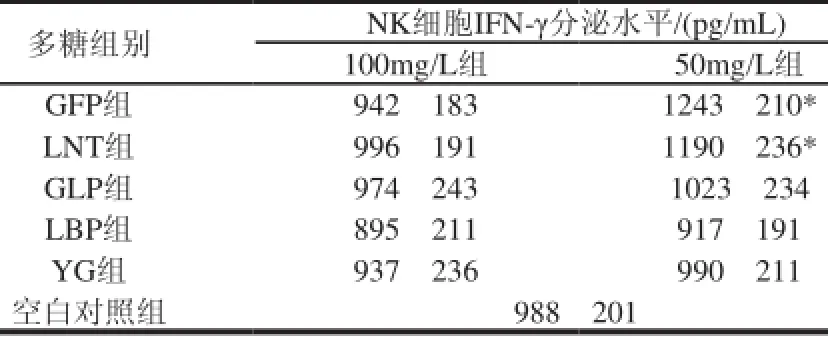
表 3 5种多糖处理后NK细胞的IFN-γ分泌水平(±s,n=8)Table 3 Effect of fi ve polysaccharides on the IFN-γsecretion of NK cells (s,n=8)
多糖组别NK细胞IFN-γ分泌水平/(pg/mL) 100mg/L组50mg/L组GFP组942f1831243f210* LNT组996f1911190f236* GLP组974f2431023f234 LBP组895f211917f191 YG组937f236990f211空白对照组988f201
2.5 多糖处理前后NK细胞形态的变化
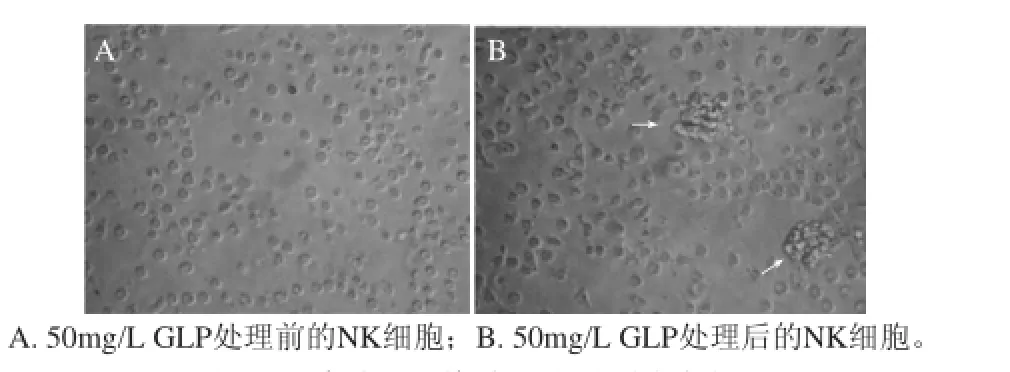
图 2 多糖处理前后NK细胞形态变化Fig.2 Morphological changes of NK cells after treatment with 50 mg/L Ganoderma lucidum polysaccharide
由图2A可知,较之未经处理的NK细胞,经过50mg/L GLP 处理72h后,NK细胞显得更加饱满,体积稍有增大,细胞聚团现象增多(图2B箭头所示),说明细胞活性有所增强。
3 讨 论
多种因子可通过调节NK细胞介导的非特异性杀伤作用影响人体的免疫功能。为了寻找能提高NK细胞活性的多糖种类,本实验选取了5种经研究证实具有明显抗肿瘤和提高人体免疫力等生物活性的多糖成分,检测了它们在体外实验中对人NK细胞的形态、增殖、细胞毒活性和IFN-γ分泌水平的影响。通过参考文献[9],将多糖的质量浓度设为100mg/L和50mg/L两个剂量组。结果发现,5种多糖中提高NK细胞毒活性效果最好的是GLP,其在两个剂量时都能明显提高NK细胞对K562细胞的杀伤率,但在质量浓度为50mg/L时效果更好。而50mg/L的GFP和LBP也显示出较明显的提高NK细胞毒活性的效果。但对应的100mg/L质量浓度却无此效果,说明50mg/L是较适宜的多糖处理剂量,更高的质量浓度反而会削弱多糖对NK细胞毒活性的增强作用。同时,50mg/L GFP和LNT能在一定程度上增加NK细胞对IFN-γ的分泌水平从而提高NK细胞的免疫活性。通过检测NK细胞的增殖情况可以看出,多糖对NK细胞毒活性的增强作用并不是通过促进NK细胞的增殖而达到的。说明多糖可能通过影响NK细胞的其他生理指标来提高它的细胞毒活性。
本实验所采用的5种多糖中,灰树花多糖、香菇多糖、灵芝多糖和酵母葡聚糖这4种多糖中均具有β-1,6-及β-1,3-糖苷键,而枸杞多糖是一种复合的蛋白多糖,其中也具有β-糖苷键结构。说明β-1,6-及β-1,3-糖苷键可能是影响NK细胞免疫活性的重要结构。而实验中发现,除酵母葡聚糖外,其他4种多糖均能对NK细胞免疫活性产生影响,或能直接提高NK细胞对靶细胞的细胞毒活性,或能提高NK细胞IFN-γ的分泌水平。暗示了此种对NK细胞免疫活性的刺激作用在生物活性类多糖中可能是广泛存在的。由于酵母葡聚糖难溶于水,所以本实验中采用了可溶于水的羧甲基化酵母葡聚糖,但未发现对NK细胞免疫活性的影响,或许羧甲基化的处理会影响酵母葡聚糖的生物活性。
近年来,人们对多糖生物活性的认识逐渐增加,总结前人的研究结果发现多糖具有明显的提高生物免疫力和抗肿瘤的活性,主要表现为:1)直接抑制肿瘤细胞的生长。2)提高T、B淋巴细胞的增殖能力和活性。3)增加巨噬细胞的吞噬能力等[10-13]。有关多糖对NK细胞功能影响,Yuki等[14]研究发现灰树花多糖中的有效成分MD-Fraction能促进小鼠NK细胞的细胞毒活性,抑制肿瘤的生长。Rafique等[15]认为香菇多糖能够减缓化疗对小鼠肝脏NK细胞活性的破坏作用。目前以人NK细胞为研究对象的相关文献还较少,本实验以NK细胞体外扩增技术为平台,初步研究了5种多糖对NK细胞功能的影响,找出了其中能够上调NK细胞毒活性的成分与合适的处理质量浓度。此结果暗示了多糖亦能够通过提高NK对肿瘤细胞的细胞毒作用和对IFN-γ的分泌水平而起到增强免疫力和抗肿瘤的效果。下一步的工作当瞄准多糖影响NK细胞活性的机理进行深入研究,以进一步明确多糖的作用机理与靶标,为开发更具针对性的免疫增强药物提供依据。
[1] KIM J H, BAE J T, SONG M H, et al. Biological activities of Fructus arctii fermented with the basidiomycete Grifola frondosa[J]. Arch Pharm Res, 2010, 33(12): 1943-1951.
[2] 林楠, 钟耀广, 王淑琴, 等. 香菇多糖的研究进展[J]. 食品研究与开发, 2007, 28(5): 174-176.
[3] 乔英, 董学畅, 邱明华, 等. 灵芝多糖的研究概况[J]. 云南民族大学学报, 2006, 15(2): 134-137.
[4] 毛健, 马海乐. 灵芝多糖的研究进展[J]. 食品科学, 2010, 31(1): 295-299.
[5] 王奇, 张晓丹, 张静蕾, 等. 枸杞多糖研究进展[J]. 食品研究与开发, 2009, 30(10): 150-152.
[6] 郭永, 王振伟. 酵母β-葡聚糖的生物活性及开发利用[J]. 中国食物与营养, 2010(9): 24-26.
[7] RAULET D H. Missing self recognition and self tolerance of natural killer (NK) cells[J]. Semin Immunol, 2006, 18(3): 145-150.
[8] 黄庆生, 李琦, 黄勇, 等. 人NK细胞体外高效扩增的实验研究[J]. 细胞与分子免疫学杂志, 2008, 24(12): 1167-1169.
[9] 邓旻, 窦晓兵, 史亦谦, 等. 黄芪多糖体外诱导脐血单核细胞分化为树突状细胞及其免疫学特征[J]. 医学研究杂志, 2006, 35(9): 22-26.
[10] 梁淑轩, 马二红, 许成燕, 等. 枸杞多糖的硒化及其对人宫颈癌细胞的抑制作用[J]. 食品科学, 2010, 31(9): 243-246.
[11] MAYELl M. Maitake extracts and their therapeutic potential[J]. Altern Med Rev, 2001, 6(1): 48-60.
[12] HAMURO J. Anticancer immunotherapy with perorally effective lentinan[J]. Gan to Kagaku Ryoho, 2005, 32(8): 1209-1215.
[13] XU Zengtao, CHEN Xiuping, ZHONG Zhangfeng, et al. Ganoderma lucidum polysaccharides: immunomodulation and potential anti-tumor activities[J]. Am J Chin Med, 2011, 39(1): 15-27.
[14] YUKI M, YUKIHITO M, MASAHIKO H, et al. Inhibitory effect of MD-Fraction on tumor metastasis: involvement of NK cell activation and suppression of intercellular adhesion molecule (ICAM)-1 expression in lung vascular endothelial cells[J]. Biol Pharm Bull, 2008, 31(6): 1104-1108.
[15] RAFIQUE M, ADACHI W. Effects of intraportal administration of chemoimmunothrapeutic agents on natural killer cell activity in the rat liver[J]. J Surg Oncol, 1995, 60(3): 154-159.
Effects of Bioactive Polysaccharides on Immunocompetence of Human NK Cells
LI Qi1,2,MEI Qi-bing1,ZHANG Ming-jie1,HUANG Qing-sheng1,*
(1. Key Laboratory for Space Bioscience and Biotechnology, School of Life Sciences, Northwestern Polytechnical University, Xiÿ an 710072, China;2. The Central Laboratory, School of Life Sciences, Northwestern Polytechnical University, Xiÿ an 710072, China)
Objective: To determine the effects of Grifola frondosa polysaccharide, lentinan, Ganoderma lucidum polysaccharide, Lycium barbarum polysaccharide and yeast glucan on the morphology, proliferation, cytotoxicity and IFN-γ secretion of human NK cells. Methods: Pure human NK cells, prepared by PBMC based ex vivo expansion, were treated with each polysaccharide at concentrations of 100 mg/L and 50 mg/L, respectively. The proliferation, cytotoxicity and IFN-γ secretion of NK cells were tested after 72 h treatments. Results: No signif i cant changes in the proliferation of NK cells were observed between polysaccharide treatment groups and control group. However, increased cytotoxicity of NK cells could be observed for four polysaccharide treatment groups and some changes in cell morphology were also detected. The cytotoxicity of NK cells increased by 5.89% and 9.1% (P<0.05) after treatment with 100 mg/L and 50 mg/L of Ganoderma lucidum polysaccharide, and increased by 5.7% and 6.9% (P<0.05) after treatment with 50 mg/L of Grifola frondosa polysaccharide and Lycium barbarum polysaccharide, respectively. In addition, the IFN-γ secretion of NK cells increased by 255 pg/mL and 202 pg/mL (P<0.05) separately after treatment with 50 mg/L of Grifola frondosa polysaccharide and lentinan. Conclusion: Grifola frondosa polysaccharide, Ganoderma lucidum polysaccharide and Lycium barbarum polysaccharide enhances the cytotoxicity of NK cells, but not by promoting its proliferation. Grifola frondosa polysaccharide and lentinan promote the IFN-γ secretion to a certain extent in vitro and thus have immunoregulatory effects on NK cells.
human NK cells;polysaccharide;cytotoxicity;IFN-γ
TS201.2
A
1002-6630(2013)01-0315-04
2011-10-06
李琦(1981ü),女,实验师,硕士,研究方向为细胞免疫学。E-mail:caddie_liqi@126.com
*通信作者:黄庆生(1963ü),男,副教授,博士,研究方向为细胞免疫学。E-mail:qingshengh@yahoo.com.cn

