虾类过敏原及消减方法研究进展
胡志和
(天津市食品生物技术重点实验室,天津商业大学生物技术与食品科学学院,天津 300134)
虾类过敏原及消减方法研究进展
胡志和
(天津市食品生物技术重点实验室,天津商业大学生物技术与食品科学学院,天津 300134)
虾及其制品味道鲜美,营养丰富,但却具有较高的致敏性。本文综述国内外有关虾类主要过敏原üü原肌球蛋白的结构、表位预测与定位、变态反应原性检测及脱敏方法等方面的研究进展,为进一步研究虾类过敏原及其消减技术提供一定的参考。
海虾;过敏原;原肌球蛋白;过敏反应原性
自古以来,海洋一直是人类食物的主要来源之一,海洋食品是由各种海洋有机体构成的,但人类对它们中的多数产生过敏。虾及其制品味道鲜美,营养丰富,越来越受到消费者的喜爱,是百姓餐桌上常见的水产品。然而,虾及其制品却具有致敏性,约有20%的过敏病人对虾过敏,小儿发病率高达60%,严重影响了患者的生活质量。因此,学者们针对虾的过敏物质展开了一系列的研究。本文针对目前国内外有关虾类主要过敏原üü原肌球蛋白的结构、表位预测与定位、过敏反应原性检测及脱敏方法等方面的研究进展进行综述。
1 虾类原肌球蛋白结构及表位
虾中存在的过敏原种类比较多,但目前为止研究比较清楚的是其主要过敏原Pen a 1和Pen c 1,二者都来源于肌肉组织中的原肌球蛋白。
1993年,Shanti等[1]以印度对虾为原料研究确定原肌球蛋白是其主要过敏原,并对其IgE的结合表位特性进行鉴定,结果显示其分子质量为34kD,等电点为4.8~5.4,IgE结合表位为肽链的50~66和153~161片段。1994年,Daul等[2]以褐对虾(Penaeus aztecus)为原料研究确定了该虾的主要过敏原也是原肌球蛋白,其分子质量为36kD,并将其命名为Pena1。同年,Leung等[3]对刀额新对虾(Metapenaeus ensis)的原肌球蛋白进行克隆表达,并进行氨基酸测序,结果显示,该虾的原肌球蛋白有281个氨基酸残基,分子质量为34kD。此后研究发现,原肌球蛋白不仅是虾的主要过敏原,同时也是龙虾和蟹类等甲壳类水产品的主要过敏原[4-6]。因此,各国研究者对不同虾类原肌球蛋白的基因克隆与序列分析、重组表达与致敏性及交叉反应分析、致敏原因分析、脱敏和检测等方面进行了研究。2006年,Reese等[7]提取褐对虾(Penaeus aztecus)的过敏原蛋白并进行克隆表达,对天然和重组后的过敏原蛋白的分子二级结构和免疫学参数进行研究,结果显示天然和重组后的蛋白具有а-螺旋构象,为典型的原肌球蛋白,由284个氨基酸残基组成。2008年,Nakano等[8]对2种磷虾(Euphausia superba和E. pacifica)的原肌球蛋白和变态反应原性进行研究,发现2种磷虾的原肌球蛋白由284个氨基酸残基组成,分子质量为38kD,与龙虾和螃蟹的原肌球蛋白显著一致。2007年,Motoyama等[9]研究发现6种甲壳类水产(black tiger prawn、kuruma prawn、pink shrimp、king crab、snow crab、horsehair crab)的原肌球蛋白为主要过敏原,并对不同品种和不同部位的原肌球蛋白的氨基酸序列进行分析,发现快速和舒缓原肌球蛋白的氨基酸序列具有90%的一致性。2008年,Motoyama等[10]比较了南极磷虾(Euphausia superb)和虾蛄的原肌球蛋白,发现二者的氨基酸序列有82.4%~89.8%的一致性,均具有变态反应原性,但虾蛄中原肌球蛋白含量很低。除了原肌球蛋白以外,2008年,Ayuso等[11]研究发现,虾的肌球蛋白轻链是一种新的过敏原,并将其命名为Lit v 3。
对于水产品中甲壳纲动物和软体动物之间的过敏原的相关性,2007年,Suma等[12]研究了2种十足类动物(American lobster Homarus americanus and black tiger prawn Penaeus monodon)和2种藤壶(acorn barnacle Balanus rostratus and goose barnacle Capitulum mitella)的原肌球蛋白的变态反应原性,证明2种原肌球蛋白具有交叉反应,但氨基酸序列的一致性较低,通过重组DNA克隆发现,藤壶的原肌球蛋白与鲍鱼具有高度的一致性,应属于软体动物家族。2009年,Emoto等[13]研究了4种腹足动物(disc abalone、turban shell、whelk、Middendorf’s buccinum)和6种双贝类动物(bloody cockle、Japanese oyster、Japanese cockle、surf clam、horse clam、razor clam、shortneckclam),发现原肌球蛋白是主要过敏原,且彼此间具有交叉反应;通过对各自的原肌球蛋白氨基酸序列分析,发现同类间具有高度一致性,而软体动物与甲壳纲动物之间的原肌球蛋白的氨基酸序列只有60%左右的一致性。由此可见,对于水产品中甲壳类动物和软体动物,其主要过敏原均为原肌球蛋白,但在氨基酸序列方面存在差异。
国内有关虾原肌球蛋白的研究,在1964年,龚祖埙等[14]对虾的原肌球蛋白进行提取并进行结构观察。针对其过敏性的研究起步较晚,李振兴[15]对凡纳滨对虾(Pneaeus vannamei)的过敏原蛋白进行分离纯化,并鉴定为原肌球蛋白,分子质量为36kD。王晓斐[16]对中国对虾的主要过敏原进行分离鉴定,将其命名为Pen c 1,该过敏原含有1个糖链,分子质量为36kD,其二级结构为а-螺旋。杜欣军等[17]对凡纳滨对虾原肌球蛋白基因表达模式与重组表达进行研究,确定其原肌球蛋白分子质量为38.2kD。詹政科等[18]进行了口虾蛄原肌球蛋白基因表达及变应原性鉴定的研究,证明其原肌球蛋白分子质量为36kD,且具有良好的IgE结合活性。黄建芳[19]进行了河虾主要过敏原单克隆抗体的制备及河虾过敏原不同组分共同表位分析,结果显示,河虾中至少存在9种过敏原组分,21、36、80kD等3种蛋白组分为河虾的主要过敏原组分,其中以36kD过敏原组分致敏率和致敏性最强。河虾21、36kD的过敏原组分之间具有共同过敏原表位,河虾、海虾和蟹的过敏原之间具有交叉反应,河虾36kD的原肌球蛋白与海虾的原肌球蛋白及蟹的26、36、70kD的蛋白组分具有共同表位。吴海明等[20]对凡纳滨对虾、中国明对虾、刀额新对虾以及虾蛄4种海虾的过敏原进行鉴别,发现凡纳滨对虾的主要过敏原为99、33、19、14kD的蛋白质;中国明对虾的主要过敏原为39、33、28kD的蛋白质;刀额新对虾的主要过敏原为33、24kD的蛋白质;虾蛄的主要过敏原为56、48kD的蛋白。因此,分子质量为33kD的蛋白组分是前三者所共有的过敏原,而虾蛄的则无共同分子质量的过敏原。郑礼娜[21]对刀额新对虾的过敏原指纹图谱进行分析,确定其过敏原为分子质量36kD的原肌球蛋白,利用生物信息学方法对虾过敏原及其他甲壳类过敏原之间的同源性进行分析,发现甲壳类过敏原-原肌球蛋白氨基酸序列之间同源性很高。易海涛等[22]对克氏原螯虾主要变应原原肌球蛋白的一个片段区基因的克隆表达、纯化及免疫原性鉴定。周向红等[23]进行了中国明对虾主要过敏原基因分子克隆与序列分析,证明其原肌球蛋白的分子质量为32.8kD,由284个氨基酸残基组成。
上述研究表明,原肌球蛋白是甲壳纲动物的主要过敏原,但不同亚类间原肌球蛋白的氨基酸序列存在一定差异。因此,在过敏原的研究过程中,要注意不同虾类的亚种之间的差异。
2 表位预测与定位及过敏反应原性检测
2.1 表位预测与定位
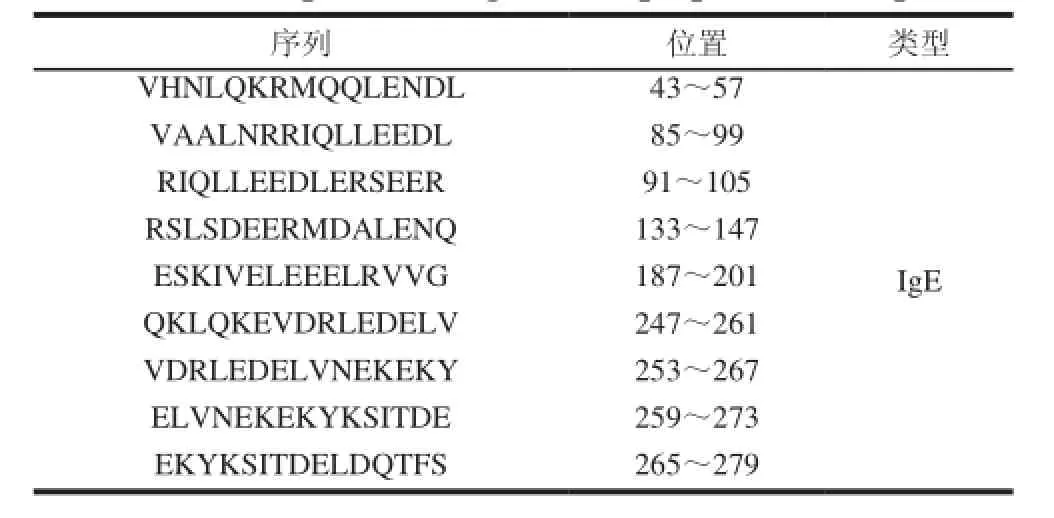
表 1 虾过敏原的线性表位肽段Table 1 Peptides of allergen linear epitopes from shrimps
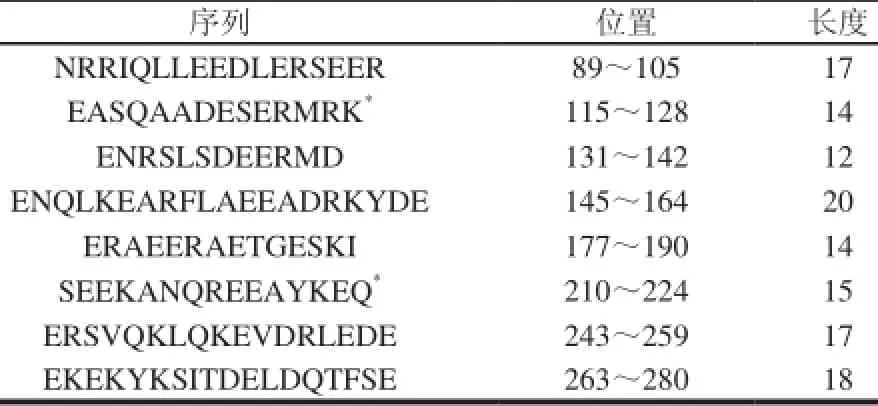
表 2 刀额新对虾线性表位[21]Table 2 Allergen linear epitopes from Metapenaeus ensis[21]
表位预测与定位方法主要有酶解、肽扫描、噬菌体展示、质谱、表面等离子共振、蛋白芯片和核磁共振技术等[24]。酶解和肽谱扫描技术相对传统,有特异性差、费时和昂贵等缺点;而噬菌体展示、质谱、表面等离子共振、蛋白芯片、核磁共振技术相比于传统的技术在灵敏度、样品用量、分析速度等方面都有一定的优势。目前,研究确定的虾过敏原表位共有9个肽段,见表1[16]。另外,郑礼娜[21]采用DNAstar、AntheProt等生物信息学软件分析刀额新对虾的Pen a 1的二级结构、亲水性、溶剂可及性、可塑性、抗原指数等多个性质,间接预测线性表位区域,并结合2个在线网站对表位的预测结果进行筛选,发现8个表位,其中有2个新的表位(表2)。并指出Pen a 1 空间结构比较简单,没有复杂的三、四级结构,二级结构主要以α-螺旋为主。
2.2 过敏反应原性检测
在过敏反应原性检测方法的研究方面,李振兴[15]以鼠源抗体为捕获抗体,胶体金标记的兔源抗体为检测抗体,制备了虾过敏原蛋白检测的免疫渗滤试剂盒,检测限达到250ng/mL,检测时间在15min之内。刘光明等[25]进行了虾类过敏原的识别纯化和检测技术研究,建立了虾原肌球蛋白的酶联免疫吸附测定方法。张轶群[26]采用蛋白质芯片技术建立了过敏原检测的技术体系,其芯片检测南美白对虾过敏原检测限为20ng/mL,线性检测范围为0.02~20.0μg/mL;杂色蛤过敏原检测限为40ng/mL,线性检测范围为0.04~40.0μg/mL。鲅鱼过敏原检测限为20ng/mL,线性检测范围为0.02~20.0μg/mL。王丽娟等[27]以豚鼠为实验动物,建立了虾过敏实验的动物模型,为过敏原消减效果的体内检测提供依据。
3 虾类过敏原的消减方法
目前,国内外普遍采用的方法包括物理法(加热、辐照、微波、超高压)、化学法和生物法(酶解法、基因改良法)等。
3.1 加热、辐照、微波技术在过敏原消减中的应用
由于虾的原肌球蛋白对热稳定,因此,较少采用热加工消减其过敏反应原性,但加热对其他来源的过敏原反应原性的影响均有报道。Yu Huilin等[28]以青蟹(Scylla paramamosain)为原料,采用煮沸加热、超声波与煮沸加热、高压蒸汽加热等方法处理,研究对其主要过敏原蛋白(原肌球蛋白)的可消化性的影响,研究发现,3种方法中的高压蒸汽加热能够较好地促进过敏原的消化。Husband等[29]研究了热和高压对苹果的2个主要过敏原(Mal d1、Mal d 3)及Bet v 1(类似芹菜中过敏原Api g 1)的影响,发现芹菜中过敏原Api g 1的免疫反应活性可通过加热或提高压力而被减小。Tong Ping等[30]研究了加热诱导卵转铁蛋白潜在变态反应原性和结构的变化,结果显示热处理卵转铁蛋白引起的构象变化,显著影响了其变态反应原性。
辐照对虾过敏原消减的研究方面,李振兴[15,31]、顾可飞[32]等的研究结果表明,辐照可以导致虾过敏原蛋白免疫活性的变化,当辐照剂量低于10kGy时,处理的虾抽提物和虾肉的免疫活性有稍微增加;当辐照剂量大于10kGy时,虾过敏原蛋白的免疫活性下降。但辐照会引起剂量残留,从而对消费者产生不良影响。微波-超声波对虾过敏原的影响,根据董晓颖等[33]和李振兴[15]结果表明,微波-超声波处理虽然不会改变虾过敏原的分子质量,但其致敏性有所降低。
3.2 化学法及酶法在过敏原消减中的应用
化学法对过敏原消减的研究中,可采用强酸(盐酸)水解过敏原蛋白,使之完全降解为氨基酸。另外,也可采用美拉德反应,使糖和蛋白质反应生成糖和蛋白质的复合物,通过化学修饰改变蛋白质的变应原性,有学者[34-35]将该方法用于大豆过敏原的消减实验,李庆丽等[36]采用麦芽糖、葡萄糖等与虾过敏原进行美拉德反应,研究美拉德反应对虾过敏原免疫活性的影响。结果表明,不同的还原糖对虾过敏原免疫活性的影响不同,葡萄糖使虾过敏原免疫活性降低约10%,麦芽糖能够使虾过敏原的免疫活性降低60%。因此,在合适的条件下,美拉德反应能够有效降低虾过敏原的免疫活性。
在虾类过敏原消减研究中使用最多的方法是蛋白酶水解法。黄园园[37]采用模拟胃肠消化液的方法处理甲壳类原肌球蛋白和鱼类小清蛋白,结果显示,原肌球蛋白能被不同程度地分解,并产生一些降解条带,而小清蛋白则几乎不被分解。刘光明等[38]采用模拟胃肠液体外消化方法消减蟹类原肌球蛋白,较好地降低了其致敏性。吴海明等[39-40]采用胰蛋白酶、菠萝蛋白酶和木瓜蛋白酶分别水解虾蛋白和虾肉,发现3种酶对虾蛋白的致敏性均有较好的消减作用,木瓜蛋白酶的消减效果最好。
3.3 高静压技术在过敏原消减中的应用
静压力是指在一个压力条件下维持一定时间。高静压是指以水压作为压力传递介质,压力范围0.1~10GPa,且受压空间的各个方向的压力相同。该技术在食品加工应用中,一般压力范围在100~1000MPa。研究表明,高静压只对弱键(氢键、离子键、疏水键等)产生影响,对共价键不会产生影响[41]。而这些弱键在维持蛋白质构象稳定性方面起着主要作用,因此,高静压对蛋白质的构象稳定具有很大影响。高压条件下蛋白质的稳定性主要依赖于其构象稳定去代偿弱键相互作用的损失,除此之外,也依赖水分子可渗透的缝隙体积。高压条件下蛋白质结构的转变常常受到蛋白质水合变化的影响,该水合变化伴随着蛋白质的构象转变。这种水合度的变化可以由两个主要作用解释:1)打开缝隙允许溶液占据内部空间,该空间原先没有与这种溶剂发生作用:2)对于伸展蛋白与原蛋白相比,其与溶剂的接触面积增大了[42-43]。众所周知,食物过敏原的二、三级结构对其过敏潜能十分重要。因此,高压处理可以影响其结构,具有减弱或增强食物的变应原性。目前,有些研究者已经开始研究高压处理对一些食品过敏原的影响。根据Kato等[44]研究,大米(Oryza sativa L. Japonica cv. Akitakomachi)浸泡在蒸馏水中,在100~400MPa压力作用下,其变应原蛋白会释放出来,高压释放的蛋白主要是球蛋白Glb33、a-Glb和白蛋白Alb16。Husband等[29]研究了热和高压对苹果的2个主要过敏原(Mal d 1、 Mal d 3)及Bet v 1类似芹菜中过敏原Api g 1的影响。结果显示,尽管Mal d 1对115℃加热10min和高压高温(115℃、10min、700MPa)加工时有一定的抗性,但其结构依然被化学修饰。来源于芹菜的Bet v 1,类似于Api g 1对热和压力都很敏感。通过研究得出结论,高压高温加工是一种有效地减少苹果和芹菜过敏原的变应原性的方法。Peñas等[45]研究了高静压对大豆制品的免疫反应性和营养质量的影响,高压处理(300MPa、15min、40℃)可显著降低大豆的抗原性。
但也有经过高压处理后,虽然结构发生改变,而变态反应原性没有发生变化的情况。例如,Setinova等[46]采用高压(450~550MPa)处理重组桦树花粉过敏原(rBet v1)和桦树花粉提取物。在450MPa条件下30℃处理,rBet v1结构发生最大变化。采用免疫印迹法检测rBet v1和桦树花粉提取物的变态反应。450~550MPa条件下,温度分别30、40、50℃,处理10min,与未处理的样品比较,没有改变rBet v1蛋白和花粉提取物的变态反应原性。
针对原肌球蛋白,谢丹丹等[47-48]提取南美白对虾水溶性蛋白,然后采用超高压法、超高压结合酶法进行处理,发现采用超高压法处理(150MPa、45℃、35min)的产物,过敏原性降低了66.2%;超高压下直接用木瓜蛋白酶处理(300MPa、45℃、35min)的产物,过敏原性降低了91.5%。随后又以虾肉为原料,研究虾肉组分存在对过敏原消减效果的影响,发现采用超高压法处理(200MPa、40℃、35min)处理的产物过敏原性降低了66.1%;超高压条件下直接用木瓜蛋白酶处理(300MPa、40℃、35min)的产物过敏原性降低了91.2%。上述研究结果表明,采用超高压、超高压结合酶法处理,均能降低虾的过敏原性,且后者消减效果更好;另外,当虾肉其他组分存在时,其过敏原性消减条件发生改变,但通过改变作用条件,会达到同样的消减效果。
高静压对原肌球蛋白结构影响的研究方面,乌云娜[49]采用0.1~400MPa的压力处理牛骨骼肌的原肌球蛋白,解压后测定原肌球蛋白的芳香族表面疏水基团、脂肪族表面疏水基团、280nm和295nm激发波长处的荧光强度、光谱质量中心、光散射性、巯基基团含量等的变化,发现压力可引起原肌球蛋白结构的变化,而这些变化可能有一定程度的可逆性。
另外,经过高压处理可增加过敏原的可消化性,从而降低过敏反应。例如,在高压条件下进行酶水解蛋白时,乳清中β-乳球蛋白对胃蛋白酶、胰蛋白酶、胰凝乳蛋白酶、链酶蛋白酶和嗜热菌蛋白酶等更加敏感。其水解物减小了对IgG和人的IgE结合的变态反应原性[50-51]。但该报道没有进行高压对酶活力影响进行对照实验,因此,不能说明上述结果到底是由于高压对β-乳球蛋白的可消化性产生影响,还是高压对相关的酶活产生了影响。因为酶的活性,如特异性蛋白酶,可被压力调节。某些酶的活性随着压力的增加会丧失活性。如在压力为100~400MPa,马肝醇脱氢酶(HLADH)的催化活性急剧降低[52]。相反,如果催化反应诱导的体积是减小的,那么,高压能够增强相关的酶的活性。如α-糜蛋白酶,在470MPa条件下,其酶活是常压下的6倍[53]。同样,嗜热菌蛋白酶在200MPa条件下的酶活是环境压力下的45倍[54]。因此,在高压条件下进行酶解消减过敏原,有必要进行高压对酶活性影响的对照实验,进而确定降低致敏性的真正原因,但目前还没有报道。
4 结 语
对于消费者而言,不仅要享受虾的美味,更要享受吃虾时的感觉,因此,在不破坏整体虾仁结构的同时,消减过敏原,制备低致敏性或无致敏性的虾仁就显得尤为重要。综合目前国内外的研究报道,较少研究加工对其分子结构和过敏反应原性的影响,而对整体虾仁的过敏原消减方法及机理研究基本没有报道。虽然日本已经采用高压法生产低致敏性的米饭,但对不同过敏原,食物基质对其钝化作用和机理有着明显的差异,因此很难得出同样的结论。在以往的研究中,无论是物理法、化学法还是生物法,如果单独使用,由于虾仁其他成分和组织结构的影响,很难较好地消减虾仁内部的过敏原。本课题组采用高静压结合蛋白酶水解方法,处理整体虾仁,较好地消减了虾仁内部的过敏原,建立了高压结合酶法制备低致敏性虾仁的相关技术参数。但对于虾仁内部过敏原消减过程中,高压对虾仁过敏原蛋白溶出、结构变化与过敏反应原性关系;虾仁中其他成分对过敏原蛋白消减的影响;高压能否有效地使蛋白酶压入虾仁组织内部并作用于过敏原蛋白,以及高压对酶活性影响等问题还有待深入探讨研究。
参考文献:
[1] SHANTI K N, MARTIN B M, NAGPAL S, et al. Identification of tropomyosin as the major shrimp allergen and characterization of its IgE binding epitopes[J]. J Immunol, 1993, 151(10): 5354-5363.
[2] DAUL C B, SLATTERY M, REESE G, et al. Identification of the major brown shrimp (Penaeus aztecus) as the muscle protein tropomyosin[J]. Int Arch Allergy Clin Immunol, 1994, 105(1): 49-55.
[3] LEUNG P S C, CHU K H, CHOW W K, et al. Cloning, expression, and primary structure of Metapenaeus ensis tropomyosin, the major heatstable shrimp allergen[J]. J Allergy Clin Immunol, 1994, 94(5): 882-890.
[4] LEUNG P S, CHEN Y C, MYKLES D L, et al. Molecular identif i cation of the lobster muscle protein tropomyosin as a seafood allergen[J]. Mol Mar Biol Biotechnol, 1998, 7(1): 12-20.
[5] LEUNG P S, CHEN Y, GERSHWIN M R, et al. Identif i cation and molecular characterization of Charybdis feriatus tropomyosin, the major crab allergen[J]. J Allergy Clin Immunol, 1998, 102(5): 847-852.
[6] MYKLES D L, COTTON J L, TANIGUCHI H, et al. Cloning of tropomyosins from lobster (Homarus americanus) striated muscles, fast and slow isoforms may be generated from the same transcript[J]. J Muscle Res Cell Motil, 1998, 19(2): 105-115.
[7] REESE G, SCHICKTANZ S, LAUER I, et al. Structural, immunological and function al properties of natural recombinant Pen a 1, the major allergen of brown shrimp Penaeu saztecus[J]. Clin Exp Allergy, 2006, 36(4): 517-524.
[8] NAKANO S, YOSHINUMA T, YAMADA T. Reactivity of shrimp allergy related IgE antibodies to krill tropomyosin[J]. Int Arch Allergy Immunol, 2008, 145(3): 175-181.
[9] MOTOYAMA K, SUMA Y, ISHIZAKI S, et al. Molecular cloning of tropomyosins identif i ed as allergens in six species of crustaceans[J]. J Agric Food Chem, 2007, 55(3): 985-991.
[10] MOTOYAMA K, SUMA Y, ISHIZAKI S, et al. Identification of tropomyosins as major allergens in ant arctic krill and mantis shrimp and their amino acid sequence characteristics[J]. Mar Biotechnol, 2008, 10(6): 709-718.
[11] AYUSO R, GALINA G, LUDMILLA B, et al. Myosin light chain is a novel shrimp allergen, Lit v 3[J]. J Allergy Clin Immunol, 2008, 122(4): 195-802.
[12] SUMA Y, ISHIZAKI S, NAGASHIMA Y, et al. Comparative analysis of barnacle tropomyosin: divergence from decapod tropomyosins and role as a potential allergen[J]. Comparative Biochemistry and Physiology, 2007, 147(2): 230-236.
[13] EMOTO A, ISHIZAKI S, SHIOMI K. Tropomyosins in gastropods and bivalves: identification as major allergens and amino acid sequence features[J]. Food Chemistry, 2009, 114(2): 634-641.
[14] 龚祖埙, 曹天钦. 对虾原肌球蛋白晶体和纤维的电子显微镜观察[J].生物化学与生物物理学报, 1964, 4(4): 427-436.
[15] 李振兴. 虾(Penaeus vannamei)过敏原免疫活性的研究[D]. 青岛: 中国海洋大学, 2006.
[16] 王晓斐. 中国对虾(Penaeus chinensis)主要过敏原的鉴定及性质研究[D]. 青岛: 中国海洋大学, 2008.
[17] 杜欣军, 张伟伟, 孙伟英, 等. 凡纳滨对虾原肌球蛋白基因表达模式与重组表达[J]. 渔业科学进展, 2009, 30(4): 38-43.
[18] 詹政科, 刘志刚, 吉坤美. 口虾蛄原肌球蛋白基因表达及变应原性鉴定[J]. 中国公共卫生, 2009, 25(4): 413-415.
[19] 黄建芳. 河虾主要过敏原单克隆抗体的制备及河虾过敏原不同组分共同表位分析[D]. 广州: 暨南大学, 2010.
[20] 吴海明, 胡志和, 王超. 免疫印迹法对4种海虾主要过敏原的鉴定[J].食品科学, 2010, 31(16): 274-277.
[21] 郑礼娜. 虾类过敏原的活性分析及其抗原表位的研究[D]. 青岛: 中国海洋大学, 2011.
[22] 易海涛, 夏立新, 刘芳, 等. 克氏原螯虾主要变应原原肌球蛋白的一个片段区基因的克隆表达、纯化及免疫原性鉴定[J]. 江西师范大学学报: 自然科学版, 2011, 35(3): 280-285.
[23] 周向红, 阎斌伦, 李士虎. 中国明对虾主要过敏原基因分子克隆与序列分析[J]. 水产科学, 2011, 30(2): 102-106.
[24] 武涌, 李欣, 陈红兵, 等. 食物过敏原表位定位技术的研究进展[J].食品科学, 2010, 31(23): 406-410.
[25] 刘光明, 沈苑, 曹敏杰, 等. 虾类过敏原的识别、纯化和检测技术研究[J]. 中国食品学报, 2008, 8(6): 142-148.
[26] 张轶群. 海产品过敏原免疫芯片检测方法的研究[D]. 青岛: 中国海洋大学, 2009.
[27] 王丽娟, 胡志和, 陈照丽, 等. 虾蛋白过敏实验动物模型的建立[J].食品科学, 2010, 31(19): 347-350.
[28] YU Huilin, CAO Minjie, CAI Qiufeng, et al. Effects of different processing methods on digestibility of Scylla paramamosain allergen (tropomyosin)[J]. Food and Chemical Toxicology, 2011(49): 791-798.
[29] HUSBAND F A, ALDICK T, van der PLANCKEN I, et al. High pressure treatment reduces the allergenicity of the major allergens in apple and celeriac[J]. Molecular and Nutrition and Food Research, 2011, 55(7): 1087-1095.
[30] TONG Ping, GAO Jinyan, CHEN Hongbing, et al. Effect of heat treatment on the potential allergenicity and conformational structure of egg allergen ovotransferrin[J]. Food Chemistry, 2012, 131(2): 603-610.
[31] LI Zhenxing, LIN Hong, CAO Limin, et al. The inf l uence of gamma irradiation on the allergenicity of shrimp (Penaeus vannamei)[J]. Journal of Food Engineering, 2007, 79(3): 945-949.
[32] 顾可飞, 高美须, 李春红, 等. 辐照对虾过敏原抗原性的影响[J]. 中国食品卫生杂志, 2007, 19(2): 102-105.
[33] 董晓颖, 高美须, 潘家荣, 等. 不同处理方法对虾过敏蛋白分子量及抗原性的影响[J]. 核农学报, 2010, 24(3): 548-554.
[34] BABIKER E E, HIROYUKI A, MATSUOOMI N, et al. Effect of polysaccharide conjugation or transglutaminase treatment on the allergenicity and functional properties of soy protein[J]. J Agric Food Chem, 1998, 46(3): 866-871.
[35] DOKE S, NAKAMURA R, TORII S. Allergenicity of food proteins interacting with oxidized lipids in soybean-sensitive individuals[J]. J Agric Biol Chem, 1989, 53(5): 1231-1235.
[36] 李庆丽, 李振兴, 林洪, 等. 美拉德反应中麦芽糖、葡萄糖对虾过敏原活性影响的研究[J]. 食品工业科技, 2009, 30(1): 79-81.
[37] 黄园园. 水产过敏原的模拟胃肠液消化[D]. 厦门: 集美大学, 2009.
[38] 刘光明, 余惠琳, 黄秀秀, 等. 加工处理方式对蟹类原肌球蛋白的消化稳定性和过敏原性的影响[J]. 中国食品学报, 2011, 31(11): 14-22. [39] 吴海明, 胡志和, 王丽娟. 凡纳滨对虾主要过敏原鉴定及酶法消减技术的研究[J]. 食品科学, 2010, 31(17): 272-276.
[40] 吴海明, 胡志和. 凡纳滨对虾过敏原酶法消减技术的研究[J]. 食品科学, 2010, 31(19): 38-41.
[41] NOLWENNIG R, JEAN R, GÉRARD D. Development of high hydrostatic pressure in biosciences: pressure effect on biological structures and potential applications in biotechnologies[J]. Biotechnology Advances, 2010, 28(6): 659-672.
[42] HEREMANS K. Protein dynamics: hydration and cavities[J]. Braz J Med Biol Res, 2005, 38(8): 1157-1165.
[43] SILVA J L, FOGUEL D. Hydration, cavities and volume in protein folding, aggregation and amyloid assembly[J]. Phys Biol, 2009, 6(1): 15002.
[44] KATO T, KATAYAMA E, MATSUBARA S, et al. Release of allergenic proteins from rice grains induced by high hydrostatic pressure[J]. Journal of Agricultural and Food Chemistry, 2000, 48(8): 3124-3129.
[45] PEÑAS E, GOMEZ R, FRIASA J, et al. High hydrostatic pressure effects on immunoreactivity and nutritional quality of soybean products[J]. Food Chemistry, 2011, 125(2): 423-429.
[46] SETINOVA I, KMINKOVA M, STROHALM J, et al. Allergenicity of main birch allergen rBet v1 and high-pressure treatment[J]. High Pressure Research, 2009, 29(4): 680-685.
[47] 谢丹丹, 胡志和, 薛璐, 等. 超高压结合酶法消减南美白对虾蛋白过敏原研究[J]. 食品科学, 2012, 33(8): 109-114.
[48] 谢丹丹, 胡志和, 薛璐, 等. 超高压结合酶法消减南美白对虾虾肉中的过敏原[J]. 食品科学, 2012, 33(3): 68-71.
[49] 乌云娜. 超高压处理对牛骨骼肌原肌球蛋白结构的影响[D]. 呼和浩特: 内蒙古农业大学, 2011.
[50] CHICON R, BELLOQUE J, ALONSO E, et al. Immuno reactivity and digestibility of high-pressure-treated whey proteins[J]. Int Dairy J, 2008, 18: 367-376.
[51] CHICÓN R, BELLOQUE J, ALONSO E, et al. Antibody binding and functional properties of whey protein hydrolysates obtained under high pressure[J]. Food Hydrocolloid, 2009, 23(3): 593-599.
[52] TROVASLET M, DALLET-CHOISY S, MEERSMAN F, et al. Fluorescence and FTIR study of pressure-induced structural modif i cations of horse liver alcohol dehydrogenase (HLADH)[J]. Eur J Biochem, 2003, 270(1): 119-128.
[53] AERTSEN A, MEERSMAN F, HENDRICKX M E G, et al. Biotechnology under high pressure: applications and implications[J]. Trends Biotechnol, 2009, 27(7): 434-441.
[54] KUNUGI S, KITAYAKI M, YANAGI Y, et al. The effect of high pressure on thermolysin[J]. Eur J Biochem, 1997, 248(2): 567-574.
Research Progress of Shrimp Allergens and Allergenicity Removal
HU Zhi-he
(Tianjin Key Laboratory of Food Biotechnology, School of Biotechnology and Food Science, Tianjin University of Commerce, Tianjin 300134, China)
Shrimp and its products have good delicious and are rich in nutrients, but they are allergenic foods for some people. In this paper, the research progress in the structure of major shrimp allergen protein (tropomyosin), epitope prediction and positioning, allergenicity testing and desensitization is reviewed. These investigations will provide some references for further studies on shrimp allergens and reduction of their allergencity.
shrimp;allergen;tropomyosin;allergenicity
TS254.1
A
1002-6630(2013)01-0319-05
2012-09-29
国家自然科学基金项目(31271841)
胡志和(1962ü),男,教授,硕士,研究方向为专用功能食品。E-mail:hzhihe@tjcu.edu.cn

