吡咯衍生物的合成研究进展
徐 虹,白雪峰,吕宏飞,李 猛
(黑龙江省科学院石油化学研究院,哈尔滨 150040)
吡咯衍生物[1-2]是一类重要的含氮五元杂环化合物,在天然产物化学、有机合成、药物化学及材料化学等领域有着广泛的用途。近年来,随着天然产物化学的迅猛发展,科研人员[3]发现许多含有吡咯环的化合物具有很强的生物活性或有特殊的用途,如抗菌素藤黄绿脓菌素(Pyoluteorin),从雄性斑蝴蝶中得到的吡咯嗪酮,绿色植物光合作用的催化剂叶绿素,从动物肝脏中提取得到的一种深红色结晶维生素B12等。这些化合物化学合成的关键问题是如何经济有效地合成吡咯环,因此,吡咯衍生物的合成成为研究的热点。本研究介绍了几种吡咯衍生物的合成方法及其优缺点。
1 Paal-Knorr反应
Paal-Knorr反应是指1,4-二羰基化合物在无水的酸性条件下脱水,生成呋喃及其衍生物,1,4-二羰基化合物与氨或硫化物反应,可得吡咯、噻吩及其衍生物。该法是合成吡咯中最经典的方法,其可能的生成吡咯反应机理[4]如下:
反应第一步生成两份半缩醛胺化合物,再经过亚胺(R =H)或烯胺(R≠H)中间体分步脱水得到吡咯。
1999年,N.Timother等[5]报道了2,5-二羰基正己烷与伯胺在微波作用下生成相应的吡咯,反应在2min之内就能完成,收率最高能达到90%。对于不对称的1,4-二羰基化合物较难生成所需的产物,2004年,G.Minetto等[6]提出了通过微波辐射促进Paal—Knorr反应,取得了不错的效果。
2006年,CHEN Jiuxi等[7]采用Sc(OTf)3、Mg(OTf)2、Cu(OTf)2等催化剂,2,5-二羰基化合物与苯胺在无溶剂条件下得到吡咯,考察了不同催化剂对反应的影响,其中Sc(OTf)3能达到93%的收率,并且催化剂能多次使用。
2009年,张书文等[8]研究了在超声辐射下,几种1,4-二酮与取代的芳香伯胺进行的Paal-Knorr缩合反应。与传统的加热方法相比较,在超声辐射下利用Paal—Knorr缩合反应合成多取代吡咯可以在室温条件下进行,产率较高,反应时间短。
Paal-Knorr反应仍然是合成吡咯环中一种最方便、最有效、适用范围最广的方法,最适合制备2,5-二取代吡咯。近年来,一些新催化剂和新方法成功应用于Paal—Knorr缩合反应中,但还是存在明显缺点,采用新催化剂存在操作复杂、反应条件剧烈及反应时间长等缺点。离子液体法[9]中离子液体本身价格较贵、制备复杂;超声辐射法的缺点是不适合放大。
2 Barton-Zard反应
1985年,Barton和Zard报道了[10]在非亲核碱,如1,8 -二氮杂二环[5.4.0]十一碳-7-烯(DBU)存在下,硝基烯烃与异氰基乙酸乙酯缩合可方便地制备出5-位未被取代的各种吡咯。Barton-Zard反应[4]所用到的5位未取代的3,4-二取代吡咯-2-羧酸酯来自异氰基酸酯在碱(如DBU、TMG、K2CO3)存在下与硝基烯烃的反应。这个环缩合反应经过去质子后的异氰酸酯官能团捕获,再质子化、碱诱导脱去HNO2后互变异构体2H-吡咯为1H-吡咯。吡咯-2-羧酸酯皂化为吡咯-2-羧酸热消除脱羧得到3,4-二取代吡咯。
2011年,Nathan R.等[11]在合成一个环氧化酶 -2 (COX-2)特异性抑制剂(吡咯烷酮类化合物)的过程中,关键的吡咯环反应就是应用了Barton-Zard反应。
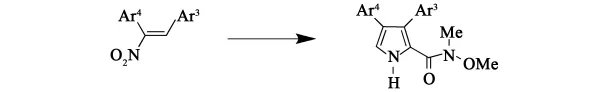
Barton-Zard反应随着硝基烯烃[12]的发展已经被广泛应用于天然和非天然吡咯产品的合成,可以很方便地合成β-取代吡咯,产率很高(80%~90%)。但是最大的问题是不能在吡咯的2-位上发生取代反应,另外当β位有一个基团是氢,收率则一般,这些限制了它的应用。
3 Van Leusen反应
Van Leusen反应是利用对甲苯磺酰异腈(TosMIC)与缺电子烯烃反应合成吡咯的方法。以TosMIC与烯酮的反应为例,其可能的反应过程如下:脱质子后的TosMIC加到烯酮上形成烯醇离子,它被分子内异氰酸酯官能团捕获并环化、再质子化,在3-位脱质子化给出烯醇离子,1,4-消除脱去磺酸离子并生成3H-吡咯,再互变异构为3,4-二取代1H-吡咯。
1991年,Van Leusen等[13]采用1-异氰基-1-对甲苯磺酰基-1-烯烃和硝基烷烃反应生成3-硝基吡咯。该反应在四氢呋喃中添加一定量的t-BuOK,低温-80℃下进行,可以得到最高收率94%的产物。
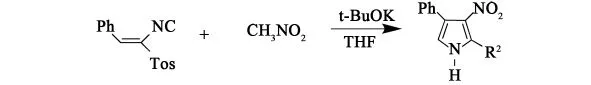
硝基二烯烃和硝基三烯烃都可以Leusen反应来分别合成得到3-烯烃-4-硝基吡咯或2-烯烃-3-丁二烯基-4-硝基吡咯。
Van Leusen反应最重要的优点是能直接制得未取代的α-取代吡咯,而且收率非常高。不足之处在于想要获得高收率反应需要在低温-80℃下进行,操作不易,能耗较高。
4 其他方法
1998年,Shiraishi H.等[14]采用 SmCl3为催化剂,醛、胺、硝基烷烃三组分一锅法反应生成吡咯。该反应经由亚胺,亚胺由氨基和羰基化合物生成,再按硝基化合物的Michael加成机理进行,能得到收率65%的取代吡咯。
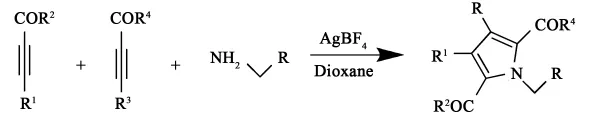
2010年,Weibing Liu等[15]采用AgBF4为催化剂,二氧六环作溶剂,100℃条件下反应3h,炔酸酯和胺一锅法反应生成吡咯。该反应由炔烃氧化加成成环得到多取代吡咯。
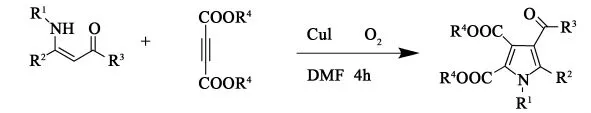
2010年,Ru-Long Yan等[16]探索出利用β-烯胺酮(脂)和炔酸酯来制取吡咯,在CuI和O2共同作用下反应,溶剂为DMF,80℃条件下反应4h得到一系列呋喃、吡咯衍生物,最高收率87%的产物,这是一种新型且具有实际意义的方法。
2010年,Sukhendu Maiti等[17]采用FeCl3为催化剂,1,3 -二羰基化合物、醛、胺、硝基烷烃四组分生成多取代吡咯。共计得到36个吡咯衍生物,收率在38%~85%。
近年来,吡咯的新合成多采用一锅法,研究的重点均为多取代吡咯,很好地弥补了传统方法的不足,也取得了很大的进步。这些方法适用范围有很大局限,还需要做大量的工作。
5 结论
综上所述,合成吡咯的方法很多。选择不同的合成方法路线主要依据吡咯环上取代基的位置、数量,还有原料合成难易程度,经济等因素。不同的合成方法均有不同的适用范围,以及一定的局限性。随着科技的日新月异,越来越多的吡咯衍生物应用在天然产物化学、材料、生物等领域,吡咯的合成[18]也将得到更多科研人员的关注。另外,当今社会,绿色化学已成为化学化工的主题,进一步开发新的吡咯环合成技术或在原有技术上的改进还有巨大的发展空间,这将极大地促进相关产业的发展。
[1]BOULTON AJ,MCKILLOP A.Comprehensive heterocyclic chemistry[M].Oxford:Pergamon Press,1984:29.
[2] THOMAS L.,GILCHRIST.Synthesis of aromatic heterocycles[J].J.Chem.Soc.,Perkin Trans,1999,(1):2849-2866.
[3]SEREF D,AHMET C,NURI K.Synthesis and antibacterial activities of some 1-[2-(substituted pyrrol-1-y1)ethyl]-2-l]methyl-5-nitroimidazole derivatives[J].European Journal of Medicinal Chemistry,1999,(34):275-278.
[4]L.F.TIETZE,T.EICHER,U.DIEDERICHSEN,et al.当代有机反应和合成操作[M].上海:华东理工大学出版社,2008:407 -411.
[5]N.TIMOTHER,W.DANKS,Microwave assisted synthesis of pyrroles[J].Tetrahedron Lett,1999,(40):3957-3960.
[6]G.MINETTO,L.F.RAVEGLIA,MAURIZIO,et al Microwave-Assisted Paal-Knorr Reaction.A Rapid Approach to Substituted Pyrroles and Furans[J].Org.Lett.,2004,6(3):389-392.
[7]CHEN JIUXI,WU HUAYUE,ZHENG ZHIGUO,et a1.An approach to the Paal-Knorr pyrroles synthesis catalyzed by Sc (OTf)3under solvent-free conditions[J].Tetrahedron Letters,2006,(47):5383-5387.
[8]张书文,张星,魏保君,等.超声辐射下利用Paal—Knorr反应合成多取代吡咯衍生物[J].河北大学学报(自然科学版),2009,29(6):618-622.
[9]WANG BO,GU YANLONG,LUO CHENG,et al.Pyrrole synthesis in ionic liquids by Paal-Knorr condensation under mild conditions[J].Tetrahedron Letters,2004,(45):3417-3419.
[10]BARTON D H R,ZARD S Z.A new synthesis of pyrroles from nitroalkenes[J].J.Chem.Soc,Chem Commun,1985,(16): 1098-1100.
[11]JESSICA G.GREGER,SARAH J.P.YOON-MILLER,NATHAN R.BECHTOLD,Synthesis of Unsymmetrical 3,4-Diaryl -3-pyrrolin-2-ones Utilizing Pyrrole Weinreb Amides[J]. J.Org.Chem.,2011,76(20):8203-8214.
[12]ZARD.W.,VANSLYKE S.A.,Organic electroluminescence diodes[J].Tetrahedron Lett.,1995,(36):9469.
[13]DAAN VAN LEUSEN,ERNST FLENTGE,Albert M.van Leusen an efficient synthesis of 3-nitropyrrole[J].Tetrahedron,1991,47(26):4639-4644.
[14]SHIRAISHI H.,T.NISHITANI,S.SAKAGUCDI.Preparation of substituted alkylpyrroles via samarium-catalyzed three-component coupling reaction of aldehydes,amines,and nitroalkanes[J].J.Org.Chem.1998,(63):6234.
[15]WEIBING LIU,HUANFENG JIANG,LIANGBIN HUANG.One -pot silver-catalyzed and PIDA-mediated sequential reactions:synthesis of polysubstituted pyrroles directly from alkynoates and amines[J].Org.Lett.,2010,12(2):312-315.
[16]RU-LONG YAN,JIA LUO,CHUAN-XIN WANG,et a1.Cu (I)-catalyzed synthesis of polysubstituted pyrroles from dialkyl ethylenedicarboxylates and β-Enamino ketones or esters in the presence of O2[J].J.Org.Chem.,2010,75(15):5395-5397.
[17] SUKHENDU MAITI,SRIJIT BISWAS,UMASISH JANA.Iron (III)-catalyzed four-component coupling reaction of 1,3-Dicarbonyl compounds,amines,aldehydes,and nitroalkanes:a simple and direct synthesis of functionalized pyrroles[J]Org. Chem.,2010,75(5):1674-1683.
[18]BANIK B K,BANIK I,RENTERIA M,et al.A straightforward highly efficient Paal-Knorr synthesis of pyrroles[J].Tetrahedron Letters,2005,(46):2643-2645.

