伏马毒素生物合成和降解的研究进展
徐 瑾 伍松陵 常晓娇 沈 晗 孙长坡
(国家粮食局科学研究院1,北京 100037)
(北京工商大学2,北京 100037)
伏马毒素(Fumonisins,FBs)是由镰刀菌属在一定的温度和湿度下产生的水溶性代谢产物,是一类由不同的多氢醇和丙三羧酸组成结构类似的双酯化合物。伏马毒素广泛分布在全球各地,是一种非专性,非特异性的一种病原菌。主要分布在以玉米、高粱、小麦为主的农作物上,可造成秧苗枯萎,根、茎、种子腐烂等农业经济损失。Cetherine等[1]次从串珠镰刀菌培养液中分离出伏马毒素。除了串珠镰刀菌以外,多誉镰刀菌(F.proliferatum)、还有芜菁状镰刀菌(F.napiforme)、花腐镰孢菌(F.anthophilum)、尖孢镰刀菌(F.oxysporum)、F.nygamai、和F.dlamini也会产生伏马毒素。目前,除了镰刀菌属以外,交链胞属F.varsubglutinans也是伏马毒素的重要产生菌。而部分镰刀菌属的包括胶孢镰刀菌(F.subglutinans)、F.annulatum、F.succisae和F.beomiforme在内的菌种不产伏马毒素[2]。到目前为止,发现的伏马毒素有 FA1、FA2、FB1、FB2、FB3、FB4、FC1、FC2、FC3、FC4、FP1共 11种,但其分布主要以 FB1、FB2和 FB33种形式存在,其中FB1是危害范围最大和研究最广的伏马毒素[3],伏马毒素的主要化学结构式见图1。
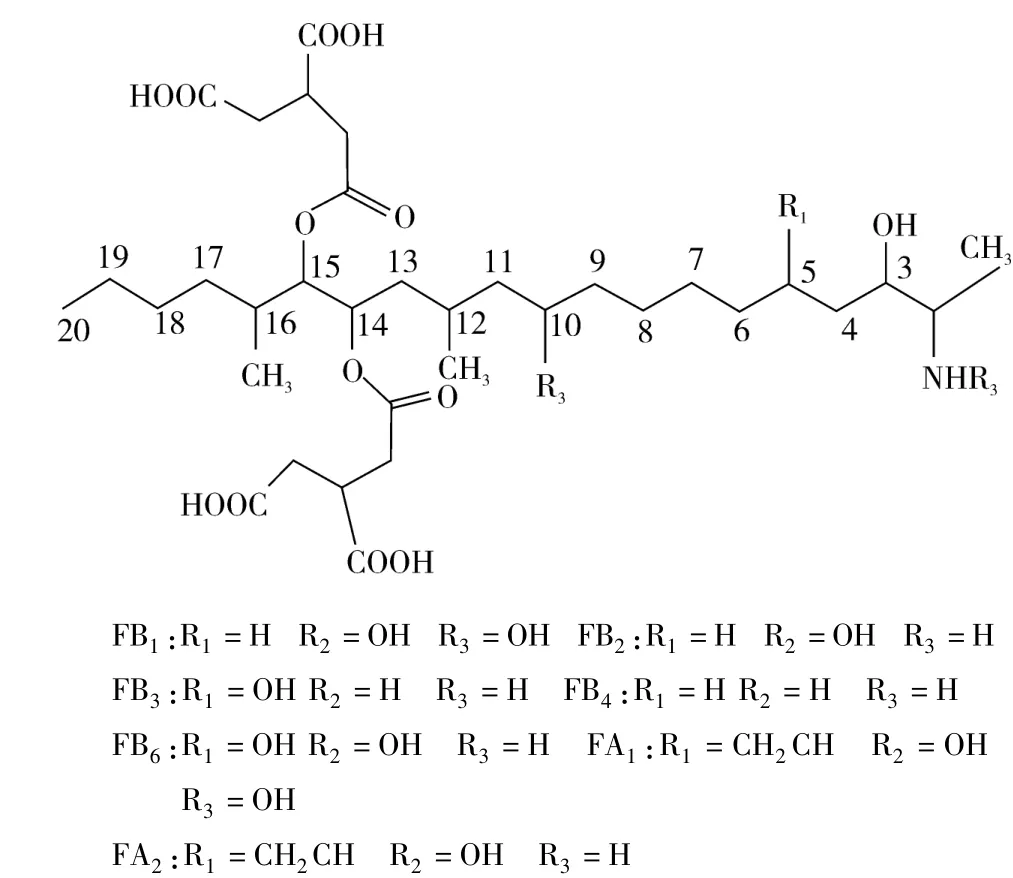
图1 伏马毒素的主要化学结构图
FB毒素能在较低的浓度范围内干扰植物正常生理功能,是对植物代谢有毒害作用的非酶类化合物,属于真菌毒素(mycotoxin)和非寄主专化型毒素(non-host-specific toxin,NHST)[4]。伏马毒素 B1对畜禽和实验动物可引起各种具有特异性的毒理作用,如马、兔的脑白质软化症(ELEM),其表现为:神经性中毒,意识障碍、失明和运动失调等症状,严重者甚至造成死亡[5]。还可造成猪的肺水肿和水胸(PPE),肝脏和食道损伤。伏马毒素还可引起灵长类动物的动脉粥样硬化,鼠、羔羊、小牛的肝细胞凋亡和肾毒性,还有肝毒性和致癌效应,给畜牧业带来严重经济损失[6-10]。本文从伏马毒素理化性质、作用机理及其毒素产生的影响进行论述,其中基因工程在伏马毒素脱毒中的应用是本文关注的重点。
1 伏马毒素理化性质及其作用机理
1.1 伏马毒素的理化性质
伏马毒素骨架结构为19或20个碳原子直链的双酯化合物,各种羧基、羟基及酯键分布在骨架两侧。伏马毒素溶于水,不溶于有机溶剂,且具有热稳定性,100℃蒸煮 30 min也不能破坏其结构[11],150℃的半衰期为10 min,125℃的半衰期为38 min,100℃的半衰期为175 min,75℃的半衰期为8 h。该特性也给研究工作带来困难。
1.2 作用机理
鞘脂类物质作为细胞膜的重要构成成分和细胞功能调节剂,在细胞的生长和分化中起到重要的作用。由于伏马毒素的化学结构与人或动物机体内的神经鞘氨醇有着高度的相似性,因此在神经鞘脂类的代谢过程中,伏马毒素竞争性地结合神经鞘氨醇N-2酰基转移酶,从而抑制了神经鞘氨醇的生物合成,阻碍了鞘脂类代谢[12]。神经鞘脂类生物合成的破坏将给人类以及动物的健康造成严重的危害。Merrill等[13]认为FB主要通过竞争的方式来抑制神经鞘氨醇N-2酰基转移酶,打破血清、肝、肾中二氢鞘氨醇(Sa)与鞘氨醇(So)之间的平衡,导致复合鞘脂减少和游离二氢神经鞘氨醇增加,影响鞘脂的代

图2 鞘脂类的代射途径和伏马毒素的作用位点及复合鞘磷脂的结构
谢,致使神经鞘氨醇生物合成被抑制,最终造成细胞的损伤。伏马毒素可通过鞘脂类物质参与多种细胞调控功能,进而导致相关疾病的产生,如:蛋白激酶C的抑制,磷酸化酶D的激活及转录因子AP-1的增加等。复合鞘磷脂参与细胞骨架蛋白结合,影响蛋白的运输、分类和定位,及其他与细胞的正常生长、分化和程序化死亡有关的调控功能。因此,伏马毒素可以引起鞘脂类代谢紊乱及脂类合成失控,同时还可以影响细胞分化等,如图3所示。
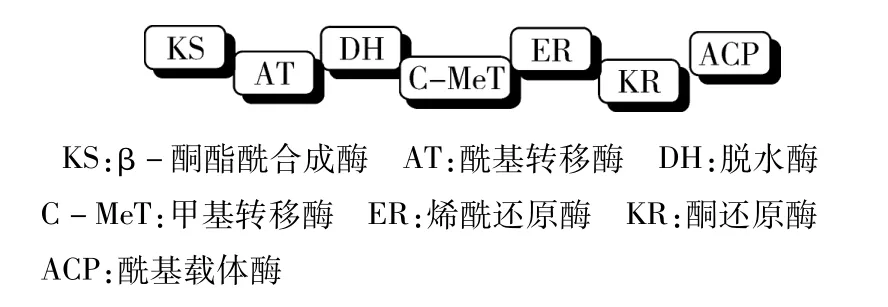
图3 转录产物功能区示意图
2 伏马毒素合成的调控因素
2.1 基因调控因素
生化分析表明,伏马毒素是镰刀菌属产生的次级毒性代谢产物。通过对参与伏马毒素生物合成的多酮肽合成酶(PKS)基因,进行PCR扩增[14]。其结果为:一个具有718kb编码区的基因(fum5)其转录产物(fum5p)与细菌和真菌Ⅰ型(TypeⅠ)多酮肽合成酶(PKS)非常相似。携带fum5的黏粒克隆转化给串珠镰刀菌,加强了这些菌株产生伏马毒素的能力,并且使不产生伏马毒素的突变株恢复了野生型产生伏马毒素的能力。反之,阻断fum5,则几乎不产伏马毒素。有研究表明,fum5p可能催化伏马毒素C—3到 C—20骨架的合成[15]。尽管 fum5p与脂肪酸合成酶相似,但由于其在一条单链转录产物上具有6个公认的功能区KS、AT、DH、ER、KR和ACP(其结构示意图,如图2),而在真菌脂肪酸链上,这6个功能区及一个MPPT区分布于两条多肽链FAS1和FAS2上,由此推断fum5p是调控多酮肽合成酶的基因,非脂肪酸合成酶基因。
2.2 环境调控因素
外界环境条件如,pH值、碳氮比等因素同样可以影响真菌能否产生伏马毒素。在轮枝镰刀菌中,最适合伏马毒素产生的pH值是3~3.5,pH值高于3.5能促进轮枝镰刀菌生长但抑制伏马毒素的生物合成。此外,外界环境的碳氮比在伏马毒素生产调控上也具有重要作用。分析表明,外界糖浓度的增加有利于伏马毒素的生物合成[16-17]。相反,氨基酸,氮源的增加则抑制伏马毒素生物合成,将氨基酸的浓度从10 g/L降低到1 g/L时,伏马毒素产量显著增加;当改用铵盐作为氮源时,同样表现为高浓度抑制伏马毒素的产生[16]。伏马毒素的产生随着碳氮比的增加而增多,真菌自身的生长下降[17]。基因分析表明,在低氮的条件下,fum1和fum8等FUM家族基因表达水平明显增加,这进一步验证了在氮缺乏情况下,更容易诱导FUM基因的表达,从而增加伏马毒素的产量[16]。此外,环境中支链淀粉含量也是影响轮枝镰刀菌伏马毒素合成的重要因素,高支链淀粉含量有利于伏马毒素的产量增加[18]。
3 伏马毒素生物合成基因序列群及其表达
到目前为止,在轮枝镰刀菌基因组中,共鉴定出16个FUM基因族类基因。在合成伏马毒素的基因调控途径上,在fum1的下游,还具有10个相关FUM基因家族类基因参与调节伏马毒素合成酶的活性,从而调控伏马毒素产量,(见图4[19],表1)。然而,其余相关FUM类基因的敲除突变体在伏马毒素合成量上影响较小或没有影响,说明该基因族在调控镰刀菌伏马毒素生物合成上具有一定的功能冗余。此外,在FUM基因家族以外,一些其他与伏马毒素产量相关的基因也正在日益发掘。例如,AREA、CPP1、FCC1、FST1、FvVE1、GBP1、GBB1等多个基因均被报道在伏马毒素合成和产量上具有重要作用[16,20-26]。表2列出了在轮枝镰刀菌基因组中除FUM基因家族基因外,已经报道的其他一系列参与调控伏马毒素生物合成的基因及其功能。

图1 以鞘酯单胞菌为例调控伏马毒素合成的FUM基因簇序列排列
研究表明,在轮状镰刀菌(F.verticillioides)中15个相关位点的基因参与FB毒素的合成[27];其中所有能产生FB毒素的F.verticillioides中都含有FB毒素生物合成所必需的多酮肽合成酶基因fum5。然而,这些基因究竟如何调控伏马毒素的合成,并与FUM基因家族之间具有怎样的调控关系和途径,目前正在进一步研究之中。表1、表2为伏马毒素生物合成基因簇的表达情况。

表1 FUM基因族参与伏马毒素生物合成的主要基因及表达

表2 FUM基因族外轮枝镰刀菌基因组中参与伏马毒素生物合成的主要基因
4 伏马毒素的钝化和降解
Stefan Heinl等[19]假设有关 FB1毒素的降解途径,FB1首先通过羧酸酶的作用进行脱羧反应,随后在转氨酶的作用下产生无毒的物质。如果该假设能够成立,那么降解伏马毒素的进程将大大加快。Duvick等[28]曾报道了发现几个微生物物种(包括真菌和细菌)能代谢伏马毒素碳链骨架产生 CO2,如黑酵母菌可以在以FB1作为唯一碳源时生长并产生代谢FB1的酶。Blackwell等发现斯平尼弗外瓶柄霉(Exophiala Spinifera)的纯培养时能分泌细胞外酯酶转化FB1为氨基酸多元醇[29]。此外,利用现代生物技术,通过基因克隆、基因修饰等相关操作也可实现降毒甚至脱毒的可能。如:斯平尼弗外瓶柄霉已经用作构建能脱毒伏马毒素的转基因玉米。斯平尼弗外瓶柄霉能分泌针对伏马毒素的可溶性酯酶对伏马毒素进行脱酯反应,接着由胺氧化酶对产生的胺醇骨干进行内部环化,形成半酮缩醇;这样酯酶,胺氧化酶,及其他下游酶一起构成了一种新型的伏马毒素代谢途径。并且与脱酯反应和脱胺作用有关的基因也已经被克隆了[29]。可见利用生物转化法将伏马毒素转化成无毒物质存在理论和技术上的可行性。通过基因转化,将新的基因插入作物的遗传物质,增加其特异性,往往超过作物间的遗传变异。通过抑制毒素的合成或将毒素降解为无毒物质也是一种减少毒素污染的有效方法。
5 展望
伏马毒素普遍存在于我国粮食作物中,对人畜健康有很大的潜在危害。随着科技的进步,可以通过物理、化学以及生物手段对FUM毒素进行脱毒、降毒。由于传统的物理和化学方法有一定的局限性,且改变了食品的品质,易造成营养物质的流失,欧盟不允许在食品生产过程中应用化学方法消除真菌毒素。而微生物或酶制剂的降解为成功控制真菌毒素的污染提供了新的思路。生物降解不仅可以高效将毒素转化为无毒产物、环保安全,而且生物酶催化方法专一性强、转化效率高。通过生物技术途径,消除真菌污染和毒素的危害已成为当今关注热点。
采用生物技术减少FUM的危害主要将集中在以下3个研究方向:一是利用微生物对真菌毒素的降解机制主要是将真菌毒素作为营养来源进行了吸收、转化,从而达到降解毒素的目的。此类生防菌通过代谢机制抑制毒素的产生。二是利用微生物基因工程,筛选降解酶基因、并进行鉴定、分离和克隆及其降解酶蛋白的高效表达。例如将FUM水解酶基因(如PKS)转化大肠杆菌、酵母或其它模式微生物,大量生产PKS水解酶,运用于受镰刀霉污染的玉米和其它粮食脱毒;或用于饲料,饲养家畜,使其在动物胃肠道降解饲料中的FUM。最后,利用基因介导,将FUM水解酶基因克隆到玉米或其他禾谷类作物,使转化表达的种子直接降解受镰刀霉污染谷物上的FUM。将去毒基因转入受害农作物,以此提高FUM水解酶基因表达水平,发现新的FUM水解酶基因,必将受到越来越多研究者的重视。总之,为保证国家粮食安全,人民身体健康,使用生物技术手段对伏马毒素的脱毒和降毒具有十分重要的意义。
[1]Catherine Bezuidenhout S,Gelderblom Wentzel C A,Gorst-Allman Charles P,et al.Structure elucidation of the fumonisins,mycotoxins from Fusarium moniliforme[J].Chemical Society,Chemical Communications,1988,52:743-745
[2]Nelson PE,Plattner R D,Shackelford D D,fumonisin B1 production by Fusarium species other than Fmoniliforome in section Liseola and some related species[J].Appl Eviron Microbiol.1992,58:984-989
[3]SYDENHAM EW,SHEPHARD GS,THIEL PG.Liquid chromatography determination of Fumonisins B1,B2 and B3 in food and feeds[J].J AOACInt,1992,75(2):313-318
[4]王金生.分子植物病理学[M].北京:中国农业出版社,1999
[5]Eric W,Sydenham,Pieter GThiel,et al.Natural occurrence of some Fusarium mycotoxins in corn from low and high esophageal cancer prevalence areas of the Transke,in southern Africa[J].Agric Food Chem,1990,38(10):1900-1903
[6]Riley RT,Norred WP,Bacon CW.Fungal toxins in food:recent concerns[J].Ann Rev Nutr,1999,13:167-189
[7]Norred WP.Fumonisins mycotoxins produced by Fusarium moniliforme[J].J Toxicol Environ Health,1993,38:309-328
[8]Groves FD,Zhang L,Chang YS,et al.Fusarium mycotoxinsin core and core products in a high-risk area for gastric cancer in Shandong Province,China[J].J AOAC Int,1999,82:657-662
[9]Marasas WFO.Fumonisins history,world-wide occurrence and impact.In:Jackson LS,De Varies W,Bullerman LB,ed.Fumonisins in food[M].New York:Plenum Publishing Co.1996.11-17
[10]MarasasW F,KellermanT S,GelderblomWC,et al.Leukoenphalomalacia in horse induced by FUMonisin B1isolated from fusarium moniliforme on derstepoort[J].Vet Re,1988,55:197-203
[11]Dupuy J,Lebars P,Boudra H,et al.Thermostability of fumonisin B1,a mycotoxin from fusarium moniliforme,in corn[J].Applied and Environment Microbiology,1993,57(9):2864-2867
[12]Merrill AH J,Schmelz EM,Wang E,et al.Role of dietary sphingolipids and inhibitors of spingolipid metabolismincancer and other diseases[J].JNutr,1995,125:1677
[13]Wang E,Norred W P,Bacon CW,et al.Inhibition of sphingolipid biosynthesis by Fumonisins.Implications for diseases associated with Fusarium moniliforme[J].Bio Chem,1991,266:14486-14490
[14]Proctor RH,Desjardins AE,Plattner RD,et al.A polyketide-synthase gene required for biosynthesis of fumonisin mycotoxins in Gibberella fujikuroimating population A[J].Fungal Genet Biol,1999,27:100-112
[15]Amoah BK,Macdonald MV,Rezanoor N,et al.The use of random amplified polymorphic DNA technique to identify mating groups in the Fusarium section Liseola[J].PL Pathol,1995,45:115-125
[16]Kim H,Woloshuk CP.Role of AREA,a regulator of nitrogen metabolism,during colonization of maize kernelsand fumonisin biosynthesis in Fusarium verticillioides[J].Fungal Genet Biol,2008,46(6):947-53
[17]Jimeneza M,Mateoa JJ,Hinojo MJ,et al.Sugars and amino acids as factors affecting the synthesis ofFumonisins in liquid cultures by isolates of the Gibberella fujikuroi complex[J].Int JFood Microbiol,2003,89(2):185-93
[18]Bluhm BH,Woloshuk CP.A mylopectin induces fumonisin B1 production by Fusarium verticillioides during colonization of maize kernels.Plant-Microbe path genesis[J].Mol Plant-Microbe Interact,2006,18(12):1333-9
[19]Stefan Heinl,Doris Hartinger,Michaela Thamhesl,et al,Degradation of fumonisin B1 by the consecutive action of two bacterial enzymes[J].,Journal of Biotechnology,2010,145:120-129
[20]Bluhm BH,Woloshuk CP.Fck1,a C-type cyclin-dependent kinase,interacts with Fcc1 to regulate development andsecondary metabolism in Fusarium verticillioides[J].Fungal Gene Biol,2006,44(3):146-54
[21]Shim WB,Woloshuk CP.Regulation of fumonisin B1biosynthesis and conidiation in Fusarium verticillioides byacyclin-like(C-Type)gene,FCC1[J].Appl Environ Microb,2001,67(4):7-12
[22]Bluhm BH,Kim H,Butchko RAE,et al.Involvement of ZFR1 of Fusarium verticillioides in kernel colonization and the regulation of FST1,a putative sugar transportergene required for fumonisin biosynthesis on maizekernels[J].Mol Plant Pathol,2008,9(2):03-11
[23]Myung K,Li S,Butchko RAE,et al.FvVE1 regulates biosynthesis of them cotoxins Fumonisins and fusarinsin Fusarium verticillioides[J].JAgric Food Chem,2009,57(11):89-94
[24]Sagaram US,Butchko RAE,Shim WB.The putative monomeric G-protein GBP1 is negatively associated with fumonisin B1production in Fusarium verticillioides[J].Mol Plant Pathol,2006,7(5):381-9
[25]Sagaram US,Shim WB.Fusarium verticillioides GBB1,a gene encoding heterotrimeric G proteinβsubunit,isassociated with fumonisin B1 biosynthesis and hyphal development but not with fungal virulence[J].MolPlantPathol,2007,8(4):375-84
[26]Desjardins AE,Plattner RD,Proctor RH.Linkage among genes responsible for fumonisin biosynthesis in Gibberella fujiku roimating population A[J].Appl Eviron Microbiol,1996,62:2571-2571
[27]PLATTNER L.Identification and characterization of strains of Gibberella fujiku roimating population A with rare fumonisin production phenotypes[J].Mycologia,1996,88:416-424
[28]Duvick Jon.Prospects for reducing fumonisin contamination of maize through genetic modification[J].Environmental Health Perspectives,2001,09(suppl2):337-342
[29]Blackwell B A,Gilliam JT,Savard M E,et al.Oxidative deamination of hydrolyzed fumonisin B(1)(AP(1))by cultures of exophiala spinifera[J].Natural Toxins,1999,7(1):31-38.

