尼氟灭酸和钙通道阻断剂对γ-氨基丁酸激活电流去敏感的作用*
李 丽,汪 洋,马克涛,成洪聚,赵 磊,司军强△
(1.石河子大学医学院生理和病理生理教研室,2.新疆地方与民族高发病教育部重点实验室-电生理研究室,新疆石河子832002)
γ-氨基丁酸(gamma aminobutyric acid,GABA)作为一种重要的中枢抑制性神经递质,广泛分布于哺乳动物的中枢神经系统,对神经系统具有普遍的抑制性作用。GABA在抗焦虑、抗惊厥、镇痛和调节内分泌等方面发挥着重要作用[1]。GABA激活的受体分为三类,包括 GABAA、GABAB和 GAGAC,其中GABAA和GABAC属超家族配体门控离子通道受体,GABAB属G蛋白偶联受体。目前认为GABAA受体包括氯通道和五个分别供GABA、苯二氮类(benzodiazepine)、巴比妥类(barbiturates)、苦味毒(picrotoxin)及麻醉药作用的结合位点[2],上述药物可通过与其相应部位的结合调节GABAA受体对GABA的反应。GABAA受体已有至少19个受体亚单位被成功克隆,已鉴定的GABAA受体主要由α、β、γ和δ构成,其中除δ亚基外,每一种亚基均有不同的异构体存在(α1-α6、β1-β4和γ1-γ4),α6和γ2又各有两个剪接变异体。目前认为GABAA受体是由不同亚基构成的五聚体,被GABA激活后通过开启Cl-通道产生抑制作用,其效应可被荷包牡丹碱(bicuculline)阻断。GABAA受体本身作为通道-受体复合体还有多种药物的结合位点,这些药物结合位点与GABA识别位点在构像上相互作用,直接或间接参与Cl-通道的门控过程,发挥着加强或抑制GABA的药理学作用。
非甾体类抗炎药物(non-steroidal anti-inflammatory drugs,NSAIDs)是目前临床使用较为广泛的一类药物,其通过抑制环氧合酶和前列腺素的合成发挥解热、镇痛和抗炎作用[3]。已有文献报道,NSAIDs对中枢神经系统神经元GABAA受体功能也存在着重要的调节作用[4],我们前期的研究也发现NSAIDs对背根神经节(dorsal root ganglia,DRG)神经元 GABAA受体的激活电流有明显的抑制作用,这一作用我们推测可能是通过抑制钙激活的氯离子通道(calciumactivated chloride channels,CaCC)实现的,事实是否如此还需进一步深入研究。本研究选择非甾体类的抗炎药物尼氟灭酸(niflumic acid),观察尼氟灭酸和钙离子通道阻断剂对DRG神经元GABA激活电流的作用。
1 材料与方法
1.1 主要材料
实验所用动物由新疆医科大学医学实验动物养殖中心提供的4周龄SD大鼠(200~250 g),雌雄不限,动物质量符合一级标准。葡萄糖酸钾、胶原酶、胰蛋白酶、胰蛋白酶抑制剂、荷包牡丹碱(bicuculline)、GABA、尼氟灭酸、HEPES为 Sigma公司产品,其余试剂均为国产分析纯试剂。
1.2 主要仪器
Axon 700B放大器(美国Axon公司)、P-2000拉制仪(美国 Sutter公司)、生物电信号记录计算机(Axoscope 10.2软件,美国 Axon公司)。
1.3 细胞制备
实验动物为4周龄的SD大鼠,击昏、断头后迅速切开背部皮肤沿脊柱两侧剪断与之相连的肋骨,取出胸腰段脊柱由脊柱正中剖开成两半置于O2饱和的细胞外液中,外液成分为(mmol/L):NaCl 150;KCl5;CaCl22.5;MgCl21;HEPES 10;D-glucose 10,pH=7.4溶液渗透压为340mOsm。由剖开的椎管内侧取出神经节及相连的神经前后根和脊神经,在显微镜下用角膜剪及游丝镊剪除相连的神经和结缔组织,将分离出的DRG剪碎转移至培养皿内,加胰蛋白酶 0.25mg/ml,胶原酶 0.5 mg/ml后移于试管中,在37℃恒温温箱中孵育15min。然后加入适量胰蛋白酶抑制剂终止胰蛋白酶的消化。将上述机械分离和酶处理的 DRG神经元离心(1 000 r/min,6 min),然后转移至培养皿内,室温(20~30℃)下静置至少30min[5]。
1.4 全细胞膜片钳记录
使用Axon 700B放大器(美国Axon公司)进行实验记录,玻璃微电极用P-2000拉制仪(美国Sutter公司)拉制,电极阻抗约为1~5 MΩ,玻璃微电极所充内液成分为(mmol/L):KCl 140;CaCl21;MgCl22;HEPES 10;EGTA 11,细胞外液的成分为(mmol/L):NaCl150;KCl 5;CaCl22.5;MgCl21;HEPES 10;d-glucose 10,在电极与细胞膜形成高阻(1~5GΩ)封接后将膜吸破然,然后调节电容和串联电阻补偿保持电压为负 60mV。膜电流应用低通滤波(10 Hz)[5]。药物均采用无糖外液配制,pH为7.4。给药系通过微操纵器移动快速换液装置的排药管进行,排药管的每个管口的直径0.5 mm,管口距所记录的细胞100 μm,实验在室温22~30℃范围进行。GABA激活电流的去敏感拟合采用Clampfit 10.2软件(美国Axon公司)进行。
1.5 统计学分析
实验数据采用均数±标准差(±s)表示,采用SPSS 17.0软件进行数据分析,给药前后采用两均数的t检验来分析数据。
2 结果
本实验所检测的大鼠新鲜分离DRG细胞呈圆形或椭圆形。实验选用的细胞轮廓清晰,折光性强,直径在20μm~45μm之间,静息电位为(-59±7.1)mV(n=223)。其中部分细胞连有被离断的轴索突起残端,呈卷曲状。
2.1 GABA激活DRG神经元的内向电流
被测 DRG的神经元中有 95.11%(212/223)对外加 GABA(0.1~1 000μmol/L)敏感,GABA引起明显的内向电流,且具有明显的去敏感现象(图1),即虽然GABA持续存在且浓度不变,但GABA激活电流达到顶峰后,电流幅值立即呈指数衰减直到达到一稳定值。GABA激活内向电流的 EC50为(28.2±2.5)μmol/L(n=9)。100μmol/L的 GABA引起的电流幅值为(1.32±0.74)nA(n=84)。该电流可被GABAA受体特异性拮抗剂荷包牡丹碱(bicuculline,100μmol/L)几乎完全阻断 (n=8,图 1),这一结果与我们实验室前期的研究结果一致[5]。

Fig.1 Effect of bicuculline(100μmol/L)on the GABAA receptor GABAA:Gamma aminobutyric acid A receptor
2.2 尼氟灭酸浓度依赖性的抑制GABA激活电流
预灌流不同浓度的尼氟灭酸后,给予相应浓度GABA,发现预加尼氟灭酸可抑制GABA激活电流的幅值,尼氟灭酸对GABA激活电流的抑制作用具有浓度依赖性,IC50为(27.24±4.63)μmol/L(n=56)。1μmol/L、10μmol/L和100μmol/L的尼氟灭酸对GABA激活电流幅值的抑制率分别为(6.13%±3.21%)(n=8)、(31.60% ±4.87%)(n=19)和(59.80%±6.23%)(n=15,图 2)。但尼氟灭酸没有改变 GABA激活内向电流的 EC50值((28.2±2.5)μmol/L,n=9),与不预灌流尼氟灭酸相比,GABA激活内向电流的 EC50差异无显著性(P>0.05)[5]。

Fig.2 Records of GABA(100μmol/L)-activated currents with pretreatment of niflumic acid
2.3 尼群地平浓度依赖性的抑制GABA激活电流
DRG神经元全细胞膜片钳记录形成后,胞外给予 GABA(100μmol/L)约5 s,记录GABA激活电流,外液冲洗2min后再一次记录GABA激活电流作为前对照。预加不同浓度特异性L-型钙通道阻断剂尼群地平20 s后,给予相应浓度尼群地平与GABA(100μmol/L)混合药物,记录 GABA激活电流。预加 0.1μmol/L、1μmol/L、10μmol/L和 30μmol/L的尼群地平均致GABA激活电流幅值降低,其抑制率分别为(18.90% ±2.14%)(n=12)、(42.50% ±5.95%)(n=10)、(43.60%±5.10%)(n=5)和(49.60%±8.70%)(n=6),与对照组相比差异均有统计学意义(P<0.05,图 3)。
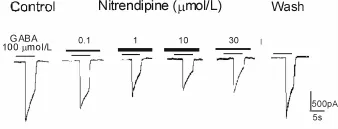
Fig.3 Records of GABA(100μmol/L)-activated currents with pretreatment of nitrendipine
2.4 尼氟灭酸对DRG神经元GABA激活电流去敏感的作用
图4所示,100μmol/L的尼氟灭酸对 GABA激活内向电流产生明显的抑制作用,经指数方程f(t)=∑Aie-t/τi+C拟合后(见图 4中的下图),发现 GABA激活内向电流的去敏感呈双指数特性,τ值分别为(14.68±5.11)s(n=6)和(175.80±42.67)s(n=6)(r=0.9647),表明 GABA激活电流的去敏感包括快、慢两个时相[5]。预加尼氟灭酸之后,GABA激活电流幅值受抑制的同时,GABA激活电流的去敏感仍为双指数特性,τ值分别减少为(4.64±2.21)s(n=3)和(43.70±14.34)s(n=3)(r=0.9548),提示尼氟灭酸抑制GABA激活内向电流可能是通过加速去敏感来实现的。
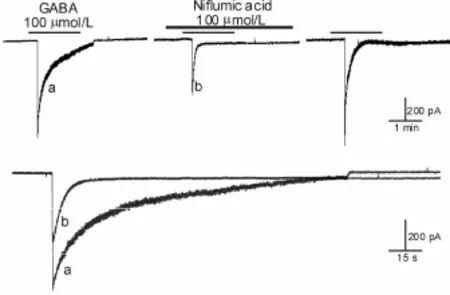
Fig.4 Tracings and fit curves of the desensitization of GABA(100 μmol/L)-activated currentswith presentand non-presentniflumic acid(100μmol/L)
2.5 氯化镍对DRG神经元GABA激活电流去敏感的作用
图5所示,100μmol/L的氯化镍(非特异性钙离子通道阻断剂,包括阻断L-型电压依赖性钙通道)对GABA激活内向电流也有明显的抑制作用,经指数方程 f(t)=∑Aie-t/τi+C拟合后(见图 5中的下图),GABA激活内向电流的去敏感的双指数特性保持不变,τ值分别为(14.68±5.11)s(n=6)和(175.80±42.67)s(n=6)(r=0.9647)。但预加氯化镍之后,GABA激活电流幅值受抑制的同时,GABA激活电流的去敏感仍为双指数特性,τ值分别减少为(3.76±2.21)s(n=3)和(133.45±47.54)s(n=3)(r=0.9721),提示氯化镍抑制 GABA激活内向电流主要抑制了快去敏感时相,对慢去敏感时相的作用不明显。

Fig.5 Tracings and fit curves of the desensitization ofGABA(100 μmol/L)-activated currents with present and non-present niekel chloride(100μmol/L)
3 讨论
GABA是脊髓主要的抑制性神经递质,在初级感觉信息传递(尤其是伤害性感受)通路的控制中发挥重要作用。DRG神经元膜有GABAA及GABAB受体共存已经得到证实。脊髓GABA能中间抑制性神经元释放GABA作用于初级传入终末(DRG假单极神经元中枢突末梢)的GABAA受体,增加DRG神经元Cl-电导,导致Cl-外流,产生初级传入末梢去极化[6],导致传入神经冲动的幅度降低,产生突触前抑制,减少末梢神经递质的释放,使背角痛敏神经元的活动减弱,对初级感觉传入尤其是痛觉的上传起到抑制作用[7]。因此,研究DRG神经元GABAA受体的作用和被调节机制,对阐明初级感觉信息传入的突触前机制具有重要意义。
已有大量的文献报道,NSAIDs对中枢神经系统神经元GABAA受体功能也存在着重要的调节作用[4,8]。GABAA受体作为配体门控离子通道能被很多药物调控,包括苯(并)二氮卓类、巴比妥类、类固醇、惊厥剂和麻醉剂[9]。已有报道,尼氟灭酸对GABAA和 NMDA受体有调节作用[4,8]。甲芬那酸(一种非甾体抗炎药物)能直接作用于神经元膜的GABAA受体[10]。尼氟灭酸也可以作为正性变构调节剂作用于α1β2γ2组成的 GABAA受体,另外,尼氟灭酸也能作为负性变构调节剂作用于α6β2和α6β2γ2组成的GABAA受体[9]。我们的研究表明,尼氟灭酸没有改变GABA激活内相电流的EC50(约为30μmol/L)值,但明显使 GABA激活电流最大值减少约60%,表明尼氟灭酸对GABA激活电流的抑制作用是非竞争性的。实验还发现GABA激活内向电流的去敏感呈双指数特性,GABA激活电流的去敏感包括快、慢两个时相,τ值分别为(11.60±4.23)s(n=3)和(175.80±42.67)s(n=3,r=0.9616)。预加尼氟灭酸之后,GABA激活电流幅值受抑制的同时,GABA激活电流的去敏感仍为双指数特性,τ值分别减少为 4.64 s和 43.70 s(r=0.9548),提示尼氟灭酸抑制GABA激活内向电流可能是通过加速去敏感(包括快、慢两个时相)来实现的。
已有资料表明钙激活氯通道在神经元兴奋、平滑肌生理特性的维持等许多生理过程中起重要作用。成年大鼠DRG神经元有基础钙激活氯通道表达[11],研究发现神经损伤可致大、中型DRG神经元上钙激活氯通道表达的上调。尼氟灭酸是一种环氧化酶抑制剂,也是目前公认的一种较强的钙激活氯通道(calcium-activated chloride channels,CaCC)阻断剂[12]。本实验发现尼氟灭酸对GABA激活的内向电流有明显的浓度依赖性抑制,表明钙激活氯通道可能与GABA介导的Cl-外流有关。而钙激活氯通道是钙和电压依赖性的,钙激活氯通道取决于细胞内钙离子浓度的升高[12]。为揭示GABA激活电流与Ca2+的关系,本实验预灌流L-型钙通道阻断剂尼群地平和氯化镍阻断Ca2+内流后,GABA激活电流幅值明显降低。实验结果表明Ca2+在GABA激活氯通道开放中起重要作用,细胞外Ca2+内流可能通过激活氯通道调节GABA激活电流。
由实验可以推测:当初级感觉信息传入脊髓背角,脊髓抑制性中间神经元释放GABA,作用于DRG神经元中枢端末梢GABAA受体介导Cl-外流,引起去极化电流产生,膜去极化激活电压依赖性钙通道,导致Ca2+内流,细胞内Ca2+浓度升高激活DRG神经元膜上钙激活氯通道,促进Cl-进一步外流产生内向电流,加速DRG神经元的去极化,形成一个正反馈。结果使DRG神经元传至初级传入终末的动作电位幅度变小,时程缩短,由此使递质的释放量减少,最终导致脊髓中枢神经元的兴奋性突触后电位减小,实现突触传递的前抑制作用。
[1] Bormann J.The‘ABC’ofGABA receptors[J].TrendsPhar-macol Sci,2000,21(1):16-19.
[2] Wu J,Harata N,Akaike N.Potentiation by sevoflurane of theγ-aminobutyric acid-induced chloride current in acutely dissociated CA1 pyramidal neurones from rat hippocampus[J].Br JPharmacol,1996,119(5):1013-1021.
[3] Vane JR,Botting RM.Mechanism of action of nonsteroidal anti-inflammatory drugs[J].Am JMed,1998,104(3A):2S-8S.
[4] Babot Z,Cristofol R,Sunol C.Excitotoxic death induced by released glutamate in depolarized primary cultures of mouse cerebellar granule cells is dependenton GABAA receptorsand niflumic acid-sensitive chloride channels[J].Eur J Neurosci,2005,21(1):103-112.
[5] Si JQ,Zhang ZQ,LiCX,etal.Modulatory effectof substance P on GABA-activated currents from rat dorsal rootganglion[J].Acta Pharmacol Sin,2004,25(5):623-629.
[6] Alvarez F J,Kavookjian A M,Light A R.Synaptic interactions between GABA-immunoreactive profiles and the terminals of functionally defined myelinated nociceptors in the monkey and cat spinal cord[J].Neurosci,1992,12(8):2901-2917.
[7] 李 丽,赵言昌,王 磊,等.GABA引起正常和病理性疼痛大鼠DRG神经元去极化反应的比较[J].石河子大学学报(自然科学版),2010,28(1):63-67.
[8] Sinkkonen ST,Mansikkamaki S,Moykkynen T,etal.Receptor subtype-dependent positive and negativemodulation of GABA(A)receptor function by niflumic acid,a nonsteroidal anti-inflammatory drug[J].Mol pharmacol,2003,64(3):753-763.
[9] Mehta A K,Ticku M K.An update on GABAA receptors[J].Brain Res Brain Res Rev,1999,29(2-3):196-217.
[10] Coyne L,Su J,Patten D,et al.Characterization of the interaction between fenamates and hippocampal neuron GABA(A)receptors[J].Neurochem Int,2007,51(6-7):440-446.
[11] Sorota S.Pharmacologic properties of the swelling-induced chloride current of dog atrial myocytes[J].J Cardiovasc Electrophysiol,1994,5(12):1006-1016.
[12] Hartzell C,Putzier I,Arreola J.Calcium-activated chloride channels[J].Annu Rev Physiol,2005,67:719-758.

