分离自牧草根际四株促生菌株(PGPR)互作效应研究
张英,朱颖,姚拓*,祁娟,荣良燕
(1.甘肃农业大学草业学院 草 业生态系统教育部重点实验室 中 —美草地畜牧业可持续发展研究中心,甘肃 兰 州730070;2.青海大学农牧学院草业科学系,青海 西 宁810016)
植物根际促生菌(plant growth promoting rhizobacteria,简称PGPR)是指自由生活在土壤或附生于植物根际、茎叶,可促进植物生长及对矿质营养吸收和利用,产生促进植物生长的次生代谢物,抑制有害微生物的有益菌类[1]。促生菌包括解磷、固氮和分泌植物激素的微生物;降解农药残留和有机污染物的根际微生物;预防和控制流行性病原菌对植物侵染的微生物[2]。PGPR能否在植物根际成功定殖,并发挥其功效,往往受到气候、土壤性质和土著微生物的影响[3]。微生物在田间植物根际并不是单独存在的,所以在有益微生物资源的开发利用和微生物肥料的研究中,了解微生物之间的相互作用,将几种微生物有机地混合在一起培养,能适应较广谱的生态环境,增加混合菌株功能的多样性,并有可能产生优于单类菌培养的效果,这对复合微生物肥料的开发利用有着重要的意义。
近几年来,一些学者就细菌间的交互促生效果进行了些研究,如Esitken等[4]、Banchio等[5]、Karlidag等[6]、Orhan等[7]将混合接菌剂接种到植物(蔬菜、水果等)根际后发现能调节植物的营养平衡,促进N、P、K和其他(Mg、Ca、Fe、Mn和Zn)营养元素吸收,促进植物生长,提高植物产量。再次验证了适合的菌株混合物能起到协同作用,如一类微生物为另一类微生物的生长提供重要的养料和基质,或者为另一类微生物的继续生长创造了有利条件,有的甚至依赖于其他微生物而存活[8],一些可以促进其他细菌生长繁殖[9]。
目前,对具有不同功能的根际PGPR共生协作效应的研究报道较少。本研究拟开展具有固氮、溶磷和分泌植物激素等功能的不同PGPR菌株之间进行单独和交叉混合培养,测定溶磷和分泌IAA(吲哚乙酸,Indoleacetic Acid)的能力,探讨菌株在溶磷和分泌IAA时的互作效应,探求不同功能菌株的最佳组合,以期为研制PGPR复合菌肥提供基础资料和理论依据。
1 材料与方法
1.1 菌株来源
供试菌株为前期(2008-2010年)在兰州、定西、酒泉及其周边地区苜蓿(Medicagosativa)、白三叶(Trifoliumrepens)和红三叶(Trifoliumpratense)植物根际分离、筛选获得的细菌(PGPR菌株)(表1),这些菌株具有较强的固氮、溶磷、分泌IAA的能力,同时具有生长快、竞争力强等特点[10-12]。

表1 供试菌株Table 1 Tested strains
1.2 培养基
LB培养基[13]:酵母粉5 g,蛋白胨10 g,NaCl 5 g,琼脂20 g,蒸馏水1 000 m L,p H=7.0。
PKO无机磷培养基[14]:葡萄糖10 g,(NH4)2SO40.5 g,NaCl 0.2 g,KCl 0.2 g,MgSO4·7H2O 0.03 g,Mn-SO40.03 g,FeSO40.003 g,酵母膏0.5 g,琼脂20 g,Ca3(PO4)23 g,蒸馏水1 000 m L,p H=6.8~7.0。
蒙金娜有机磷培养基[15]:FeSO4·7 H2O 0.03 g,(NH4)2SO40.5 g,CaCO35 g,NaCl 0.3 g,MnSO4·4 H2O 0.03 g,KCl 0.3 g,葡萄糖10 g,卵磷脂0.2 g,酵母膏0.4 g,琼脂20 g,蒸馏水1 000 m L,p H=7.0~7.5。
King培养基[16]:MgSO4·7H2O 1.5 g,K2HPO41.15 g,蛋白胨20 g,甘油15 m L,蒸馏水1 000 m L,p H=6.8。
Spot比色液[16]:0.5 mol/L FeCl31 m L,蒸馏水50 m L,浓 H2SO430 m L。
S2比色液[16]:FeCl34.5 g,10.8 mol/L H2SO41 L。其测定范围为5~200μg/m L,一般超过100μg/m L需要稀释。
1.3 菌株拮抗反应测试
菌株间的拮抗反应测试采用牛津杯法[17],将一种菌在液体培养基中培养24 h的菌悬液,以2%(V/V)的量接种到发酵培养基中,28℃、180 r/min振荡培养48 h;发酵液8 000 r/min离心10 min,上清过0.22μm滤膜,取滤液100μL滴加在含有2% 另一种细菌的LB平板中央的牛津杯中(直径7 mm),待发酵滤液扩散后置28℃条件下恒温培养。以无菌水作阴性对照。将供试4株细菌两两进行抑菌实验,每个处理3次重复,1 d后观察抑菌圈的有无,若有抑菌圈,说明两细菌间有拮抗作用,若无抑菌圈,且细菌生长良好,则说明这两个细菌可以共存,各菌株间没有拮抗作用,不发生拮抗反应的菌株可以混合培养,否则只能单独施用。
1.4 互作实验设计
将无拮抗反应的4株供试菌株,在LB培养液中,于28℃,125 r/min振荡培养48 h后,待菌株充分生长后,用无菌水调节各待测菌株菌悬液浓度为1×108cfu/m L(波长660 nm,OD值≥0.5)。将制备好的菌悬液按表2的方法处理,共16个处理。
1.5 各处理菌株溶磷能力测定
将50 m L液体PKO无机磷培养液和蒙金娜有机磷培养液分别装入150 m L三角瓶中,121℃灭菌25 min,冷却后按处理设计分别接种500μL菌悬液,每个处理设3次重复。接种完后,将三角瓶置于28℃、160 r/min摇床培养10 d,之后加入已处理的活性炭1 g,振荡30 min(150 r/min)。再将培养液在10 000 r/min、4℃离心15 min,取上清液,用钼锑抗比色法测定有效磷增量(扣除对照后的值,mg/L)[18],计算公式如下:

其中:P—有效磷增量;K—从标准曲线查得显色液的磷含量(mg/L);V—显色时溶液定容的体积(m L);V1—显色时吸取上清液的体积(m L)。
1.6 各处理菌株培养液p H值变化测定
用酸度计测定1.5中培养10 d后的各处理菌株培养液p H值的变化情况。
1.7 各处理菌株分泌有机酸总量测定
取1.5中离心后的上清液,以酚酞为指示剂,用0.1 mol/L NaOH滴定各上清液,测定有机酸的总量,用 mmol/L表示。
1.8 菌株分泌IAA能力测定
1.8.1 定性测定 将50 m L King培养液装于150 m L三角瓶,121℃灭菌25 min,冷却后按处理设计分别接种500μL菌悬液,每个处理设3次重复。接种后,将上述三角瓶置于28℃,150 r/min摇床培养12 d,吸取菌株培养液50μL滴置于白色陶瓷板上,同时加50μL Spot比色液,对照只在比色液中加50 μL 10 ppm的植物生长激素(3-吲哚乙酸);将白色瓷板置室温下,在15 min内观察其颜色变化,颜色变粉红者表示能分泌IAA,颜色越深表示分泌IAA能力越强;不变色为阴性,即不分泌IAA。
1.8.2 定量测定 采用Salkowski比色法[19],吸取1.8.1中培养12 d菌株培养液10 000 r/min、4℃离心10 min,取上清液1 m L加1 m L S2比色液在黑暗下静置30 min后,迅速用分光光度计比色(波长530 nm)进行测定(标准曲线采用纯的3-吲哚乙酸制作)。

表2 菌悬液的处理Table 2 Bacteria levitation liquid treatments
1.9 数据统计分析
数据处理采用SPSS 16.0软件,多重比较采用LSD法。
2 结果与分析
2.1 菌株拮抗反应测试
微生物间的拮抗作用,一般是指一种微生物的生命活动或其代谢产物,抑制或干扰另一种微生物生命活动的现象。拮抗试验是鉴定菌株间遗传差异的传统方法,是其不同遗传特性和亲和群的重要表现[20]。本研究供试菌株间拮抗反应测试结果表明菌株间均无拮抗反应,可用于制作混合接种液。
2.2 各处理菌株的溶磷能力
2.2.1 溶解无机磷能力 以PKO无机磷培养基中磷酸三钙为唯一磷源,对各处理的有效磷增量进行了测定,结果表明,单菌株处理有效磷增量为14.68~307.61 mg/L,各处理有效磷增量差异显著(P<0.05)(表3),其中C处理的有效磷增量最大,为307.61 mg/L;2菌株组合处理中,AD处理的有效磷增量最大,为536.26 mg/L,另外,AB、AD、BC、BD处理的有效磷增量均显著高于单菌株处理的有效磷增量,且大于2菌株单独接种时有效磷增量之和(P<0.05),呈现“1+1>2”的溶磷效果,而AC、CD处理的有效磷增量均显著高于单菌株处理的有效磷增量,但均未表现“1+1>2”的溶磷效果;3菌株和4菌株组合处理中除ABD处理外,其余各处理的有效磷增量均显著高于单菌株处理的有效磷增量,但均未表现“1+1+1>3”或“1+1+1+1>4”的溶磷效果。说明没有拮抗作用的各菌株混合培养,大部分组合能显著提高有效磷的增量,但所起到的作用也不完全是加成效应。
2.2.2 溶解有机磷能力 有机磷是土壤中磷元素的重要来源之一,约占土壤中全部磷元素的30%~50%。因此微生物对有机磷的转化也是土壤中磷元素的重要来源。本研究中各处理菌株都具有一定的溶解有机磷能力(表4),有效磷增量总体不高,为2.50~11.11 mg/L,为无机磷有效磷增量的2%,其中:单菌株C处理有效磷增量最小(2.50 mg/L),与其他处理差异极显著(P<0.01),D 处理有效磷增量最大(11.11 mg/L),与其他处理差异显著(P<0.05);组合处理BD有效磷增量较D和B处理时低(P<0.05),组合ACD处理的有效磷增量(9.20 mg/L)较高,但小于单菌株D处理,其余各处理有效磷增量均处于2菌株单独培养有效磷增量值之间,各组合处理的有效磷增量均没有表现加成效应。说明菌株组合培养,对有机磷的溶磷能力不一定会提高,这可能是菌株溶解有机磷的能力和溶磷机理均与培养的条件等有关。
2.3 有效磷增量与p H的关系
p H值是衡量溶液酸碱性的尺度,也是反映微生物溶磷的影响因素之一。各处理菌株培养10 d后,培养液p H值都明显降低,且较对照差异显著(P<0.01)。在PKO培养液中有效磷增量大于400 mg/L的4个处理的p H值集中于3.16~4.61(表3),在蒙金娜培养液中有效磷增量大于8 mg/L的6个处理的p H值集中于5.74~6.77(表4),说明各处理菌株在培养的过程中均能分泌一些酸类物质使p H值降低。对PKO和蒙金娜培养液有效磷增量与p H值间的相关性分析结果表明,PKO 培养液的Y有效磷增量=-125.77XpH+908.75(R2=0.525 7),有效磷增量与p H间呈线性相关(图1)(P<0.01);蒙金娜培养液的Y有效磷增量=-4.0305XpH+32.851(R2=0.282 4),有效磷增量与p H间也呈现线性相关(图2)(P<0.05),说明培养液p H值降低对各处理菌株溶磷作用存在一定的相关性。
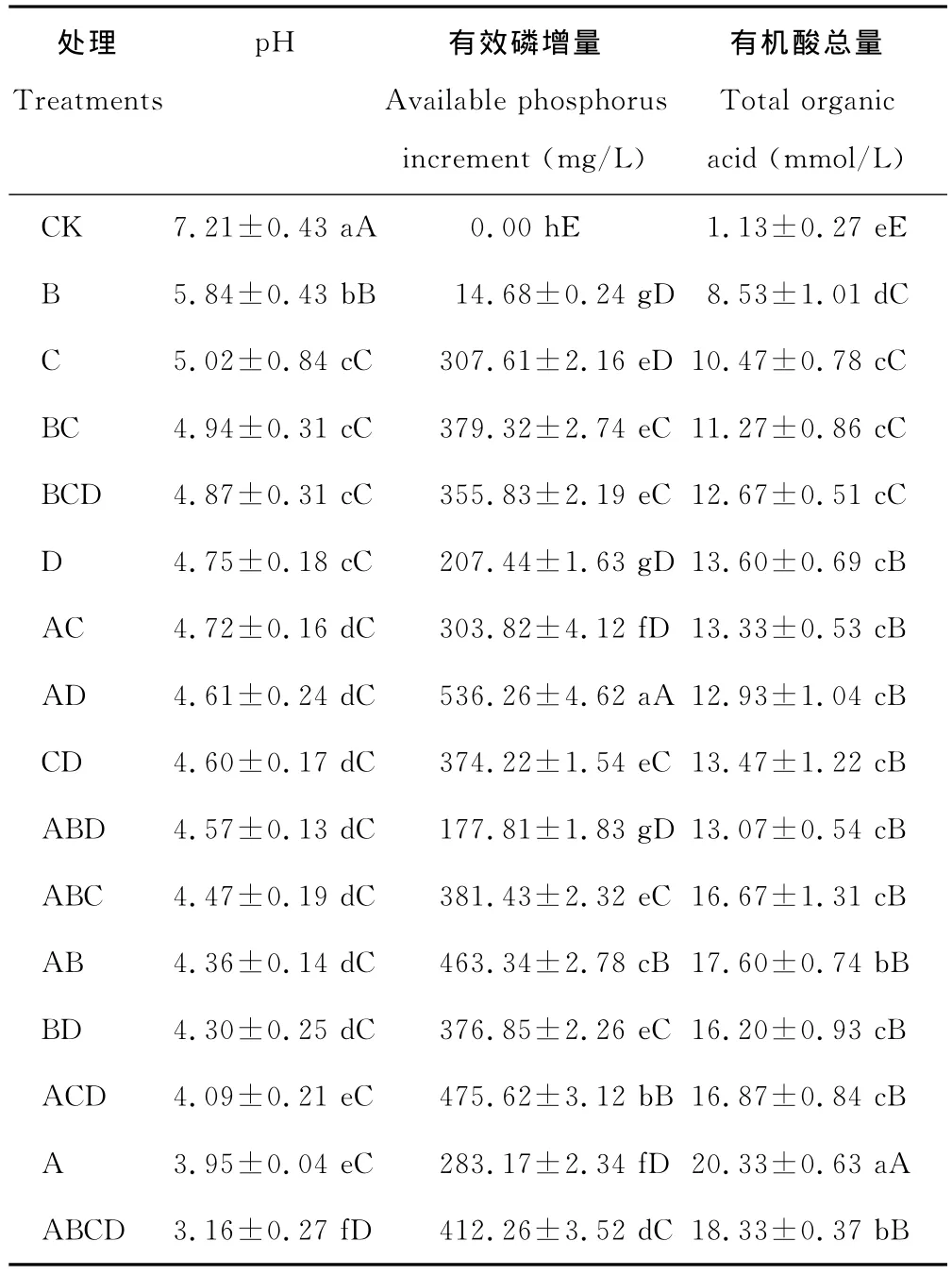
表3 各处理菌株在PKO培养液中有效磷增量、p H值及有机酸总量的变化Table 3 Available increased phosphorus,p H and total organic acid on PKO culture medium by different treatments
2.4 有效磷增量与有机酸总量的关系
许多微生物在生命代谢活动中常常会分泌有机酸,测定各处理菌株培养液的有机酸总量(表3),结果表明,处理菌株在PKO培养液中生长10 d后均能分泌有机酸,各处理与对照(1.13 mmol/L)差异显著,有机酸总量为8.53~20.33 mmol/L,其中 A处理有机酸总量最高,为20.33 mmol/L,ABCD处理有机酸总量次之,为18.33 mmol/L。分析有机酸总量与培养液有效磷增量间的相关性表明,Y有效磷增量=19.485X有机酸总量+64.127(R2=0.337 3),培养液有效磷增量与有机酸总量间呈线性相关(图3)(P<0.05),但相关性较弱。A处理的有机酸总量最高,但有效磷增量(283.17 mg/L)并非最高,而ABCD处理有机酸总量次之,有效磷增量(412.26 mg/L)却高于A处理129.1 mg/L。其结果表明有效磷增量与有机酸总量间存在一定的相关性,但有效磷增量并不完全由总有机酸量来决定,可能也与分泌的有机酸的种类有关,尤其是多微生物共同作用时,微生物的溶磷机理更加复杂,是多种因素共同作用的结果。
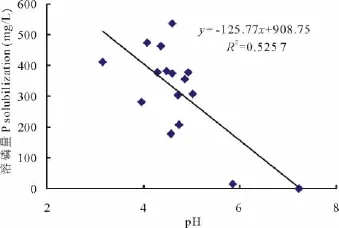
图1 溶磷量与p H值的相关性(PKO培养液)Fig.1 Relationships between P solubilization and p H value(PKO culture medium)
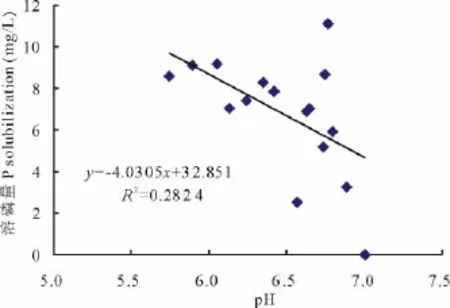
图2 溶磷量与p H值的相关性(蒙金娜培养液)Fig.2 Relationships between P solubilization and p H value(Mongolia Jin culture medium)
2.5 有机酸总量与p H的关系
微生物生命活动过程中会分泌有机酸,但有机酸的种类较复杂,菌株培养过程中分泌的有机酸是否对培养液p H值的降低起决定作用,对各处理在PKO培养液中的有机酸总量与p H值(表3)进行相关性分析,结果表明,YpH=-0.1817X有机酸总量+7.174 8(R2=0.889 4),p H值的变化与有机酸总量间相关性显著(P<0.01)(图4)。A 处理有机酸总量最高(20.33 mmol/L),培养液的p H 值(3.95)较对照CK(7.21)显著降低,但并非最低,而ABCD处理有机酸总量次之(18.33 mmol/L),培养液的p H 值(3.16)最低。结果表明有机酸总量与p H值的变化存在线性相关,这可能与菌株分泌的有机酸的种类和数量有关,另外可能与菌株协同作用的影响也有一定的关系。
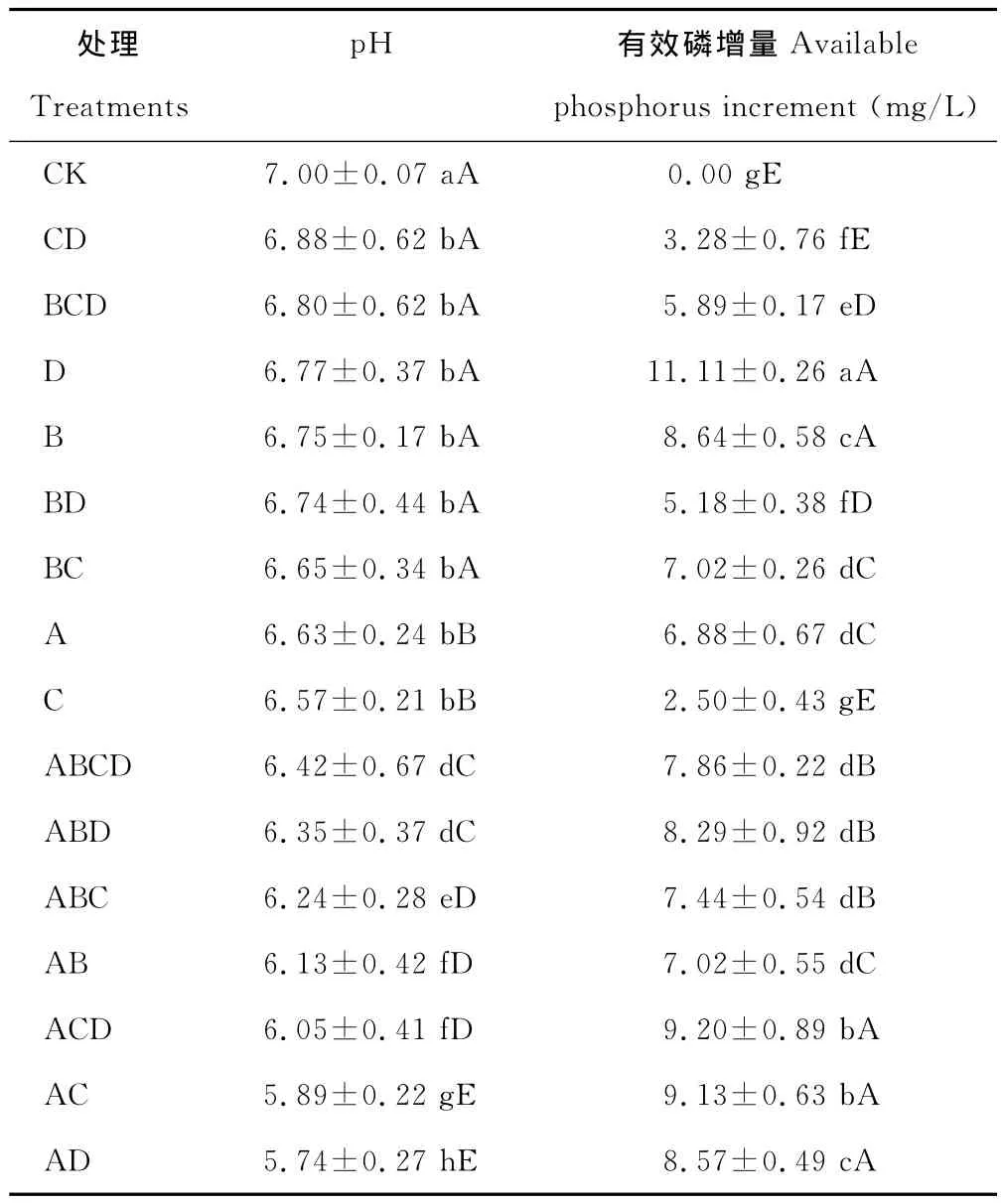
表4 各处理菌株在蒙金娜培养液中有效磷增量和p H值的变化Table 4 Available increased phosphorus and p H on Mongolia Jin culture medium by different treatments
2.6 各处理菌株分泌IAA能力
测定各处理菌株分泌IAA的结果可知(表5),Spot试剂比色测定,除D处理颜色基本没有变化外,其他处理均有颜色变化,说明除D处理,其他各处理都能分泌一定量IAA,进一步用S2试剂定量测定,其结果与采用Spot试剂基本一致,各处理差异显著(P<0.05),各处理分泌IAA 量为0.212~9.331 μg/m L。单菌株B处理颜色变化较明显,分泌IAA量也最高(9.331μg/m L)。组合处理菌株分泌IAA量差异显著,其中:BD处理分泌IAA量较高(9.152μg/m L),AD处理分泌IAA量(6.887μg/m L)较菌株A处理分泌IAA量(3.624μg/m L)和D处理分泌IAA量(0.212 μg/m L)显著提高(P<0.01),且表现出“1+1>2”的加成效果,其他菌株组合处理,分泌IAA量在2菌株单独培养时分泌IAA量之间。说明菌株混合培养,不一定都能提高某种菌株分泌IAA的活力,组合菌株分泌IAA能力可能与多种因素有关。
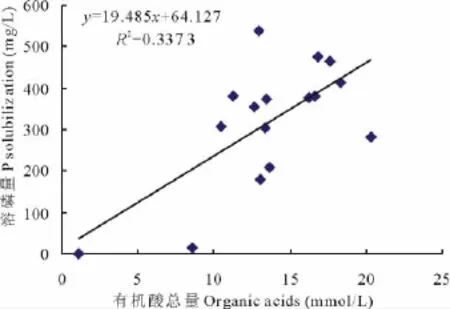
图3 溶磷量与有机酸总量的相关性(PKO培养液)Fig.3 Relationships between P solubilization and organic acids(PKO culture medium)
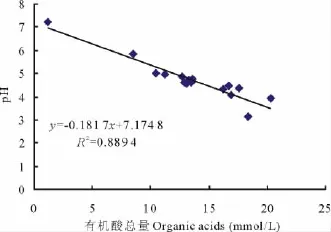
图4 p H值与有机酸总量的相关性(PKO培养液)Fig.4 Relationships between p H value and organic acids(PKO culture medium)
3 讨论
Glick[21]和 Bashan等[22]认为用植物促生菌菌剂接种植物是一种有效促进植物生长、提高作物产量的方法,PGPR可通过各种代谢途径来促进植物生长,如固氮、溶磷、产生植物激素、合成铁载体或提高对植物病原菌的生物控制等。以往对PGPR的分离、筛选和固氮、溶磷能力等功效的测定,优良菌株的种类鉴定,研制单菌株接菌剂,并对植物生长特性和品质的影响等方面开展了大量的研究,取得了一定的成果[23,24]。近年来,有些学者研究了混合接种剂对植物的促生作用,结果表明对植物的促生作用效果显著,如Esitken等[4]采用PseudomonasBA-8和BacillusOSU-142菌株,单独和混合接种欧洲甜樱桃(Prunusavium),结果表明,树干的横断面积增加,甜樱桃的重量增加,嫩枝条长度增加,并使叶片中的N、P、K、Fe、Mn和Zn的含量增加。Orhan等[7]采用BacillusM3和BacillusOSU-142混合接种剂接种木莓(Rubusswinhoei),产量增加74.9%,茎长增加15.0%,叶片中的N、P、K、Ca、Mg、Fe、Mn和Zn含量增加,土壤中有效磷的含量从1.55 mg/kg增加到4.71 mg/kg。Karlidag等[6]采 用BacillusM3、BacillusOSU-142 和MicrobacteriumFS01菌株,单独和混合接种苹果(Malus domestica)5年后,产量增加26.0%~88.0%,水果重量增加13.9%~25.5%,枝条长度增加16.4%~29.6%,枝条直径增加15.9%~18.4%。PGPR菌株单独和混合接种都能促进植物的生长和产量的增加,但混合接种的效果更好。植物根际存在有益菌群的同时,也存在许多病原菌[25-28],使得植物产量降低,造成了经济损失,目前,生防菌剂的研究与应用逐步成为热点,本研究中所用菌株对病原菌的生防性能有待进一步研究。

表5 各处理在King培养基分泌IAA浓度Table 5 Concentration of IAA secrete from treatments bacteria on King culture
本研究对4株优良PGPR菌株进行不同组合处理,测定各处理的溶磷能力,有些菌株混合比单菌株表现更好的功效,如本研究的组合AD(Hsg+lhs11)、ACD(Hsg+ls1-3+lhs11)等处理,也有菌株混合后功效降低,如组合CD(ls1-3+lhs11)等处理。综合分析各菌株组合溶解无机磷和有机磷结果发现,具有优良特性的菌株组合处理,并不是都能表现出良好的加成效应,也不是组合菌株越多越好,这是因为菌株间交互作用受多种因素综合的作用:一方面可能是各菌株本身菌体差异较大[29],多菌株同时接种后,存在营养和空间的竞争;另一方面相对单独培养,共同培养会导致生理代谢物质的差异,不能排除彼此产生的分泌物对其他菌株溶磷效果的抑制作用;第三,磷是微生物生长繁殖的必需营养元素之一,在溶磷菌和固氮菌的培养过程中,将消耗一部分可溶性磷构建微生物细胞[30]。同时采用Spot和S2试剂定性、定量测定各处理分泌IAA的能力,除组合AD(Hsg+lhs11)处理外,大部分菌株组合处理分泌IAA量为2菌株单独培养时分泌IAA量之间。说明菌株混合培养,可能提高某种菌株分泌IAA的活力,同时抑制另一菌株活力,另外菌株分泌IAA能力与培养环境及代谢途径等多种因素有关,并且,这些菌株分离自不同生境植物根际,当它们混合培养后,可能有一个相互适应的过程,或者由于生境的差异,使菌株组合不能表现出良好的促生作用,其相关的作用机理尚需进一步研究。
微生物溶磷机理非常复杂,有些微生物溶磷主要是质子起作用,有些主要是有机酸起作用,而有些菌株则2种机制都存在,还有些菌株由于生长过程中产生其他的螯合物质,从而导致磷矿粉的溶解[31]。Narsian和Patel[32]、Illmer和Schinner[33]研究表明溶磷量和培养介质p H 值之间缺乏相关性,但 Paul和Sundara[34]、康贻军等[35]、冯瑞章等[36]和王光华等[37]报道二者之间存在显著的线性相关关系。本研究发现,菌株培养液有效磷增量与p H值、有效磷增量与有机酸总量、有机酸总量与p H值之间都存在线性相关关系,表明溶磷菌分泌有机酸的溶磷作用,但溶磷菌把磷酸盐从难溶状态转化为可溶状态是一个复杂的过程,并且溶磷菌株之间溶磷机制存在多样性,溶磷菌溶磷的机理、磷酸酶的作用、释放H+的作用、蛋白质的作用等有待进一步研究。
筛选出的AD(Hsg+lhs11)、ACD(Hsg+ls1-3+lhs11)组合处理较其他组合处理具有较好的互作协同作用,表现出良好的互作效能,可作为复合微生物肥料生产的潜在优良菌株组合作一步研究,本研究采用的菌株正在进行鉴定,研究这些菌株在植物根际的定殖能力和实际促生效果将成为进一步工作的重点。
[1] Malik K A,Rakhshanda B.Association of nitrogen-fixing plant growth promoting rhizobateria(PGPR)with kallar grass and rice[J].Plant and Soil,1997,194:37-44.
[2] 黄晓东,季尚宁,Bernard G.植物促生菌技术的研究与开发[J].现代化农业,2002,279(10):19-21.
[3] Ahmad F,Ahmad I,Khan M S.Screening of free-living rhizospheric bacteria for their multiple plant growth promoting activities[J].Microbiological Research,2008,163(2):173-181.
[4] Esitken A,Yildiz H E,Ercisli S,etal.Effects of plant growth promoting bacteria(PGPB)on yield,growth and nutrient contents of organically grown strawberry[J].Science Hortic-Amsterdam,2010,124:62-66.
[5] Banchio E,Bogino P C,Zygadlo J,etal.Plant growth promoting rhizobacteria improve growth and essential oil yield inOriganummajoranaL[J].Biochemical Systematics and Ecology,2008,36:766-771.
[6] Karlidag H,Esitken A,Turan M,etal.Effects of root inoculation of plant growth promoting rhizobacteria(PGPR)on yield,growth and nutrient element contents of leaves of apple[J].Scientia Horticulturae,2007,114:16-20.
[7] Orhan E,Esitken A,Ercisli S,etal.Effects of plant growth promoting rhizobacteria(PGPR)on yield,growth and nutrient contents in organically growing raspberry[J].Scientia Horticulturae,2006,110:38-43.
[8] 王富明,张彦,吴皓琼.解磷固氮菌剂的研制及其对小麦增产效应[J].生物技术,1994,4(4):15-18.
[9] 谢应先.绿发生物肥的研制原理和工业化生产[J].北京农业科学,1994,(增刊):9-15.
[10] 李玉娥,姚拓,朱颖,等.兰州地区苜蓿和红豆草根际溶磷菌筛选及菌株部分特性研究[J].中国草地学报,2009,31(1):45-50.
[11] 朱颖,姚拓,李玉娥,等.红三叶根际溶磷菌分离及其溶磷机制初探[J].草地学报,2009,17(2):259-263.
[12] 朱颖.三叶草根际溶磷特性及其促生效果研究[D].兰州:甘肃农业大学,2009.
[13] 李凤霞,张德罡,姚拓.高寒地区燕麦根际高效PGPR菌培养条件研究[J].甘肃农业大学学报,2004,39(3):316-320.
[14] Hafeez F Y,Malik K A.Manual on Biofertilizer Technology[M].Pakistan:National Institute for Biotechnology and Genetic Engineering,2000.
[15] 林启美,赵小蓉,孙炎鑫,等.四种不同生态系统中的解磷细菌数量及种群分布[J].土壤与环境,2000,9(1):34-37.
[16] 姚拓.高寒地区燕麦根际联合固氮菌研究Ⅱ固氮菌的溶磷性和分泌植物生长素特性测定[J].草业学报,2004,13(3):85-90.
[17] 任大明,张晓轩,董丹,等.拮抗菌株 Kc-t99的鉴定及其抑菌活性研究[J].生物技术通报,2011,(4):153-157.
[18] Smith K P,Goodman R M.Host variation for interactions with beneficial plant associated microbes[J].Annal Review of Phytopathology,1999,96:4786-4790.
[19] Glickmann E,Dessaux Y.A critical examination of the specificity of the Salkowski reagent for indolic compounds produced by phytopathogenic bacteria[J].Applied and Environmental Microbiology,1995,619(2):793-796.
[20] 姚自奇,兰进.杏鲍菇不同菌株生物学特性的研究[J].食用菌学报,2005,12(2):14-18.
[21] Glick B R.The enhancement of plant growth by free-living bacteria[J].Canadian Journal of Microbiology,1995,41:109-117.
[22] Bashan Y,Rojas A,Puente M E.Improved establishment and development of three Cacti species inoculated withAzospirillumbrasilensetransplanted into disturbed Urban Desert soil[J].Canadian Journal of Microbiology,1999,45:441-451.
[23] 陈春.植物根围促生菌的研究进展及在林业上的应用[J].山西林业科技,2010,39(6):33-37.
[24] 胡江春,薛德林,马成新,等.植物根围促生菌(PGPR)的研究与应用前景[J].应用生态学报,2004,15(10):1963-1966.
[25] 刘亚亚,陈垣,郭凤霞,等.掌叶大黄根腐病病原菌的分离与鉴定[J].草业学报,2011,20(1):199-205.
[26] 牛秀群,李金花,张俊莲,等.甘肃省干旱灌区连作马铃薯根际土壤中镰刀菌的变化[J].草业学报,2011,20(4):236-243.
[27] 马敏芝,南志标.黑麦草内生真菌对植物病原真菌生长的影响[J].草业科学,2011,28(6):962-968.
[28] 赵玲,柴兆祥,李金花,等.四株胡萝卜软腐欧文氏杆菌胡萝卜亚种新菌株的分离鉴定[J].草业学报,2011,20(4):244-251.
[29] 饶正华,林启美,孙焱鑫,等.解钾菌与解磷菌及固氮菌的相互作用[J].生态学杂志,2002,21(2):71-73.
[30] 林启美,王华,赵小蓉,等.一些细菌和真菌的解磷能力及其机理初探[J].微生物学通报,2001,28(2):26-30.
[31] 赵小蓉,林启美,李保国.微生物溶解磷矿粉能力与p H及分泌有机酸的关系[J].微生物学杂志,2003,23(3):5-7.
[32] Narsian V,Patel H H.Aspergillusaculeatusas a rock phosphate solubilizer[J].Soil Biology &Biochemistry,2000,32:559-565.
[33] Illmer P,Schinner F.Solubilization of inorganic phosphates by microorganisms isolated from forest soils[J].Soil Biology &Biochemistry,1992,24(4):389-395.
[34] Paul N B,Sundara rao W V B.Phosphate-dissolving bacteria in the rhizosphere of some cultivated legumes[J].Plant and Soil,1971,35:127-132.
[35] 康贻军,程洁,梅丽娟,等.植物根际促生菌的筛选及鉴定[J].微生物学报,2010,50(7):853-861.
[36] 冯瑞章,姚拓,周万海,等.溶磷菌和固氮菌溶解磷矿粉时的互作效应[J].生态学报,2006,26(8):2764-2769.
[37] 王光华,周可琴,金剑.不同碳源对三种溶磷真菌溶解磷矿粉能力的影响[J].生态学杂志,2004,23(2):32-36.

