糖耐量正常的非酒精性脂肪肝患者血糖波动特征的临床研究
姜 涛,尚 文,文 祯,付月月
非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)是指排除酒精以外的其他因素导致的肝脏弥漫性脂肪浸润,它代表了一组以三酰甘油(TG)在肝内过度贮积而引起的临床病理综合征,其范畴包括单纯性脂肪肝、非酒精性脂肪肝炎(nonalcoholic steaohepatitis,NASH)及NASH相关性肝硬化[1]。肝脏是调节和控制糖脂代谢的重要器官,文献报道NAFLD患者血糖、血脂等水平均高于健康者,且脂肪肝与2型糖尿病相互影响加重[2-3]。鉴于NAFLD与代谢性疾病及其并发症的发生和预后密切相关[3-5],因此临床上全面了解NAFLD人群体内血糖波动的特点,勾勒其血糖谱,对合理干预措施的制定有着重要意义。本研究通过对NAFLD患者进行72 h动态血糖监测,旨在对糖耐量正常(NGT)的NAFLD患者的血糖波动特点进行初步探讨。
1 对象与方法
1.1 研究对象 在2011年11月于我院体检中心进行体检的北京铁路局职工中,采用单纯随机抽样方法选取无糖尿病的NAFLD患者30例,其中男18例,女12例;年龄25~62岁,平均(49±10)岁。根据口服葡萄糖耐量试验(OGTT)结果,分为NAFLD合并糖耐量异常(IGT)组(NA-IGT组)15例,其中男8例,女7例;NAFLD合并NGT组(NA-NGT组)15例,其中男10例,女5例。另外随机选取同期无NAFLD的NGT对照者(NGT组)10例,其中男2例,女8例;年龄31~54岁,平均(43±8)岁。NA-IGT组既往有高血压者1例,高脂血症者2例,肝酶异常者2例;NA-NGT组既往有高血压者1例,高脂血症者2例,肝酶异常者1例;NGT组既往有高血压者0例,高脂血症者2例,肝酶异常者0例。
1.2 纳入及排除标准
1.2.1 糖尿病诊断标准 按照1999年世界卫生组织(WHO)制定的糖尿病诊断标准[6]筛选研究对象。OGTT空腹血糖(FPG)≥7.0 mmol/L,糖负荷后2 h血糖(2 hPG)≥11.1 mmol/L可诊断为糖尿病;FPG<6.1 mmol/L,且OGTT中2 hPG≥7.8 mmol/L且<11.1 mmol/L可诊断为IGT;FPG<6.1 mmol/L,且OGTT中2 hPG<7.8 mmol/L可诊断为NGT。
1.2.2 NAFLD诊断标准 需符合以下3条:(1)无饮酒史或饮酒折合乙醇量男性<140 g/周、女性<70 g/周;(2)除外病毒性肝炎、药物性肝病、全胃肠外营养、肝豆状核变性等可导致脂肪肝的特定疾病;(3)肝活检组织学改变符合脂肪性肝病的病理学诊断标准[1]。因肝活检在临床上推广较难,多以B超检查来代替。B超诊断标准:(1)肝区近场回声弥漫性增强(强于肾脏和脾脏),远场回声逐渐衰减;(2)肝内管道结构显示不清;(3)肝脏轻至中度肿大,边缘角圆钝;(4)彩色多普勒血流显像提示肝内彩色血流信号减少或不易显示,但肝内血管走向正常;(5)肝右叶包膜及横膈回声显示不清或不完整。具备上述第1项及第2~4项中一项者为轻度脂肪肝,具备上述第1项及第2~4项中两项者为中度脂肪肝,具备上述第1项及第2~4项中两项和第5项者为重度脂肪肝。饮酒史定义:超过5年的长期饮酒史,折合乙醇量男性>140 g/周,女性>70 g/周。乙醇量换算公式为:乙醇量(g)=饮酒量(ml)×乙醇含量(%)×0.8(乙醇比重g/cm3)。
1.2.3 排除标准 慢性病毒性肝炎史;饮酒量男性>140 g/周、女性>70 g/周;自身免疫性肝病和遗传性疾病史;甲亢、糖尿病、恶性肿瘤、药物性肝病史;全胃肠外营养史;严重肝肾功能衰竭;心脑血管疾病等。
1.3 研究方法
1.3.1 临床病史采集 所有研究对象均根据统一调查表进行问诊,包括性别、年龄、饮酒史、吸烟史、既往慢性病史(如糖尿病、高血压、冠心病、脑血管病、血脂异常、病毒性肝炎、肝毒性药物、肿瘤、手术、输血史等)、服药史、家族史(高血压、糖尿病、冠心病、脑血管病、血脂异常、脂肪肝、肥胖及遗传病史)。
1.3.2 体格检查 由有经验的内科医师测量研究对象的身高、体质量、腰围(WC)、收缩压(SBP)、舒张压(DBP),计算体质指数(BMI)。
1.3.3 实验室指标检测 禁食水8~12 h,于次日清晨经肘静脉抽血,由本院检验科统一检测丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、TG、总胆固醇(TC)、低密度脂蛋白(LDL)、FPG、空腹胰岛素(FINS),然后5 min内将250 ml溶有75 g无水葡萄糖的水服完,留取0.5、2 h静脉血检测血糖(0.5 hPG、2 hPG)、胰岛素(0.5 hINS、2 hINS),计算胰岛素抵抗指数(HOMA-IR)、早时相胰岛素分泌指数(△I30/△G30)。HOMA-IR=FPG×FINS/22.5,△I30/△G30=糖负荷后0.5 h胰岛素升高值(△I30)/糖负荷后0.5 h血糖升高值(△G30)[3]。
1.3.4 B超检查 采用日本产Aloka α10超声显像仪,探头频率为3.5 MHz,由体检中心影像学主治医师以上人员操作。
1.3.5 动态血糖监测
1.3.5.1 仪器及步骤 动态血糖监测系统(CGMS)使用美国美敦力公司(Medtronic MiniMed公司)CGMS System Gold MMT-7102W,指尖血糖采用罗氏公司血糖仪测定。安装步骤如下:将感受器从4 ℃冰箱取出,室温下放置30 min;患者平卧位,注射部位用75%乙醇消毒2次,自然晾干;使用助针器将感受器注入腹部皮下,将感受器与主机相连;待电流信号稳定且在5~200 nA时拔出针芯,使用3M胶布固定感受器;每日四次输入空腹及睡前指尖血糖值校正,每日三次餐前输入“FOOD”就餐事件。
1.3.5.2 患者教育 采用固定的专科医生进行相关知识的教育,具体内容包括:使每一位受试者均能操作血糖仪测定指尖血糖,并且按照推荐的时间范围完成测定并正确输入CGMS。每天至少正确输入四个指尖血糖值;所有受试者在佩戴CGMS期间要求一日三餐定时定量;正确填写患者日志,如进食第一口饭的时间以及运动等。
1.3.5.3 数据准确性要求 当指尖血糖值之间的差值≥5.6 mmol/L时,平均绝对差(MAD)≤28%且相关系数≥0.79;当指尖血糖之间的差值<5.6 mmol/L时,MAD≤18%。佩戴3 d后,取下动态记录器,通过专用软件下载CGMS数据并进行分析。
1.3.5.4 CGMS的评估参数 (1)血糖水平:平均血糖水平(MBG):24 h血糖的平均值;血糖≥7.8 mmoL/L的时间百分率(PT7.8);血糖≤3.9 mmoL/L的时间百分率(PT3.9);早、午、晚三餐前1 h的平均血糖值(早、午、晚餐前1 h血糖);早、午、晚三餐后3 h的平均血糖值(早、午、晚餐后3 h血糖)。(2)日内血糖波动:最大血糖波动幅度(LAGE):日内最大和最小血糖值之差;血糖水平标准差(SDBG):取受试者连续48 h血糖标准差;平均血糖波动幅度(MAGE):取受试者CGMS 48 h监测期间血糖波动幅度大于1个标准差的为有效波动,以波动峰值到谷值的方向计算血糖波动幅度,取所有有效波动血糖波动幅度的平均值;有效血糖波动频率(FGE):所有有效波动的波动次数。(3)日间血糖波动:日间血糖平均绝对差(MODD):是受试者2个连续24 h监测期间CGMS相匹配测定值间的平均绝对差。
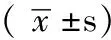
2 结果
2.1 3组一般情况比较 3组研究对象的BMI、WC、ALT、AST、TG、0.5 hPG、2 hPG、2 hINS、HOMA-IR间差异均有统计学意义(P<0.05),其余指标间差异均无统计学意义(P>0.05)。组间两两比较显示,NA-IGT组的BMI、WC、ALT、AST、TG、0.5 hPG、2 hPG、2 hINS、HOMA-IR与NGT组比较,差异均有统计学意义(P<0.05);NA-IGT组的AST、2 hPG与NA-NGT组比较,差异均有统计学意义(P<0.05)。NA-NGT组的BMI、WC、TG与NGT组比较,差异均有统计学意义(P<0.05,见表1)。
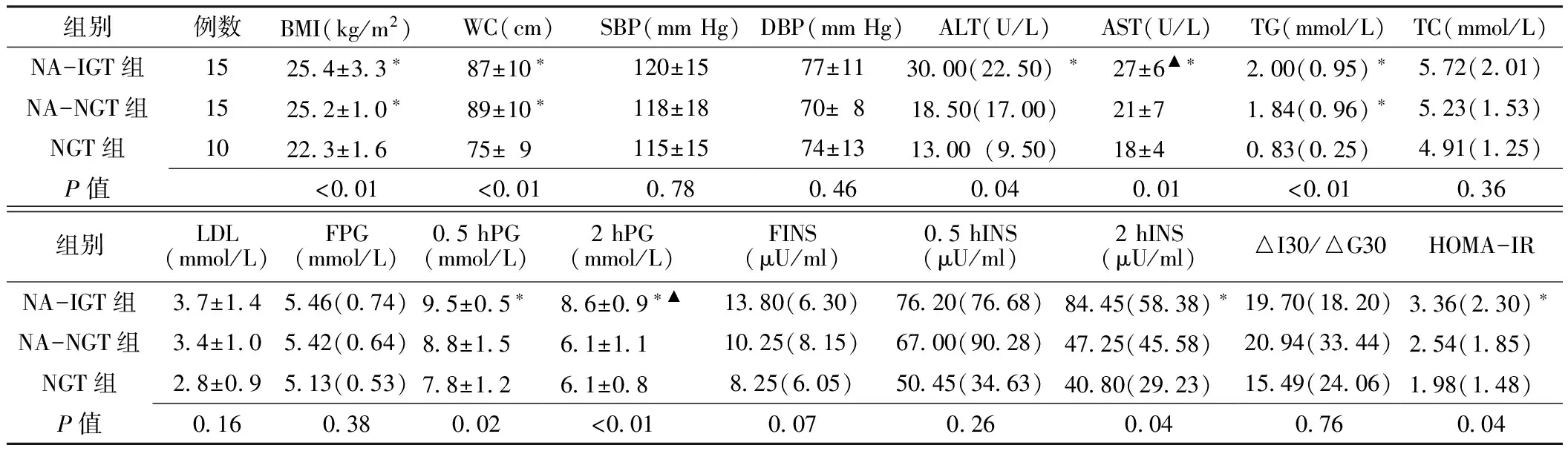
表1 3组一般情况比较
注:NA-IGT组=非酒精性脂肪肝(NAFLD)合并糖耐量异常(IGT)组,NA-NGT组=NAFLD合并糖耐量正常(NGT)组,NGT组=无NAFLD的NGT组,BMI=体质指数,WC=腰围,SBP=收缩压,DBP=舒张压,ALT=丙氨酸氨基转移酶,AST=天门冬氨酸氨基转移酶,TG=三酰甘油,TC=总胆固醇,LDL=低密度脂蛋白,FPG=空腹血糖,0.5 hPG=糖负荷后0.5 h血糖,2 hPG=糖负荷后2 h血糖,FINS=空腹胰岛素,0.5 hINS=糖负荷后0.5 h胰岛素,2 hINS=糖负荷后2 h胰岛素,△I30/△G30=糖负荷后0.5 h胰岛素升高值(△I30)/糖负荷后0.5 h血糖升高值(△G30),HOMA-IR=胰岛素抵抗指数;与NGT组比较,*P<0.05;与NA-NGT组比较,▲P<0.05
2.2 3组血糖波动特征比较 (1)血糖水平:3组研究对象的MBG、早餐后3 h血糖、晚餐前1 h血糖、晚餐后3 h血糖、PT7.8间差异均有统计学意义(P<0.05),其余指标间差异均无统计学意义(P>0.05)。组间两两比较显示,NA-IGT组的MBG、早餐后3 h血糖、晚餐前1 h血糖、晚餐后3 h血糖及PT7.8与NGT组比较,差异均有统计学意义(P<0.05);晚餐前1 h血糖、晚餐后3 h血糖与NA-NGT组比较,差异亦均有统计学意义(P<0.05)。NA-NGT组的早餐后3 h血糖与NGT组比较,差异有统计学意义(P<0.05)。(2)日内血糖波动:3组研究对象的LAGE、MAGE、SDBG间差异均有统计学意义(P<0.05),FGE间差异无统计学意义(P>0.05)。组间两两比较显示,NA-IGT组的LAGE、MAGE、SDBG与NGT组比较,差异均有统计学意义(P<0.05);NA-NGT组的SDBG与NGT组比较,差异有统计学意义(P<0.05)。(3)日间血糖波动:3组研究对象的MODD间差异无统计学意义(P>0.05,见表2)。
2.3 3组CGMS血糖图比较 NGT组全天血糖波动在4.97~6.03 mmol/L,血糖曲线比较平缓。NA-NGT组全天血糖波动在4.72~7.13 mmol/L,基线血糖水平上移。NA-IGT组血糖波动在5.45~7.68 mmol/L,基线血糖水平较NA-NGT组略有升高。三组餐后血糖均出现3个高峰,且最高峰均位于晚餐后,NA-IGT组及NA-NGT组存在明显的餐后血糖高峰。三组血糖低谷均在3~4点间,但凌晨0~4点NA-NGT组血糖最低。血糖在0:00~4:00维持在较低水平,3组空腹血糖接近。从图1中可以看出,NA-IGT组血糖波动幅度较大,NA-NGT组次之。
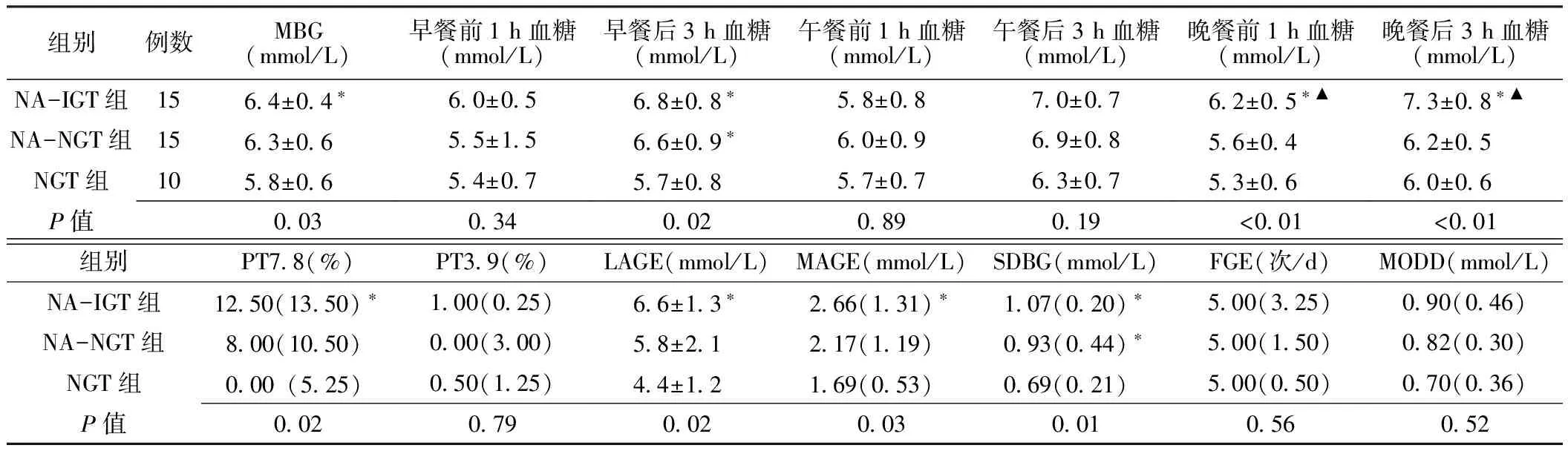
表2 3组血糖波动特征比较
注:MBG=平均血糖水平,PT7.8=血糖≥7.8 mmol/L的时间百分率,PT3.9=血糖≤3.9 mmol/L的时间百分率,LAGE=最大血糖波动幅度,MAGE=平均血糖波动幅度,SDBG=血糖水平标准差,FGE=有效血糖波动频率,MODD=日间血糖平均绝对差;与NGT组比较,*P<0.05;与NA-NGT组比较,▲P<0.05
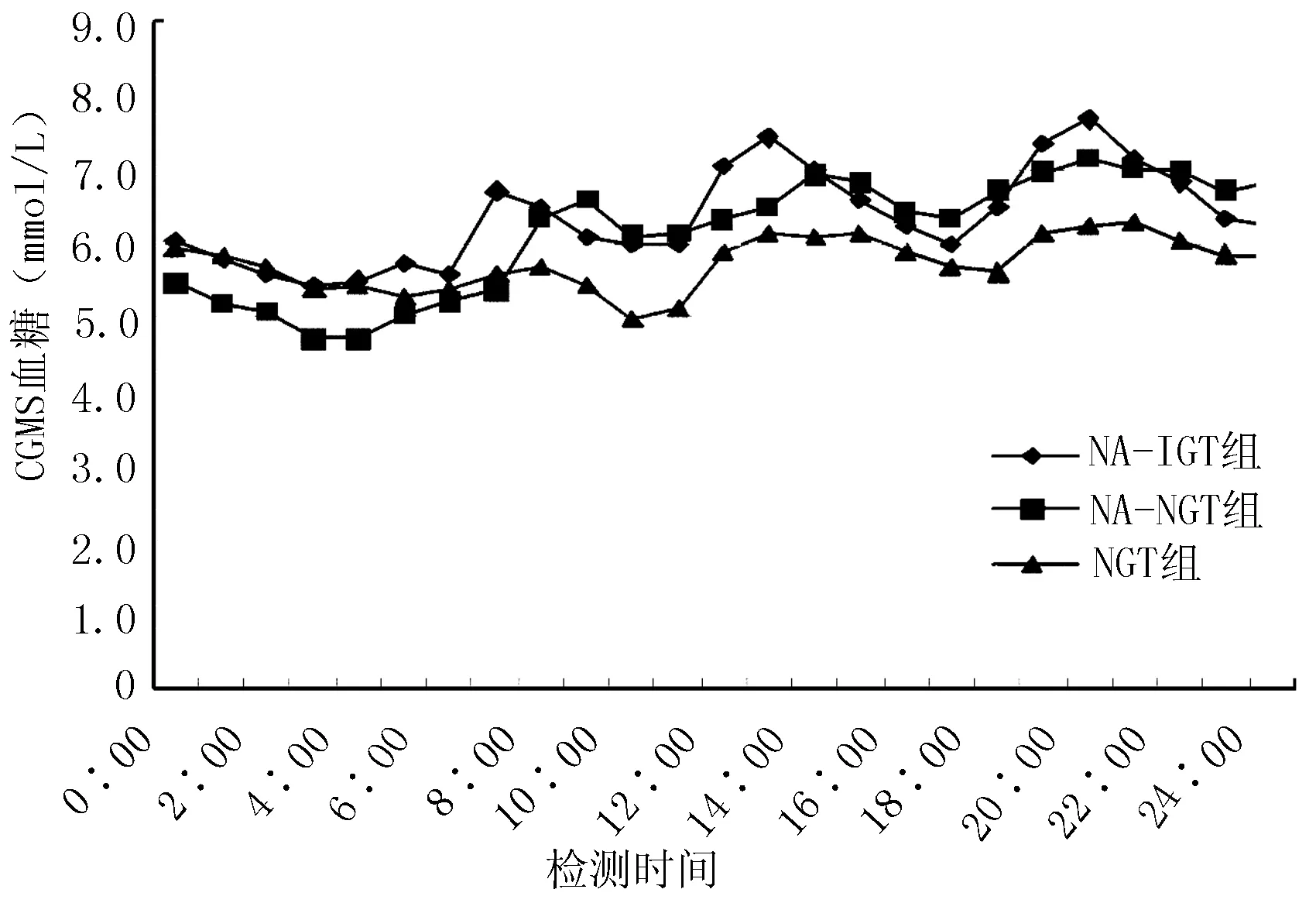
注:CGMS=动态血糖监测系统
图1 3组动态血糖波动图
Figure1 Dynamicglucose fluctuations among three groups
3 讨论
NAFLD是指除外酒精和其他明确损肝因素所致的,以弥漫性肝细胞大泡性脂肪变性为主要特征的临床病理综合征,目前NAFLD的患病率在逐渐升高。在西方国家,NAFLD的患病率在普通人群中为10%~24%,我国2005年上海地区成人NAFLD的患病率为17.29%[7],在过去的10年,我国发达地区成人NAFLD的患病率增加了一倍[8-9]。
目前认为NAFLD与代谢综合征(MS)密切相关[10-12],2004年世界胰岛素抵抗研讨会决定将NAFLD列入构成MS的主要条件,NAFLD被认为是MS在肝脏的表现。NAFLD的发生发展与肥胖、2型糖尿病、高脂血症及心血管疾病等相关危险因素密切相关,NAFLD相关的疾病谱在不断扩大[13-15]。Fan等[16]将3 175例人群分为NAFLD组和非NAFLD组,发现NAFLD组的年龄、BMI、WC、血压均高于非NAFLD组,且肥胖、糖尿病、高血压、血脂异常的发生率均高于对照组。本研究发现,NAFLD组较非NAFLD组的BMI、WC、TG及餐后血糖升高,与文献报道一致,提示NAFLD与MS及各组分关系密切,两者互为因果。在NAFLD患者中,存在胰岛素抵抗、氧化应激、脂质过氧化和炎症损伤等诱发和加重外周胰岛素抵抗和全身的低度炎性反应,促进2型糖尿和动脉硬化的发病[17]。此外,肥胖、高胰岛素血症、高血糖以及脂肪因子改变及其所致肝脂肪变同样也参与其他慢性肝病患者肝脏炎症和纤维化的发病[18]。
糖代谢主要分为糖的分解代谢(包括糖酵解、糖的有氧氧化)、糖原合成与分解、糖异生以及其他个别代谢途径(包括磷酸戊糖途径、糖醛酸途径等)。正常时,血液中的葡萄糖水平在3.9~6.1 mmmol/L波动。血糖的来源主要有从肠道吸收、肝糖原分解和肝脏的糖异生,其去路则为各组织细胞的摄取利用。另外,脂肪代谢和氨基酸代谢与血糖水平也密切相关。这些代谢途径的调节主要依靠激素的作用,其中最主要的是胰岛素和胰高血糖素。胰岛素可促进周围组织细胞对葡萄糖的摄取利用,加速糖原合成和糖的有氧氧化;抑制糖原的分解,抑制糖异生,减少脂肪酸动员向葡萄糖转化,由此降低血糖[19]。肝脏是代谢的重要器官,对血糖水平的调节有至关重要的作用。肝脏对血糖的调节主要表现在糖原合成分解、糖异生及其贮藏和对作为能源的葡萄糖的摄取、利用及释放。肝脏摄取来自肠道吸收的葡萄糖,这个过程主要是借助肝细胞膜内外的葡萄糖浓度差进行单纯扩散,葡萄糖进入肝细胞后由葡萄糖输送体加以转运。肝脏摄取葡萄糖量的多少和快慢取决于血糖值、葡萄糖输送体的数目和活性及葡萄糖激酶活性等。进入肝细胞内的葡萄糖的代谢率、糖原合成分解及糖异生则受激素(尤其是胰岛素和胰高糖素)的调节。胰岛素与靶细胞膜上胰岛素受体结合后可发生一系列变化,激素与受体结合形成复合物,在局部被包被而内部化,其后可能通过磷酸化连锁或第二信使而发挥生物学效应。肝脏对激素代谢亦发挥一定作用。胰岛分泌的胰岛素、胰高糖素、生长抑素、胰多肽等肽类激素,它们均在糖代谢中起重要作用。这些激素分泌后,直接经门脉系统进入肝脏,肝脏成为这些激素的第一作用器官。肝脏疾病时,由于侧支循环建立、肝功能状态等的改变影响上述激素作用的发挥和代谢,给糖代谢带来一定影响[19]。
糖尿病和NAFLD关系密切,NAFLD是2型糖尿病的重要危险因素。NAFLD患者常有血糖升高,Bae等[2]在对无糖尿病的人群进行随访4年的临床研究中发现,糖尿病的总发生率在基线无NAFLD人群中为3.7%,在基线患NAFLD的人群中达到9.9%。NAFLD能够明显增加2型糖尿病并发症的发病率。无NAFLD的2型糖尿病患者中冠状动脉疾病、脑血管疾病和周围血管疾病的患病率分别为18.3%、13.3%和10%,而合并NAFLD的2型糖尿病患者中上述疾病的患病率上升至26.6%、20%和15.4%[20]。本研究结果显示,虽然NAFLD患者糖耐量正常阶段OGTT结果与非NAFLD患者无差别,但是其餐后血糖已经较非NAFLD患者升高,并且提示胰岛素抵抗及胰岛素分泌的指标也高于非NAFLD患者。本研究通过72 hCGMS发现在糖耐量正常的患者中,其MBG、三餐前1 h的血糖、午餐及晚餐后3 h的血糖高于非NAFLD患者,但差异无统计学意义;早餐后3 h血糖高于非NAFLD患者,差异明显。这说明在NAFLD患者中,虽然其OGTT结果未达到诊断IGT的标准,但是在糖耐量正常的NAFLD患者就已经存在血糖升高的情况。国内卞华等[3]报道,应用磁共振波谱分析测定肝脏脂肪含量发现,在糖代谢和脂质代谢正常的人群中约有30%的人肝脏脂肪含量超过正常,并且发现这部分受试者的TG水平和全天血糖谱开始正常范围内升高,高密度脂蛋白胆固醇水平开始正常范围内降低,提示肝脏脂肪沉积2型糖尿病的发病机制,支持上述的观点。这就提示我们应对NAFLD患者进行早期干预、积极有效的治疗,延缓或阻止糖耐量异常及糖尿病的发生。
血糖波动是血糖水平在峰-谷值之间震荡的非稳定状态,既包括1 d之内患者血糖变化状况,也包括在较长一段时间内比较显著的血糖变化。血糖波动评价指标包括日内和日间血糖波动的指标。日内血糖波动的主要原因是进餐引起的餐后血糖波动,主要评价指标为MAGE和SDBG。其中MAGE是指24 h内血糖波动幅度大于1倍SDBG的有效波动幅度的均值,计算方向为第一个有效波动方向[5]。由于“滤波”作用去除了其他干扰因素引起血糖波动的影响,MAGE是目前客观反映血糖波动特性的首选指标,且不依赖于整体血糖水平的变化。SDBG反映所有血糖测定值的离散程度。日间血糖波动包括空腹血糖波动和餐后血糖波动,成因包括每天饮食量、种类、进餐开始时间、进餐持续时间、加餐方式不同以及降糖药物的药代动力学因素等,其主要评价指标为MODD。MODD是指相邻2 d相匹配的血糖数值绝对差的平均值,反映日间各点血糖变化的均量,不依赖于日内血糖的波动;正常人由于胰岛功能健全,外周组织对胰岛素敏感,一系列的神经内分泌调控机制协同作用,血糖波动于一个相对狭窄的波谱范围内。本研究发现,与非NAFLD者相比,NAFLD患者的血糖波动幅度增大,通过对3组血糖波动的特征进行分析发现,NAFLD患者血糖波动指标均较非NAFLD患者升高,其MBG、LAGE、MAGE、SDBG、三餐前1 h的血糖、三餐后3 h的血糖均高于对照组,且早餐后3 h血糖和SDBG有差异。这说明在NAFLD患者糖耐量正常阶段,不仅血糖水平升高,并且血糖波动幅度增大,提示我们不仅要对NAFLD患者早期干预、积极治疗,防止IGT的发生;而且对于这部分患者虽然OGTT结果正常、但是其早餐后3 h血糖已经与非NAFLD患者有明显差异者,监测早餐后3 h血糖评估糖代谢情况有重要临床意义及实用价值。所以,本研究认为在NAFLD患者糖耐量正常阶段就有高血糖及血糖波动幅度增大,不仅要对NAFLD患者进行早期干预,还要注意其早餐后3 h血糖监测,这对于尽早发现这部分患者糖代谢异常情况有重要指导意义和实用价值。
1 中华医学会肝脏病学分会脂肪肝和酒精性肝病学组.非酒精性脂肪性肝病诊疗指南(2010年修订版)[J].中华肝脏病杂志,2010,18(3):1632-1666.
2 Bae JC,Rhee EJ,Lee WY,et al.Combined effect of nonalcoholic fatty liver disease and impaired fasting glucose on the development of type 2 diabetes:A 4-year retrospective longitudinal study [J].Diabetes Care,2011,34(3):727-729.
3 卞华,林寰东,饶圣祥,等.肝脏脂肪含量与胰岛素抵抗及胰岛β细胞功能的关系[J].中华内分泌代谢杂志,2010,26(7):535.
4 周健,李红,杨文英,等.正常糖调节人群早期相胰岛素分泌与血糖波动的关系[J].中华糖尿病杂志,2009,1(2):89-93.
5 Service FJ,Molnar GD,Rosevear JW,et al.Mean amplitude of glycemic excursions,a measure of diabetic instability[J].Diabetes,1970,19(9):644-655.
6 世界卫生组织.2型糖尿病诊断标准[Z].1999.
7 范建高,朱军,李新建,等.上海市成人脂肪肝患病率及其危险因素流行病学调查[J].中华肝脏病杂志,2005,13(2):83-88.
8 Wang Z,Xia B,Ma C,et al.Prevalence and risk factors of fatty liver disease in the Shuiguohu district of Wuhan city,central China[J].Postgrad Med J,2007,83(977):192-195.
9 Fan JG,Li F,Cai XB,et al.The importance of metabolic factors for the increasing prevalence of fatty liver in Shanghai factory workers[J].J Gastroenterol Hepatol,2007,22(5):663-668.
10 Marchesini G,Bugianesi E,Forlani G,et al.Nonalcoholic fatty liver,steatohepatitis,and the metabolic syndrome[J].Hepatology,2003,37(4):917-923.
11 Hamaguchi M,Kojima T,Takeda N,et al.The metabolic syndrome as a predictor of nonalcoholic fatty liver disease[J].Ann Intern Med,2005,143(10):722-728.
12 Almeda-Valdes P,Cuevas-Ramos D,Aguilar-Salinas CA.Metabolic syndrome and non-alcoholic fatty liver disease[J].Ann Hepatol,2009,8(1):18-24.
13 范慧,张鹏睿,徐援.2型糖尿病合并非酒精性脂肪肝与胰岛素抵抗及心血管病变发生的关系研究[J].中国全科医学,2011,14(1):147.
14 Dixon JB,Bhathal PS,O′Brien PE.Nonalcoholic fatty liver disease:Predictors of nonalcoholic steatohepatitis and liver fibrosis in the severely obese[J].Gastroenterology,2001,121(1): 91-100.
15 张喜婷,胡玲,王宁,等.2型糖尿病并发非酒精性脂肪肝的危险因素及其与糖尿病大血管病变的相关性研究[J].中国全科医学,2012,15(4):1332.
16 Fan JG,Zhu J,Li Xj,et al.Prevalence of and risk factors for fatty liver in general population of Shang hai,China[J].J Hepatology,2005,43:508-514.
17 Fan JG.Impact of non-alcoholic fatty liver disease on accelerated metabolic complications [J].J Dig Dis,2008,9(2):63-67.
18 Bugianesi E.Nonalcoholic fatty liver disease (NAFLD) and cardiac lipotozicity: Mother piece of the puzzle[J].Hepatology,2008,47(1):24.
19 沈稚舟.肝脏疾病与糖代谢异常[J].国外医学内科学分册,1994,21(6):248-250.
20 Targher G,Bertolini L,Padovani R,et al.Prevalence of nonalcoholic fatty liver disease and its association with cardiovascular disease among type 2 diabetic patients[J].Diabetes Care,2007,30(5):1212-1218.

