原发性肾小球疾病患者血红素氧合酶-1的表达及其与患者临床特征的关系研究
徐 瑞,张爱平
肾小球疾病是最常见的疾病之一,是导致终末期肾病的最主要病因。血红素氧合酶(HO)是血红素降解为胆绿素、一氧化碳(CO)和Fe2+的起始酶和最为重要的限速酶,血红素氧合酶-1(HO-1)是其诱导型,对于肾脏来说是一种细胞保护因子,能抑制甚至逆转肾小管间质纤维化[1]。本研究通过检测原发性肾小球疾病患者肾组织和尿液中HO-1的表达,分析其与患者临床特征的关系,为肾小球疾病肾间质纤维化的防治提供理论依据。
1 资料与方法
1.1一般资料选择2012年11月—2013年3月在我院住院并通过临床表现及肾活检确诊的原发性肾小球疾病患者33例为病例组,其中男20例,女13例;年龄17~61岁,平均(38.7±15.1)岁;病程10 d~107个月。临床诊断:肾病综合征13例,慢性肾炎15例,隐匿性肾炎5例。病理诊断〔根据1995年世界卫生组织(WHO)肾脏病组织学分类标准〕:IgA肾病11例,系膜增生性肾小球肾炎10例,膜性肾病9例,膜增生性肾小球肾炎3例。所有患者在肾活检前未使用糖皮质激素、细胞毒药物等,并排除继发性慢性肾脏疾病如糖尿病肾病、紫癜性肾炎、狼疮性肾炎、乙型肝炎相关性肾炎等。所有患者知情同意,肾活检前签署知情同意书。所有患者肾活检前肾功能指标:平均动脉压(MAP)为(103.45±11.80)mm Hg(1 mm Hg=0.133 kPa),尿比重(SG)为(1.019±0.012),血清清蛋白(ALB)为(32.57±12.48)g/L,血肌酐(Scr)为(115.87±27.04)μmol/L,尿素氮(BUN)为(5.45±1.96)mmol/L,血尿酸(UA)为(326.35±79.30)μmol/L,24 h尿蛋白定量为(1.79±1.25)g,通过简化MDRD公式估测的肾小球滤过率(eGFR)为(70.62±28.18)ml·min-1·(1.73 m2)-1。
采用单纯随机抽样法选取同期在我院健康体检正常者10例为对照组,其中男5例,女5例;年龄19~52岁,平均(36.4±12.9)岁。对照组受检者的年龄、性别均与病例组患者相匹配,均无糖尿病、高血压、乙型肝炎、结核及心肾疾病史等。
1.2肾小管间质损害程度根据Katafuchi等[2]制定的肾小管间质损害程度分级标准,采用半定量积分法判断肾小管间质损害程度,共包括间质炎性细胞浸润、间质纤维化及肾小管萎缩3项,每项0~3分,总分0~9 分。无病变计0分,病变占皮质肾组织面积的0~25%计1分,26%~50%计2分,>50%计3分。根据肾小管间质损害程度将病例组分为4个亚组:A组(总分0分)8例,B组(总分1~3分)11例,C组(总分4~6分)9例,D组(总分7~9分)5例。
1.3尿标本收集所有受检者于肾活检前留取晨尿10 ml,500 r/min离心5min,弃上清液,取尿沉渣于-20 ℃保存备用。
1.4检查方法
1.4.1肾组织活检(1)光镜:常规石蜡包埋,切片(厚度为2 μm),行苏木素-伊红染色(HE染色)、高碘酸-席夫染色(PAS染色)、马松三色染色(Masson染色)、六胺银染色(PASM染色)。免疫荧光(IF):肾组织冷冻切片(厚度为4 μm),直接免疫荧光法(DIF)检测免疫球蛋白A(IgA)、免疫球蛋白G(IgG)、免疫球蛋白M(IgM)、补体C3、补体C1q、纤维蛋白相关抗原(FRA);间接免疫荧光法(IIF)检测乙肝病毒核心抗原(HBcAg)和乙肝病毒表面抗原(HBsAg),一抗和二抗均购自丹麦Dako公司。荧光强度分级:0级(-):低倍镜下不显示或高倍镜下隐约可见;1级(+):低倍镜下隐约可见,高倍镜下可见;2级(++):低倍镜下可见,高倍镜下清晰可见;3级(+++):低倍镜下清晰可见,高倍镜下耀眼;4级(++++):低倍镜下耀眼,高倍镜下刺眼。光镜和免疫荧光结果的观察均使用Leica图像成像处理系统。
1.4.2肾组织HO-1的表达采用IIF进行检测:将4 μm厚新鲜冷冻肾组织切片置于载玻片上,避光环境下滴加兔抗人HO-1多克隆抗体(1∶250,购自美国ABCAM公司,批号ab52947)后放入湿盒,37 ℃孵育1 h,磷酸盐缓冲液(PBS缓冲液)冲洗后滴加异硫氰荧光素(FITC)标记的山羊抗兔IgG抗体(1∶50,购自北京康为世纪生物科技有限公司,批号CW0114),37 ℃孵育10 min,PBS缓冲液冲洗后置于荧光显微镜下观察,以PBS缓冲液代替一抗作阴性对照。
1.4.3尿HO-1的表达采用酶联免疫吸附试验(ELISA)进行检测:将留取的尿沉渣常温复温30 min,于人HO-1 ELISA试剂盒(购自河北博海生物工程开发有限公司)待测样品孔加入尿沉渣40 μl(以PBS缓冲液稀释3倍)、抗HO-1抗体10 μl、链霉亲和素-HRP 50 μl,37 ℃温育1 h,洗涤液洗板5次,拍干后加入显色剂A 50 μl、显色剂B 50 μl,37 ℃避光显色10 min,加入终止液50 μl,以色谱酶标仪于450 nm波长下读取吸光度值(OD值)。根据标准品浓度及OD值计算标准曲线,进一步计算得出尿沉渣HO-1表达水平。
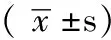
2 结果
2.1肾组织HO-1的表达及临床指标比较PBS缓冲液代替一抗作阴性对照的肾组织无HO-1阳性表达,B组和C组患者肾组织HO-1表达阳性,且均在肾小管表达(见图1)。亚组分析结果显示,4组患者肾组织HO-1表达强度、半定量积分总分、MAP、BUN、Scr、SG、eGFR比较,差异均有统计学意义(P<0.05,见表1)。
2.2尿HO-1的表达对照组尿HO-1表达水平为(145.90±55.27)ng/L,病例组为(207.83±62.51)ng/L,病例组尿HO-1表达水平高于对照组,差异有统计学意义(t=2.813,P=0.007)。亚组分析结果显示,4组患者尿HO-1表达水平比较,差异有统计学意义(P<0.05,见表1)。
2.3相关性分析Spearman相关分析结果显示,肾组织HO-1表达强度与半定量积分总分呈负相关,与eGFR呈正相关,与其他变量无直线相关性(见表2);Pearson相关分析结果显示,尿HO-1表达水平与半定量积分总分呈正相关,与其他变量无直线相关性(见表3)。

表1 各亚组肾组织和尿液HO-1的表达及临床指标分析结果比较
注:与A组比较,*P<0.05;与B组比较,△P<0.05;与C组比较,▲P<0.05;eGFR=估测的肾小球滤过率
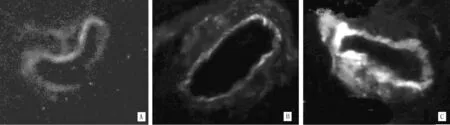
注:A:表达强度(±),B:表达强度(+),C:表达强度(++)

图1 HO-1在原发性肾小球疾病患者肾组织的表达(间接免疫荧光,×400)

表3 尿HO-1表达水平与其他变量的相关性分析
3 讨论
HO是人类和哺乳动物体内广泛存在的一种氧合酶,能够分解血红素,产生等摩尔的胆红素、CO和Fe2+,有着十分重要的生物学作用[3]。HO的同工酶有3种形式:HO-1、血红素氧合酶-2(HO-2)和血红素氧合酶-3(HO-3)。HO-1是HO的诱导型,又称热休克蛋白32(HSP 32),主要分布在组织细胞微粒体内。HO-1是反映细胞氧化损伤最敏感的指标之一[4],在感染、缺氧、损伤等多种刺激下可在短期内被诱导高表达[5],参与包括呼吸系统、循环系统、消化系统、内分泌以及肾脏系统等多系统疾病的发生和发展[1,6],发挥抗炎、抗氧化、免疫调节、抗凋亡、抑制黏附分子表达和改善组织微循环等作用。
正常情况下,肾脏可低水平表达HO-1,虽然其在肾脏皮质的近端小管、远端小管,髓质的集合管、髓袢上皮细胞内均可表达[7],但HO-1主要在肾小管表达,当肾脏受到损伤时其表达更加明显。在人类多种肾脏损伤中如梗阻型肾病[8]、急性肾损伤[9]、膜性肾病[10]、抗基底膜肾病[11]、移植肾[12]、肾癌[13]等均可见HO-1表达于近端小管,肾损伤中HO-1的不同表达部位取决于HO-1所受到的刺激反应,但仍主要表达于肾小管。一方面由于血红蛋白在近端小管分泌导致近端小管产生HO-1,另一方面可能是由于肾脏近端小管较系膜细胞更易受到氧化应激因素的影响,且更依赖HO-1的细胞保护作用[14],还可能因为HO-1在防止肾小管上皮细胞损伤中发挥着重要的作用[15]。本研究中病例组有20例原发性肾小球疾病患者的肾组织HO-1表达阳性,且均在肾小管表达,肾小球及肾间质未见HO-1表达,与上述研究相符。
HO-1作为体内存在最广泛且对细胞氧化损伤最敏感的抗氧化防御酶,在受到氧化应激的刺激后可大量分泌,进而发挥抑制炎症反应、保护血管内皮细胞等抗氧化作用。1997年,Durante等发现HO-1能抑制甚至逆转肾小管的间质纤维化,之后陆续的研究也证实了这种观点。对肾小管内HO-1进行诱导可以显著减轻细胞氧化损伤,降低氧化应激标志物表达水平[16]。一些诱导型横纹肌溶解症患者在组织受伤后会出现血红素聚集于肾脏的现象,实验证明,如果没有HO-1的保护,这些物质会对肾脏产生严重毒性[17]。HO-1降解血红素的产物中的CO、Fe2+是诱导型一氧化氮合成酶(iNOS)的两种负性调节剂,可以通过降低iNOS的活性进而发挥对肾脏细胞的保护作用;肾小球肾炎患者肾小管产生HO-1后能抵抗肾小管损伤。HO-1的缺失可使肾小管转化生长因子β(TGF-β)的表达、炎症反应和肾小管上皮-间质转分化(EMT)增多,间接促进梗阻性肾病的纤维化。Shin等[18]研究发现,异硫氰酸盐(抗氧化防御系统调控基因NRF2的激活剂)能阻止EMT基因转变,而此改变与HO-1的调节密切关,提示HO-1可通过NRF2基因进来调节EMT,进而抑制肾间质的纤维化。本研究结果显示,不同肾小管间质损害的原发性肾小球疾病患者肾组织的HO-1表达强度存在差异,表明肾间质纤维化早期就有HO-1的表达,其可能起到阻止肾间质纤维化的作用,C组患者肾组织HO-1表达强度低于B组,D组低于C组,分析其原因可能是由于HO-1的缺失促进了肾小管TGF-β的表达、炎症反应和EMT,进而加重了肾间质纤维化。
Yokoyama等[19]测定了61例肾脏疾病患者及健康人尿沉渣HO-1的表达水平,并与尿β2微球蛋白(uβ2MG)和白介素6(IL-6)进行比较,以进一步研究肾小管损伤与HO-1的关系,患者的临床诊断包括肾脏疾病综合征、非肾小球血尿、IgA肾病、间质性肾炎、急性肾小球肾炎、溶血性尿毒症综合征、川崎病。研究发现,uβ2MG在具有高细胞因子血症的间质性肾炎、溶血性尿毒症综合征中增高;虽然IL-6和 HO-1在炎性肾脏疾病患者尿液中均表达升高,但HO-1出现得更早,变化幅度也更大。因此,肾脏损伤患者尿液中HO-1较uβ2MG和IL-6出现得更早也更加敏感,尿HO-1可能是评估肾脏疾病小管间质炎性损伤程度的一个实用的、新颖的、无创伤性的生物标记物。本研究结果显示,不同肾小管间质损害的原发性肾小球疾病患者尿HO-1表达水平存在差异,且C组尿HO-1表达水平高于B组,D组高于C组,与上述研究结果一致,表明尿沉渣HO-1表达水平可能作为早期评估肾间质纤维化程度的一个重要指标,但其具体作用机制仍需进一步研究。
HO早在1964年就被发现并命名,但既往研究多集中于HO降解血红素作用方面,直到2001年才有研究报道HO与肾脏疾病的关系,尿HO-1表达方面的研究极少。本研究观察了不同肾小管间质损害的原发性肾小球疾病患者肾组织及尿HO-1的表达,分析其与患者临床特征之间的关系,具有一定创新性,但样本量较小,且未与公认的反映肾间质纤维化程度的指标进行对比,肾组织及尿HO-1表达的具体作用机制仍需进一步研究。
1郑和昕,顾维正.血红素氧合酶的临床研究[J].国外医学:内科学分册,2002,29(2):74-76.
2Katafuchi R,Kiyoshi Y,Oh Y,et al.Glomerular score as a prognosticator in IgA nephropathy:its usefulness and limitation[J].Clin Nephrol,1998,49(1):128.
3肖鹏,高洪,严玉霖,等.内源性一氧化碳研究进展[J].动物医学进展,2009,30(5):94-98.
4李晓峰,董艳玲,郭远瑾,等.臭苜蓿根提取物对巨噬细胞血红素氧合酶-1表达的影响[J].海南医学院学报,2009,15(6):569-571.
5Abraham NG,Kappas A.Pharmacological and clinical aspects of heme oxygenase[J].Pharmacol Rev,2008,60(1):79-127.
6Abraham NG,Cao J,Sacerdoti D,et al.Heme oxygenase:the key to renal function regulation[J].Am J Physiol Renal Physiol,2009,297(5):F1137-F1152.
7da Silva JL,Zand BA,Yang LM,et al.Heme oxygenase isoform-specific expression and distribution in the rat kidney[J].Kidney Int,2001,59(4):1448.
8Correa-Costa M,Semedo P,Monteiro AP,et al.Induction of heme oxygenase-1 can halt and even reverse renal tubule-interstitial fibrosis[J].PloS One,2010,5(12):e14298.
9Sue YM,Cheng CF,Chou Y,et al.Ectopic overexpression of haem oxygenase-1 protects kidneys from carboplatin-mediated apoptosis[J].Br J Pharmacol,2011,162(8):1716-1730.
10Wu CC,Lu KC,Chen JS,et al.HO-1 induction ameliorates experimental murine membranous nephropathy:anti-oxidative,anti-apoptotic and immunomodulatory effects[J].Nephrol Dial Transplant,2008,23(6):3082-3090.
11Datta PK,Duann P,Lianos EA.Long-term effect of heme oxygenase(HO)-1 induction in glomerular immune injury[J].J Lab Clin Med,2006,147(3):150-155.
12Li SD,Wang L,Wang KY,et al.Heme oxygenase-1 expression and its significance for acute rejection following kidney transplantation in rats[J].Transplant Proc,2011,43(5):1980-1984.
13Banerjee P,Basu A,Datta D,et al.The heme oxygenase-1 protein is overexpressed in human renal cancer cells following activation of the Ras-Raf-ERK pathway and mediates anti-apoptotic signal[J].J Biol Chem,2011,286(38):33580-33590.
14Yang Y,Ohta K,Shimizu M,et al.Selective protection of renal tubular epithelial cells by heme oxygenase (HO)-1 during stress-induced injury[J].Kidney Int,2003,64(4):1302-1309.
15Berger SP,Hünger M,Yard BA,et al.Dopamine induces the expression of heme oxygenase-1 by human endothelial cells in vitro[J].Kidney Int,2001,58(6):2314-2319.
16Poss KD,Tonegawa S.Reduced stress defense in heme oxygenase1-deficient cells[J].Proc Natl Acad Sci USA,1997,94(20):10925-10930.
17Ohta K,Yachie A,Fujimoto K,et al.Tubular injury as a cardinal pathologic feature in human heme oxygenase-1 deficiency[J].Am J Kidney Dis,2000,35(5):863-870.
18Shin DH,Park HM,Jung KA,et al.The NRF2-heme oxygenase-1 system modulates cyclosporin A-induced epithelial-mesenchymal transition and renal fibrosis[J].Free Radic Biol Med,2010,48(8):1051-1063.
19Yokoyama T,Shimizu M,Ohta K,et al.Urinary heme oxygenase-1 as a sensitive indicator of tubulointerstitial inflammatory damage in various renal diseases[J].Am J Nephrol,2011,33(5):414-420.

