β-环糊精-4-苄氧基苯酚包合物与DNA的相互作用*
龙 俊,段雷雨,王兴明,杨 欢
(西南科技大学材料科学与工程学院化学系,四川 绵阳 621010)
除了少数的病毒RNA之外,DNA也是生物体含有遗传信息的物质,而且是生物体内非常重要的生物大分子,DNA在生物体内发挥着特别重要的作用,特别是在基因的表达方面,因此它是生物遗传信息的基本载体。关于DNA的化学研究领域中,小分子化合物与DNA大分子的相互作用的研究是非常重要的,并且一直受到人们的关注。这是因为癌症的化学治疗方法最有效的方法就是直接针对肿瘤细胞的DNA[1-2],在医学中已经有人用这种方法来杀死癌细胞,如一些小分子抗癌药物顺铂,核酸剪切试剂以及具有核酸结构的荧光探针,还有一些功能小分子在特定碱基序列检测中被用作杂交指示剂[3-4]。因此,对小分子与DNA之间作用的研究,在医药学、生物学等领域都有着举足轻重的作用。目前研究小分子与DNA之间相互作用的手段[5]:分光光度法、荧光法、光散射技术、电化学分析法以及生物学法。
超分子化学是一门迅速发展起来的热门学科,超分子作用是一种以非共价键结合的分子间识别的相互作用力。在超分子化学中有三类物质很受关注,分别是环糊精、冠醚以及杯芳烃,它们均是生物模型的分子化学,其中环糊精是其中最重要的一支。
环糊精(CD)是一类含有6个及以上的D-吡喃葡萄糖单元经过α-1,4糖苷键首尾相连的键合作用形成的大环化合物。环糊精尤其具有内疏水外亲水的特殊结构能使客体分子的一些物理及化学性质发生部分改变。环糊精自身的结构以及性能与酶具有的微环境相类似,因此能够成为研究小分子与DNA相互作用的有效途径之一[6-7]。本文研究了4-苄氧基苯酚(PBP)和β-CD形成的包合物与DNA的相互作用。
1 实验部分
1.1 试剂与仪器
β-环糊精(β-CD,AR,成都科龙化工试剂厂):溴化乙锭(EB,AR,Sino-American biotec 公司产品);鲱鱼精DNA(hsDNA)(上海海洋生物技术有限公司);4-苄氧基苯酚(PBP,w≥99%,成都西亚化工股份有限公司);寡聚核苷酸(碱基序列为5’-AATCTCTCGG-3’,大连宝生物工程有限公司);Tris(0.25 mol/L)-HCl缓冲液(pH=7.4)临时配制;水为二次重蒸水,其它试剂均为分析纯。
F96-荧光分光光度计(上海分析仪器公司);Nicolet 380智能傅里叶变换红外光谱仪(美国热电尼高力公司);D/max-RB X射线衍射仪(日本理学公司);pHS-3B型酸度计(成都方舟科技开发公司); HH-601超级恒温水浴(金坛金南仪器厂);AL204型电子分析天平(上海梅勒特-托利多仪器);PHG-9075A电热恒温鼓风干燥箱(上海齐欣科学仪器有限公司);乌贝路德黏度计。
1.2 实验方法
1.2.1 荧光光谱法 所有样品先用配制好的Tris-HCl缓冲液(pH=7.4)溶解配制成高浓度溶液摇匀,然后静置,在使用的时候再稀释成所需浓度。荧光滴定中精确量取3.00 mL待测溶液加到1 cm厚的比色皿中,并用注射针每次加入相同量10 μL溶液,因加入体积过小,可以忽略体积变化对荧光光谱的影响,测定和记录每次滴定后溶液的荧光光谱。实验中,发射光谱的扫描狭缝均为5 nm,扫描间隔均为1 nm,所有实验的激发波长均为λex=441 nm。
Scatchard法[8]:配制一系列不同比例的小分子与DNA的混合溶液,其中DNA的浓度是不变的,每次比例均为Rt(Rt=[小分子]/[DNA],Rt=0,0.4,0.8,1.2),使用荧光探针EB分别滴定上述所配制溶液并记录荧光光谱变化值[9]。
1.2.2 黏度法 在室温下进行,使用乌氏贝德黏度计进行黏度法测量,将配制好的DNA溶液加入已经干燥好了的黏度计中,将黏度计垂直固定好,然后浸泡在水浴中以保持温度恒定,记录DNA流下的时间,此过程中始终保持DNA浓度不变,试验中每次使用小分子滴定结束后,待溶液混合均匀后记下溶液流下的时间,平行测量3次,取平均值,分析结果发现溶液流下时间均大于180 s。以小分子浓度为横坐标,以η/η0为纵坐标作黏度变化图,η为混合溶液相对黏度值,η0为DNA的相对黏度值。
1.2.3 包合物的制备 应用摩尔比法得出包和比,将4-苄氧基苯酚与β-环糊精按1∶1的计量关系称取并溶解在Tris-HCl缓冲液中,混合均匀,静置24 h让它们充分作用,得到β-环糊精-4-苄氧基苯酚包合物。
2 结果与讨论
2.1 荧光光谱法研究β-环糊精与PBP的包和作用
在研究超分子化学中主体与客体相互作用最常用的一种方法是荧光光谱法。倘使β-CD包和了PBP,β-CD会使得PBP的部分理化性质发生一些变化,因此会造成PBP的荧光光谱峰强度的变化或者造成红移等现象。当PBP浓度保持不变的情况下,向PBP溶液中逐渐滴加β-CD溶液,记下PBP的荧光光谱变化的过程,如图1所示,584 nm出的峰为PBP在激发波长为441 nm时的特征荧光峰,当β-CD溶液的不断加入,584 nm处的荧光峰强度明显减弱,再随着β-CD浓度的增加,会观察到荧光光谱峰强减小的幅度明显逐渐降低,导致峰强度减小是因为PBP与β-CD形成了包合物,在起始阶段β-CD浓度很低,那么需要多少β-CD就能全部包和PBP然后形成β-CD-PBP包合物,然而随着β-CD浓度的增加到一定值后,β-CD与PBP之间已经接近包和比,那么被β-CD包和的PBP将不随β-CD的加入而增加,故后面荧光值强度减小幅度会逐渐变小。为了得到β-CD与PBP的包和比,使用了摩尔比法,固定PBP浓度,在584nm处平行测定加入β-CD后引起的荧光值变化,作出摩尔比图如图2所示,由图可知β-CD与PBP之间结合比例为1∶1,即包和比为nβ-CD∶nPBP=1∶1,再利用双倒数曲线,即可以计算出β-CD包和PBP之间的包和常数为Kf= 7.39×103L·mol-1。

图1 β-CD对PBP荧光光谱的影响Fig.1 Fluorescence spectra of PBP in different concentrations of β-CDcPBP=2.00×10-5 mol/L,cβ-CD=7.50×10-4 mol/L

图2 PBP对β-CD的摩尔比图Fig.2 Mole ratio plots of β-CD-STcPBP=2.00×10-5 mol/L,cβ-CD=7.500×10-4 mol/L
2.2 荧光光谱法研究β-CD-PBP包合物与DNA的相互作用
在研究小分子与DNA作用中使用荧光光谱法[10-11],若对象小分子能够嵌入至DNA碱基对中,则导致小分子的荧光发射光谱减弱;若小分子与DNA的作用方式为静电方式,会导致小分子的荧光发射光谱增强,原因是在嵌插作用过程中,β-CD-PBP中PBP的芳香发色团嵌入到DNA碱基对之后出现π电子的堆积效应造成的,然而静电作用使得β-CD-PBP-DNA表面的电子密度增加从而导致荧光光谱增强。往β-CD-PBP溶液中逐渐滴加DNA溶液,然后扫描β-CD-PBP的荧光光谱变化的过程(图略),观察荧光值变化并记下在逐渐滴加DNA后β-CD-PBP在584 nm处的荧光强度,作出摩尔比图,结果如图3所示,从图3易可知由于加入DNA后,得知β-CD-PBP在584 nm处的荧光值不断减少,说明β-CD-PBP与DNA之间相互发生了作用然后形成了一种新的复合物[12],因此β-CD-PBP可能嵌插入了DNA之中。再根据图3所示,β-CD-PBP与DNA之间的结合比为nDNA∶nβ-CD-PBP= 1∶9。
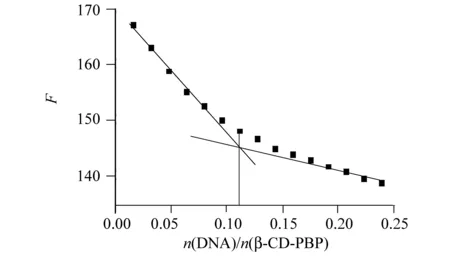
图3 β-CD-PBP对DNA的摩尔比图Fig.3 Mole ratio plots of β-CD-PBP-DNAcβ-CD-PBP=2.00×10-6 mol/L,cDNA=1.00×10-4 mol/L
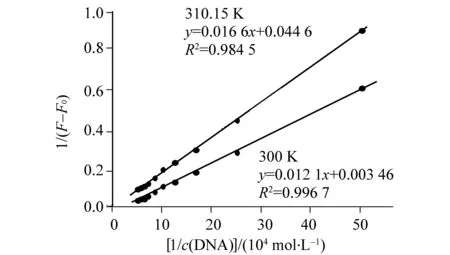
图 4 双倒数图Fig.4 Double reciprocal plotscβ-CD-PBP=2.00×10-6 mol/L,cDNA = 1.00×10-4 mol/L
2.3 β-CD-PBP包合物与DNA的相互作用间的热力学研究

2.4 EB探针法研究PBP包合物与DNA之间的相互作用
在探索小分子与DNA之间的相互作用时,检测小分子与DNA之间是否存在嵌插作用时通常用EB作为荧光探针。因为具有平面共轭结构的EB,其能专一的嵌入至DNA碱基对中,当EB嵌入至DNA中,由于DNA的内部存在疏水环境,得知水溶液对EB的荧光猝灭作用将被削弱,那么EB-DNA的荧光强度强于单独的EB溶液。若目标小分子与DNA之间存在着嵌插作用,则小分子将会和EB竞争与DNA的结合位点,结果会置换出EB,将会显现水溶液对EB的荧光猝灭作用,此时荧光强度将会明显地减弱。但是小分子以其它方式与DNA作用时,不能置换出EB,固荧光强度将保持不变。配制EB-DNA溶液并使它的浓度保持不变,在EB-DNA溶液中缓慢滴加β-CD-PBP溶液,记录观察EB-DNA荧光光谱变化(图5),从图中可以明显观察到溶液中β-CD-PBP的浓度慢慢增加时,EB-DNA的荧光强度会逐渐减弱,其结果表明β-CD-PBP置换出了DNA中的EB,进一步说明包合物β-CD-PBP与DNA之间存在着嵌插作用,即包合物β-CD-PBP会嵌入到DNA中。
2.5 磷酸盐与PBP包合物之间相互作用的研究

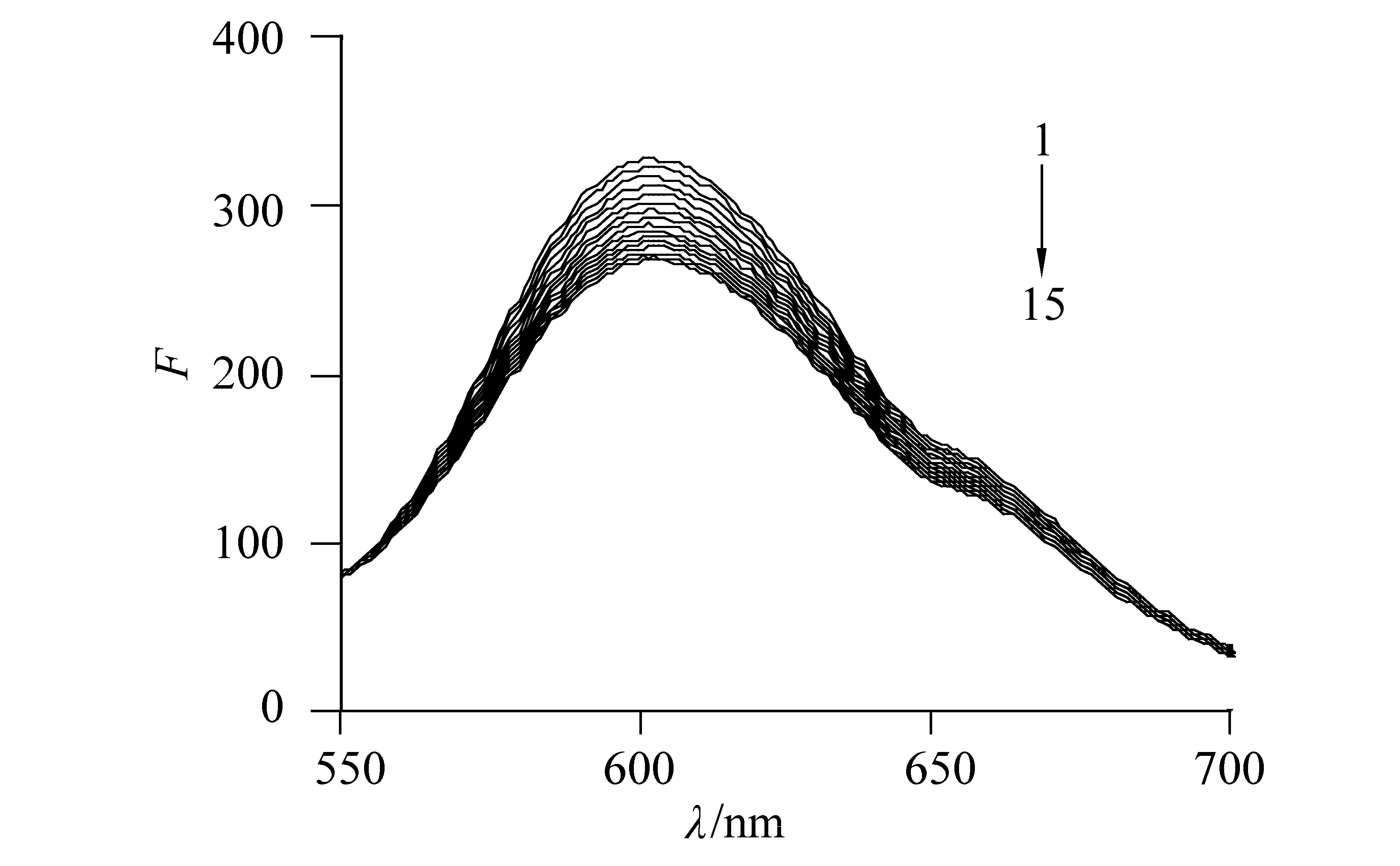
图5 β-CD-PBP对EB-DNA体系的荧光光谱影响Fig.5 Effect of β-CD-PBP on fluorescence spectra of DNA-EBcEB-DNA=1×10-5 mol/L, cβ-CD-PBP=2×10-4 mol/L

图6 磷酸盐对β-CD-PBP的荧光光谱影响Fig.6 Fluorescence spectra of β-CD-PBP in different concentration of phosphatecNa3PO4=6×10-3 mol/L, cβ-CD-PBP=2×10-4 mol/L
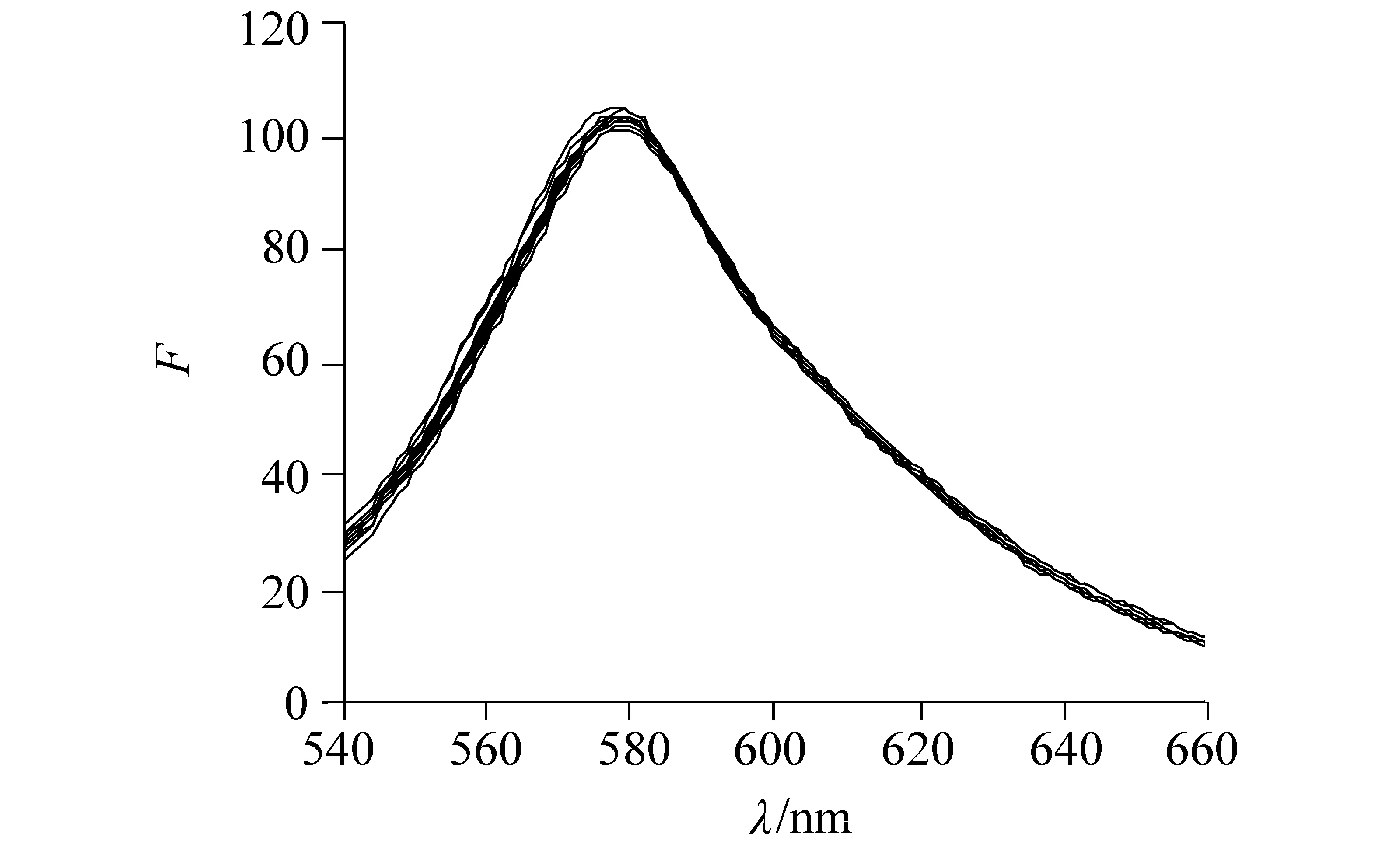
图7 寡聚核苷酸对β-CD-PBP的荧光光谱影响Fig.7 Fluorescence spectra of β-CD-PBP in different concentration of oligodeoxynucleotides cβ-CD-PBP=1×10-6 mol/L, coligodeoxynucleotides=1×10-5 mol/L
2.6 寡聚核苷酸与PBP包合物之间相互作用的研究
通过磷酸盐实验证实了PBP包合物与DNA之间的确存在静电作用,β-CD-PBP与DNA之间是否存在沟渠作用可以通过寡聚核苷酸对β-CD-PBP荧光光谱影响结果来推测。寡聚核苷酸是DNA分子中的一个短小的链状片段,也就是DNA双螺旋碱基对中的一段短小的单链碱基。寡聚核苷酸没有成对的碱基对,也没有DNA外层的磷酸骨架,则小分子只能在它的沟壑中与其发生作用,这种作用方式就是沟渠作用。寡聚核苷酸对β-CD-PBP的荧光光谱影响结果在图7所示,图中明显表明当在β-CD-PBP溶液中加入了适量的寡聚核苷酸之后,荧光光谱几乎没有任何变化,然后考虑到实验和仪器带来的误差,可以认为包合物β-CD-PBP的荧光光谱确实没有发生变化,即表明寡聚核苷酸与β-CD-PBP包合物没有发生作用,因此结果证明了包合物β-CD-PBP与DNA之间不存在沟渠作用。
2.7 β-CD-PBP包合物与DNA相互作用的黏度法研究
前面采用的方法一直是荧光光谱法来研究β-CD-PBP包合物与DNA的相互作用,意识到单一技术的可靠性,固选取流体力学——黏度法研究β-CD-PBP包合物与DNA之间的作用方式。引起DNA浓度变化的原因有其结构的变长扭结缩短变形等,而且这种变化非常的敏感,当检测时很难获得精确的晶体结构数据时,通常黏度法就是一种非常可靠而有效的方法。整个小分子完全的嵌入到DNA中时,会使得碱基对之间的空间距离变大使得DNA分子链变长,黏度就会显著增加,若小分子与DNA表面的磷酸骨架发生静电作用,而与碱基间的沟壑发生沟渠作用,这两种作用方式对DNA的结构并不产生影响,黏度值也不会发生变化。小分子若是部分的嵌入到了碱基对间,此时小分子会通过其他作用方式或者通过分子间相互作用力使得DNA双螺旋结构发生扭曲变形从而导致DNA结构变短,此时它的黏度值就会变小[15]。配制一系列不同浓度并且包含不同比例的β-CD-PBP包合物的β-CD-PBP-DNA溶液,条件为室温,分别测定其黏度并记录,分析结果如图8,探究β-CD-PBP对于DNA的黏度影响。从图8中可以看出,溶液中包合物β-CD-PBP的浓度不断增大的同时,可是DNA的黏度值在不断的减小,此现象就说明β-CD-PBP分子只是部分嵌入到了DNA碱基对中。通常情况要完全嵌入到DNA碱基对中是要求小分子为平面共轭刚性结构,可是环糊精因为是一个筒状结构却不能嵌入到碱基对中,那么嵌入到碱基对中的那小部分应为PBP中完全进入CD空腔的部分。所以,包合物β-CD-PBP与DNA之间的结合方式是以部分嵌插作用方式结合。
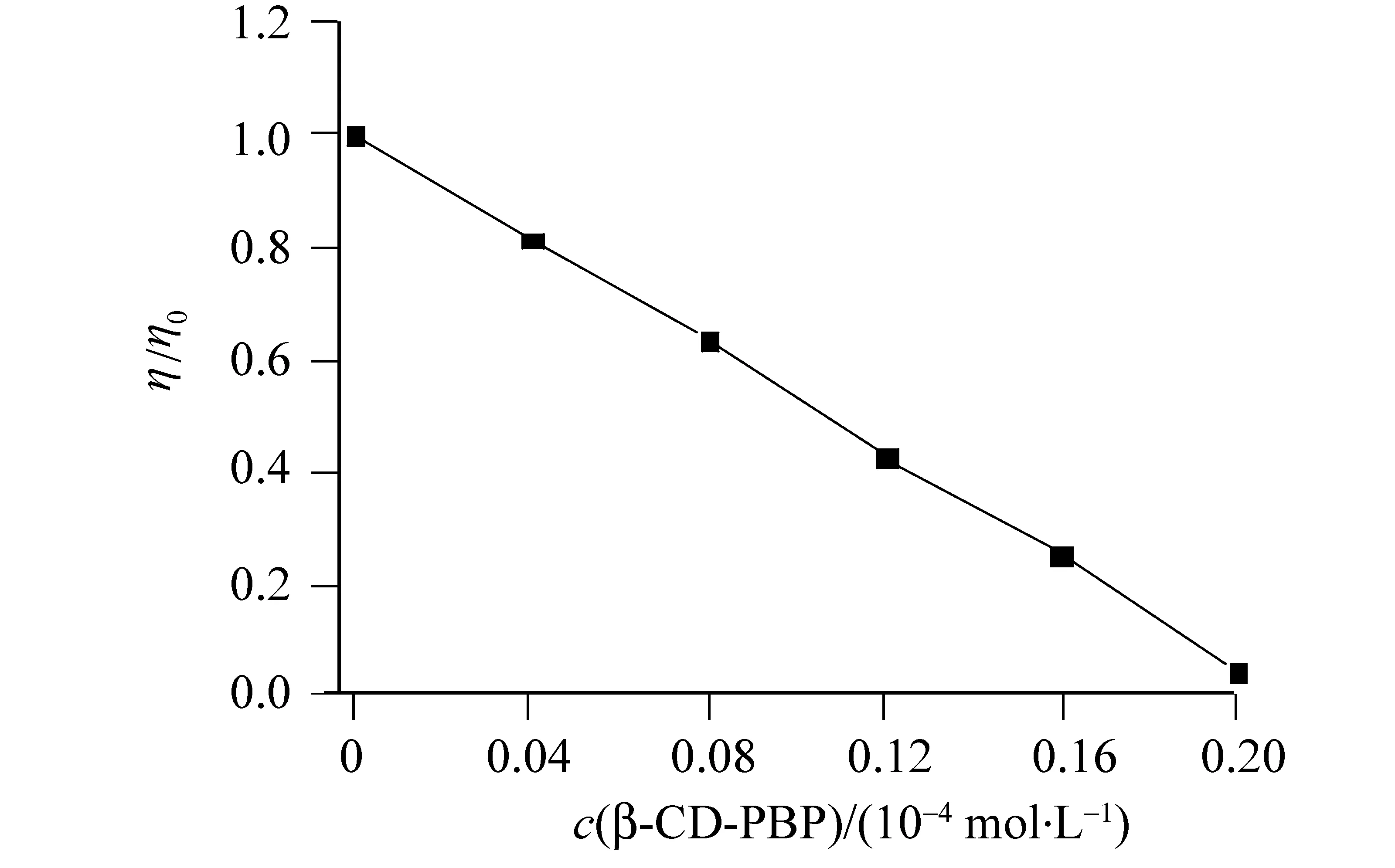
图8 β-CD-PBP对DNA的黏度影响Fig.8 Influence of concentration of β-CD-PBP on DNA viscosity cDNA=7×10-5 mol/L
2.8 Scatchard法分析研究
Scatchard法是根据荧光探针法再结合Scatchard方程分析小分子与DNA相互作用的方法。因此分析EB存在下Scatchard图有相同的K值说明包合物β-CD-PBP与DNA之间为非嵌插作用模式,即作用方式可能为沟渠作用或者静电作用,若测得Scatchard图中的n值和K值均不同说明包合物β-CD-PBP与DNA之间为嵌插作用和非嵌插作用均有的混合作用模式[15]。从表1明显得出n值和K值均不同,故β-CD-PBP与DNA之间作用方式为混合作用。
在Scatchard法中,我们还使用两种不同浓度的NaCl实验进行对比,根据溶液中的离子强度不同可以判断出物质与DNA之间是否有静电作用。
因为NaCl在缓冲溶液中将自发电离出Na+,Na+因为与DNA的磷酸骨架负离子作用在磷酸负离子周围形成紧密阳离子氛以至于小分子很难通过静电结合与DNA作用,这样也就抑制了小分子与DNA之间的静电作用,使得在高浓度NaCl溶液中中的n值小于低浓度时的n值。因此在表1中0.5 mol/L的NaCl溶液的n值低于0.1 mol/L的NaCl溶液的n值,结果证明包合物β-CD-PBP与DNA之间存在着静电作用。
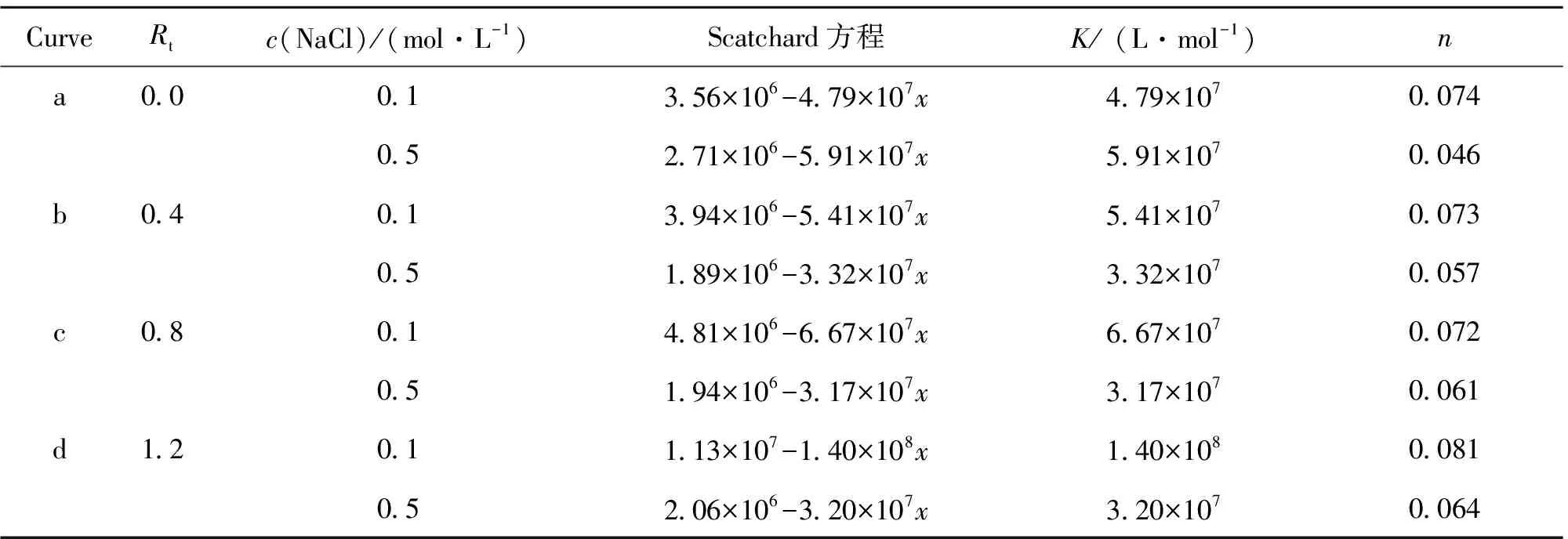
表1 β-CD-PBP与DNA相互作用的Scatchard 方程Table 1 Scatchard Equation of interaction between β-CD-PBP and DNA
3 结 论
本文研究PBP与β-CD以及β-CD-PBP与DNA的相互作用主要采用荧光光谱法和黏度法,通过一系列实验得知PBP与β-CD能形成1∶1的包合物β-CD-PBP。而且包合物β-CD-PBP能与DNA作用形成一种9∶1的新的复合物,这种复合物的生成主要是通过部分嵌插和静电作用的混合模式。荧光光谱法、探针法以及黏度法均验证了包合物β-CD-PBP与DNA存在部分嵌插,磷酸盐实验法和Scatchard法验证了静电作用,寡聚核苷酸法证明作用方式不存在沟渠作用。
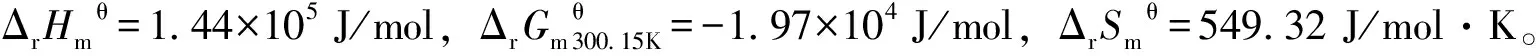
参考文献:
[1] 王兴明, 刘海萍, 石荣铭, 等. β-环糊精与中性红-铜(Ⅱ)配合物的相互作用[J].四川大学学报:工程科学版,2006,28(3):70-74.
[2] TROMMEL J S, MARZILI L G. Synthesis and DNA binding of novel water-soluble cationic methylcobalt porphyrins[J]. Inorganic Chemistry, 2001, 40(17): 4374-4383.
[3] NEBRO A J, LUQUE G, LULLA F, et, al. DNA fragment assembly using agrid-based Geneticalgorithm [J]. Comput Operat Res, 2008, 35: 2776-2790.
[4] GUO L H, YANG H H, QIU B, et, al. Capillary electrophoresis with electrochemiluminescent detection for highly sensitive assay of genetically modified organisms[J]. Analytical Chemistry, 2007, 588: 123-130.
[5] YANG H, WANG X M. Spectroscopic studies on the interaction of β-cyclodextrin-8- hydroxyquiuolineinclusion complex with herring sperm DNA[J]. Journal of Molecular Structure, 2013, 1036:51-55.
[6] NISANART C, SAOVANEE D, SAROTE S, et al. Optimization of cyclodext rin production from sago starch[J]. Biores Technol, 2004, 92: 49-54.
[7] 姚虹, 魏太保, 徐维霞,等.β-环糊精与二苯硫脲、二苯脲包结作用的紫外光谱研究[J]. 光谱学与光谱分析, 2006, 26 (9): 1664-1667.
[8] LEPCQ J B, PAOLETTI C J. A fluorescent complex between ethidium bromide and nucleic acids[J]. J Mol Biol, 1967, 27: 87-106.
[9] 王兴明, 黎泓波, 胡亚敏, 等. 苏木素与DNA相互作用的光谱研究[J]. 化学学报, 2007, 65(2): 140-146.
[10] 李志成, 王兴明, 赵娜. 酪氨酸-铒(Ⅲ)配合物与鲱鱼精DNA的作用机理[J]. 中国稀土学报, 2013, 31(2):142-147.
[11] 欧亮龙,王兴明.茜素黄R-γ环糊精包合物与鲱鱼精DNA的作用机理[J]. 中山大学学报:自然科学版, 2013, 52(1):89-93.
[12] LONG E C, BARTON J K. On demonstrating DNA intercalation acc[J]. Chem Res, 1990, 23: 271-273.
[13] 黎泓波, 拓宏桂, 王兴明, 等. 光谱学研究血卟啉与鲱鱼精DNA的相互作用[J]. 光学学报, 2008, 28(10): 2015-2021.
[14] HOWE G M, WU K C, BAUER W R. Binding of platinum and palladium metallointercalation reagents and antitumor drugs to closed and open DNAs[J]. Biochemistry, 1976, 15(19): 4339-4346.
[15] 张黔玲, 刘剑洪, 任祥忠, 等. 新型双核配合物的形成及荧光性质研究[J].高等学校化学学报,2006, 27(10): 1805-1810.
[16] 李来生, 黄志兵, 王宇晓, 等. 荧光光谱法研究对-二甲氨甲基-杯[8]芳烃与DNA相互作用[J]. 光谱学与光谱分析, 2005, 25(7): 1088-1091
[17] ROSS D P, SABRAMANIAN S. Thermodynamics of protein association reaction-forced contributing to stability[J]. Biochemistry, 1981, 20: 3096-3102.
[18] 王建红, 程鹏飞, 孙心齐, 等.N-(茄呢基哌嗪烷基)葸甲胺的合成及其与DNA作用的研究[J]. 光谱学与光谱分析, 2007, 27 (7) : 1398-1402.

