牛胚胎干细胞克隆实验中添加物及消化液对其效率的影响分析
张福全
胚胎干细胞(ES细胞)是具有全能性的哺乳动物早期胚胎细胞或原始细胞。胚胎干细胞在分化抑制的培养条件下,可以未分化状态无限增殖。近年来有关牛类ES细胞分离与克隆的研究已经取得较大进展[1-2]。笔者为探讨添加物和消化液对牛胚胎干细胞克隆效率的影响,通过从牛鲜胚内细胞团(ICM)中分离获得牛类ES细胞后进行克隆,在培养细胞中添加胰岛素生长因子和消化液,现报道如下。
1 材料与方法
1.1 牛胚采集 在自然发情期,对健康经产黑白花奶牛母进行人工受精后68 d经非手术方法从牛子宫取胚胎。将待采集胚胎的母牛固定在床位上,在尾椎硬膜外腔注射 2% 盐酸利多卡因麻醉。按规定方法在冲洗两侧子宫角。冲出的胚胎要在立体显微镜下检查。在100倍实体解剖显微镜下观察受精卵的形态、色调、分裂球的大小、均匀度、细胞的密度、与透明带的间隙以及变性情况等[3-4]。
1.2 溶液配制 细胞基础培养液:DMEM+0.1 mM 2-mercaptoethanol(在此基础上,添加不同浓度的血清及各种细胞因子);细胞基础消化液:胰蛋白酶+EDTA(在此基础上,两者浓度有所调整)。
1.2.1 饲养层制备 选取新生健康黑白花牛犊睾丸制备成纤维细胞,取3代内对数生长期MEF, 终浓度10μg/ml 丝裂霉素C处理 3.5 h, D-PBS充分洗涤,消化细胞调整细胞浓度为1×105个/ml,种植在经 0.1%明胶包被的4孔培养板中,置37 ℃、5% CO2培养箱培养待用,用前更换成胚胎干细胞培养基。
1.2.2 胚胎处理和胚胎培养条件 基础培养液为DMEM培养基+15%NBS+0.1mmol/L 0.1 μmol/L Na2SeO3+β琉基乙醇。室温下培养牛胚胎及ES细胞。
1.2.3 ICM初次传代 将ICM细胞体外培养6~7 d后,当细胞繁殖到一定数目时,选择未分化的细胞进行传代。操作如下:用玻璃针剥离覆盖在ICM表面的滋养层细胞后挑出ICM,用PBS洗涤液清洗后,置入0.02%EDTA消化液+0.125%胰蛋白酶消化液中处理后,将细胞转入15%的血清培养液中,制备细胞团悬混液。培养条件同上。
1.2.4 牛ES细胞继代克隆 ICM细胞培养35 d后,饲养层表面可出现类似ES细胞的集落。弃去培养液,用PBS液洗涤集落,再用玻璃针剥脱隆起明显、排列紧密的ES细胞集落,再用毛细吸管将集落移入培养液中。
1.3 研究方法 在DMEM培养基中加入10 ng/ml的IGF(设为IGF组)观察牛ES细胞的克隆结果与未加IGF(设为对照组)时做比较,在离散ICM和ES集落时,分别用0.02%EDTA消化液+0.125%胰蛋白酶消化液(A组)和0.04%EDTA消化液+0.25%胰蛋白酶消化液(B组),作用时间控制为2 min,温度37 ℃。
1.4 统计学处理 采用SPSS 16.0统计学软件对数据进行统计处理,计数资料采用字2检验,以P<0.05为差异有统计学意义。
2 结果
不同条件对牛ES细胞克隆的影响情况,具体结果见表1。
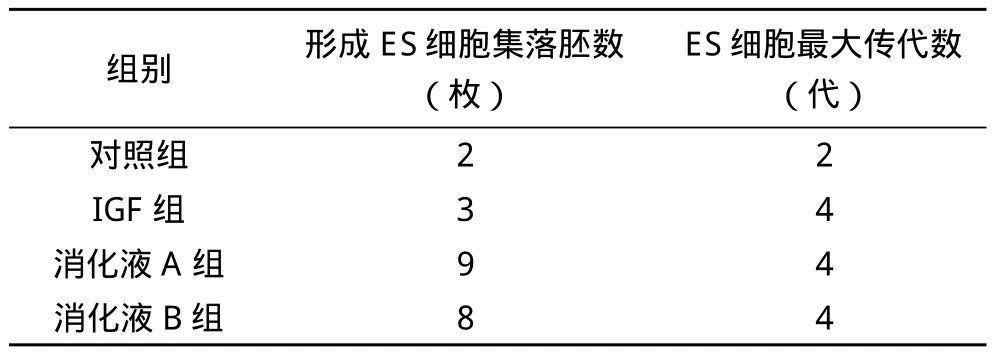
表1 不同条件对牛ES细胞克隆的影响
3 讨论
胚胎干细胞具有全能性,能再体外条件下分化为各器官系统细胞,亦可在分化抑制的情况下进行未分化状态克隆,胚胎干细胞克隆技术广泛运用于转基因动物、嵌合体的制作和克隆动物的生产,目前有关牛胚胎克隆的研究取得了重大进展[4-5]。为探讨不同条件对牛ES细胞克隆的影响,笔者探讨了在不同浓度消化液及在胰岛素生长因子作用下,牛ES细胞克隆的变化。牛ES细胞在以上配置的培养液中培养形成ES细胞集落胚数/枚ES 2枚,细胞最大传代数2代。在培养液中加入10 ng/ml的IGF牛ES细胞集落胚数为3枚,细胞最大传代数4代,可见IGF对牛ES细胞克隆有促进作用。在ICM细胞与ES细胞分离时用0.02%EDTA消化液+0.125%胰蛋白酶消化液处理2 min,形成ES细胞集落胚数/枚ES 9枚细胞最大传代数4代。用0.04%EDTA消化液+0.25%胰蛋白酶消化液分离牛ES细胞集落胚数为8枚,细胞最大传代数4代。因此,在分离ICM细胞和ES细胞时注意,选择适当浓度的消化液,且作用时间不宜过长[6-8]。通过本实验可得出在进行牛ES细胞培养时,可利用一定的添加物促进ES细胞克隆,促进其繁殖,而对于分离ICM和ES细胞的消化液,须严控其浓度和作用时间。
[1] 姜景岩,孔北华,刘星霞,等.人胚骨髓基质细胞饲养层对人胚胎生殖细胞生长的作用[J].生殖与避孕,2005,25(3):131-135.
[2] Munoz M,Rodnguez A,Frutos C,et a1.Conventional pluripotency markers are unspecific for bovine embryonic-derived cell-lines[J].Theriojournal,2008,9(6):1159-l164.
[3] 张守宝,柏学进,朱金香.不同饲养层对牛胚胎干细胞培养的影响[J].畜牧与兽医,2010,42(5):45-46.
[4] 林芸秀,魏玉珍,柯丹如,等.新生小鼠原始卵泡成熟诱导[J].生殖与避孕,2008,28(3):140-143.
[5] Mary F,Lyrme S.The potential for derivation of embryonic stem cells in Vertebrates[J].Molecular reproduction and development,2006,73(1):123-131.
[6] 窦忠英,徐小明,华进联.牛胚胎干细胞建系研究进展及存在问题[J].农业生物技术学报,2003,11(5):439-443.
[7] 李松,苗增民,宋文刚.牛胚胎干细胞分离克隆的研究[J].泰山医学院学报,2006,27(7):607-608.
[8] 靳木子,马玉珍,仓明.以两种不同成纤维细胞为饲养层培养牛胚胎干细胞的比较[J].畜牧与兽医,2010,42(6):57-58

