MZTP02噬菌体tmp基因的鉴定:与尾巴装配相关的蛋白质*
宋少云,廖 威,2,陈维春,3,李广宏
(1.中山大学生命科学学院//有害生物控制与资源利用国家重点实验室,广东广州510275;2.广西职业技术学院食品与生物技术系,广西南宁530226;3.广东医学院生化和分子生物研究所,广东湛江524023)
苏云金芽孢杆菌 (Bacillus thuringiensis)被广泛应用于防控鳞翅类昆虫,但是溶原性噬菌体的随机爆发对苏云金芽孢杆菌杀虫剂生产有很大的危害。苏云金芽孢杆菌83%的亚种都是溶原性噬菌体的寄主[1-2],噬菌体随机爆发的几率为15% ~30%,少数为50% ~80%,甚至可达100%[3]。由于噬菌体的随机爆发造成杀虫剂生产巨大损失,从1960年以来就开展了大量的研究[4],但到目前为止,还没获得有效的方法来抑制噬菌体的随机爆发。1984年,发现苏云金芽孢杆菌菌种H14细胞内有一个小DNA分子的存在,它是一个能够迁移的线性质粒[5];这个线性的DNA分子实际上对应的是溶源性噬菌体的前噬菌体形式。
目前只有3个从苏云金芽孢杆菌中分离的噬菌体 GIL01,Bam35和 GIL16,已进行了 DNA测序[5-7]。GIL01和Bam35属于复层噬菌体科,它们能够侵染很多革兰氏阳性细菌,在结构上只有少数几种核苷酸有差别。这3种噬菌体的基因组结构有着非常紧密的关联性[5],但对随机爆发噬菌体的机理仍然知之甚少。
噬菌体MZTP02是从苏云金芽孢杆菌菌株MZ1分离出来的[8]。它有一个20面体的头部、一条长的尾巴,但没有发现尾刺。噬菌体基因组已经测序,全长15717 bp, (G+C)含量为37.55%(GenBank,Accession No.AY894696)。序列分析表明两个40 bp长度内嵌终端的碱基重复率为65%,其功能为连结两端的基因组。噬菌体MZTP02基因组为包含tmp基因在内的20个开放读码框(ORFs),其中有9个编码噬菌体的尾巴蛋白质,还有2个终端酶亚体、运输蛋白质、头部蛋白质和尾巴组分等蛋白质。
Tmp基因编码的尾卷尺蛋白质 (TMP,tape measure protein)在噬菌体Bam35,Gil01,GIL16和MZTP02中也被发现[9]。TMP蛋白质是一种组成噬菌体尾巴的组分,它在吸附时可以帮助噬菌体吸附细菌,并控制尾巴的长度或者是尾巴蛋白亚体的形成,其功能类似于噬菌体的尾巴装配蛋白质。这些蛋白质可能包括了尾巴长度控制蛋白质,尾巴纤维蛋白质,尾巴组分蛋白质和尾巴亚结构蛋白质。
本文从噬菌体MZTP02中克隆到tmp基因并在原核细胞中进行了表达。功能结构分析表明TMP蛋白质在寄主中可以结合抗血清蛋白和吸附点,这说明TMP蛋白质具有控制装配噬菌体尾巴的功能。TMP抗血清可以抑制噬菌体的滴度,估计可用于解决苏云金芽孢杆菌生产中控制噬菌体爆发的问题。
1 材料与方法
1.1 菌株与噬菌体
出发菌株MZ1(B.thuringiensis subsp.kurstaki,sv.H3a3b3c)分离自广东省梅州市某公司。苏云金芽孢杆菌 ZK1(B.thuringiensis subsp.coreanensis,sv.H25)、大肠杆菌 (E.coli)菌株TG1和M15为本实验室保藏。噬菌体MZTP02通过丝裂霉素C诱变菌株MZ1中分离得到。
1.2 噬菌体MZTP02的纯化及其基因组DNA的提取
筛选指示剂菌株ZK1,噬菌体滴度的测定和双层琼脂平板的制作根据Yu and Si[10]的方法。溶源性噬菌体的检测方法为:出发菌株MZ1培养过夜制得的菌悬液,用质量浓度0.5 μg/mL的丝裂霉素C处理,震荡4 h。然后,5 μL的诱导液、200 μL处于对数生长期的检测菌株ZK1和3 mL含w=0.7%琼脂的LB的培养基混合均匀后,倒入已经凝结有底层培养基 (含w=2%琼脂的LB培养基)的平皿里,制作双层培养基,28℃培养12~16 h。出现噬菌斑,证明原菌株有溶源性噬菌体存在。选取单独的噬菌斑纯化,纯化根据Sambrook[11]的方法,连续纯化5代。噬菌体基因组DNA的分离提取根据 Verheust[7]的方法。
1.3 在E.coli M15菌株中表达tmp基因
双引物,P1:5'-GGATCCATGGGAATAATCGGGGCTACTTGG-3'和P2:5'-GTCGACCTAAAATACTTTCAATCTTTCTTTC-3',两端含有BamHI与SalI限制酶位切点,使用PCR扩增噬菌体tmp基因。PCR产物提纯后,克隆到质粒pMD18-T(TaKaRa),然后转入 pQE30(Qiagen)构建pQE30tmp载体,其中TMP蛋白质在N端与6×His融合。包含 pQE30tmp载体的 E.coli M15(pREP4)的菌体细胞培养至浊度0.6(A600nm)后,加入1 mmol/L isopropyl-b-D-thiogalactopyranoside(IPTG)的诱变剂,于37℃保温4 h。离心15 min,转速7000 r/min。融合蛋白使用w=12% 的SDS-PAGE分离,考马斯亮蓝染色。
1.4 His-tagged TMP蛋白的纯化及其抗体的制作
6×His-tagged蛋白质的纯化根据QIAexpressinistTM手册中方法进行。根据 Andrews[12]的方法,纯化的6×His-tagged蛋白质用来采集兔子的抗体毒素血浆。
1.5 蛋白质印迹分析
SDS-PAGE:分离胶的w为12%,方法见文献[11]。转移到硝酸纤维膜的方法见Hybond-C super,Amersham Pharmacia。w=1%封闭溶液进行印迹封闭,TMP蛋白抗体和原血清浓度比例为1∶500。免疫反应蛋白显示使用羊抗兔IgG和碱性磷酸酶。
1.6 tmp基因的功能分析
噬菌体滴度的测定方法见 Yu and Si[10]。TMP抗体从注射TMP蛋白的兔子血液中采集。稀释的TMP蛋白与噬菌体溶液混合,首先要试验出噬菌体滴度的范围,使TMP蛋白与噬菌体的滴度存在一种正比关系。在此比例的范围内,噬菌体溶液分别与TMP抗体、对比蛋白质和同源的胞壁酸酶混合。
2 结果
2.1 tmp基因的克隆
来自噬菌体MZTP02基因组DNA的tmp基因通过PCR扩增,出现了一条大小为1000的单一条带 (图1:A)。将PCR产物克隆到pMD18-T质粒并测序。测序结果与MZTP02基因组中tmp基因的序列一致。BamHI/SalI限制酶分析显示,基因片段已经插入了质粒pMD18-T中相应的位点上 (图1:B)。使用BamHI/SalI限制酶处理的基因片段与pQE30载体连接,重组载体命名为pQEtmp。经BamHI/SalI限制酶分析,表明tmp基因被正确插入 (图 1∶C)。
2.2 tmp基因在E.coli M15菌株中的表达及其纯化
含有pQEtmp质粒的E.coli M15菌株在37℃用IPTG(1 mmol/L)诱导5 h,然后收获细胞。从含有pQEtmp质粒的E.coli M15菌株中获得了一条35000的蛋白带 (图2),此带与预期的TMP蛋白质大小相当,对比蛋白中没有出现相应的蛋白带。TMP蛋白表达融合了6×His,使用Ni-NTA柱子纯化。所有的泳道中仅出现一条蛋白带 (图3)。
2.3 TMP抗血清蛋白的制备和检测
TMP抗血清蛋白从兔子血液中采集,兔子注射纯化并融了6×His的TMP蛋白质。蛋白质印迹分析表明,抗体血清检测出在E.coli菌株表达的融合蛋白质产生了一条清晰的蛋白带,大小为35000,而非免疫血清没有相应的条带 (图4)。
2.4 tmp基因的功能分析
为了检测噬菌体的滴度,将TMP抗血清与噬菌体悬液混合。结果表明,在噬菌体m.o.i滴度小于1时,噬菌体滴度与TMP抗血清的浓度成负比例关系。当一个指定的噬菌体质量浓度分别与25 μg/mL和250 μg/mL的TMP抗血清混合时,相应地噬菌体的滴度分别为1×105pfu/mL和2×103pfu/mL;同时,采用高纯度、来自相同基因组但不同基因的胞壁酸酶 (muramidase,MUR)作对比,结果发现噬菌体的滴度为107pfu/mL(图5)。当加入噬菌体悬液的TMP蛋白抗体质量浓度增加10倍时,噬菌体滴度却降低了50倍。这意味着TMP蛋白质可以与寄主细胞上的吸附点结合。在TMP蛋白质存在的情况下,该蛋白与其抗体即吸附点相结合,因此降低了噬菌体的滴度。TMP蛋白质可能是噬菌体尾巴的一部分,并控制噬菌体尾巴的装配。但是实验表明,假如噬菌体m.o.i滴度大于1时,噬菌斑的形成与TMP抗血清没有显示出负效果。
3 讨论
噬菌体 phi 11(NP_663684),ul36(NP_663684),λ Ba01(YP_020410),r1t(NP_695070),phi LC3(NP_996715),TP901-1(NP_112708),TM4(AAD17585),phi 3626(NP_612842)和315.6(NP_795697)与噬菌体MZTP02的tmp基因序列有较高同源性,这些噬菌体中的tmp基因功能是控制噬菌体尾巴的形成、装配及构建整个噬菌体尾巴的部件,如尾丝和尾板[13-14]。从以上10种噬菌体tmp基因的保守区的类同来判断,可以肯定的是噬菌体MZTP02与其他的噬菌体存在着某些相同的功能。

图1 tmp基因的克隆和鉴定Fig.1 Cloning and identification of tmp geneA:tmp基因的PCR产物(lane 1);B:pMD18-Ttmp/BamHI+SalI的鉴定 (lane 1);C:pQEtmp(lane 1)和pQE30载体的鉴定 (lane 2);M:蛋白质标记

图2 tmp基因表达蛋白的SDS-PAGE分析Fig.2 SDS-PAGE analysis of the expressed proteins from tmp geneLane 1-3分别为:M15(pQE30),非诱导的M15(pQEtmp)和诱导的M15(pQEtmp);M:蛋白质标记

图3 纯TMP蛋白质的SDS-PAGE分析Fig.3 SDS-PAGE analysis of purified TMP proteinLane 1-4:从缓冲液D中的抽提物;Lane 5-7:从缓冲液E中的抽提物;M:蛋白质标记
另外,tmp基因的蛋白质序列与来自57种噬菌体的10种蛋白质显示出同源性[9],特别同源于来自Staphylococcus aureus和Lactococus lactis细胞的噬菌体 λBa01,噬菌体 MZTP02与噬菌体 λBa01,rlt,phiL3,TP901-1和ul36同属于一个进化系中。但是噬菌体MZTP02与以上10种之外的噬菌体没有太高的同源性。例如,与Staphylococcus aureus细胞的噬菌体phi 13仅有28%的同源性。

图4 TMP蛋白质的印迹分析试验Fig.4 Western blot analysis of TMP proteinsLane 1-2分别为:注射前兔血清和注射后血清;M:预染的蛋白质标记
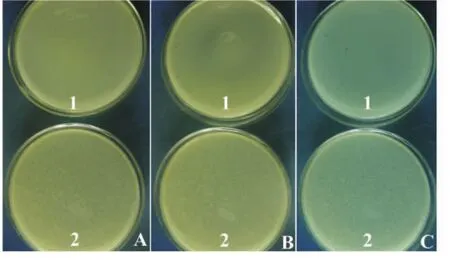
图5 噬菌体悬液与TMP抗血清形成噬菌斑的检测Fig.5 Detection of plaque formation of phage treated with TMP antiserumA1和B1:无抗血清的对比平皿;A2:25 μg/mL TMP抗血清;B2:250 μg/mL TMP 抗血清;C1:250 μg/Ml TMP抗血清;C2:250 μg/mL MUR抗血清
tmp基因编码控制噬菌体尾巴长度及其他功能的蛋白质[9],所以该基因与噬菌体尾巴的装配有关。编码的蛋白质可能包括尾巴长度的控制蛋白、尾丝蛋白、尾巴构件蛋白、尾巴亚结构蛋白,等等。当这些抗原蛋白质与相应的抗体结合时,它们对宿主的吸附被消弱了。TMP抗血清与宿主的吸附点共同竞争噬菌体。TMP抗血清的质量浓度越大,噬菌体能够吸附宿主的几率就越小,形式噬菌斑的数量就越少。因此,这一关系可以通过检测噬菌斑点滴度的变化来分析tmp基因的功能。
推测噬菌体MZTP02是一个新品种,它从发酵菌株苏云金芽孢杆菌 MZ1细胞中分离出来。基因组分析表明,tmp基因的位置在10828 bp和11872 bp之间,长度1044 bp。它编码了一个含有348个氨基酸的蛋白质,大小35500。tmp基因的功能使用TMP抗体来分析,抗体被加到具有一定浓度的噬菌体悬液中,噬菌斑的滴度下降50倍,这一现象说明该基因的蛋白质功能与噬菌体的尾巴装配有关。其理由可能是,当噬菌体与TMP抗血清混合时,抗体与噬菌体尾巴或者部分尾板结合,因此噬菌体尾巴难以、甚至无法与宿主细胞上的吸附点结合。这就解释了tmp基因编码类似于尾板、尾丝、结合蛋白等蛋白质,这些蛋白质具有与宿主吸附点结合的能力[15]。但发现当噬菌体的滴度m.o.i大于1时,滴度并没有反映这种负比例关系,说明很多噬菌体颗粒在同一时间内吸附到一个宿主细胞上,导致了该宿主细胞的破裂。
尽管我们推测到噬菌体尾巴与宿主细胞上的吸附点之间有这种关系,但还有不了解的地方,噬菌体尾巴是怎样与吸附点结合的?属于Lactococcuslactis家族的溶源性噬菌体TP901-1有一条很长、不会收缩、有终端基板的尾巴,后者估计与宿主细胞吸附点相结合起主要作用,但是其结合的机理还不清楚[16-17]。
另外一个蛋白质,捕获结合蛋白质 (Capture binding protein,CBP),可能涉及到噬菌体与宿主细胞的相互作用之中。这一蛋白与其他的蛋白质有着很多类似性,但是这些蛋白质的碳端结构大多不同[18]。有两种噬菌体蛋白质,大小分别为31000和16000,涉及到噬菌体与宿主细胞的相互作用之中[19]。一些噬菌体DNA的序列被测出,并发现了一个读码框,该读码框部分折叠并与编码必要的尾巴蛋白质相结合[20]。当噬菌体与宿主细胞吸附点的反应时,非收缩尾巴不会在吸附反应中起到主要的作用[21]。
从早期的工作中了解到,噬菌体T4的基因29编码尾巴蛋白的长度[22]。对于具有收缩性或者是非收缩性尾巴的噬菌体,尾巴的长度由tmp基因决定。对于大多数的噬菌体,相应的蛋白质则由其基因组中的开放读码框决定[23]。在下个试验中,将tmp基因敲除掉并观察噬菌体突变体,以期发现噬菌体MZTP02基因组tmp基因更多的功能。
[1]SACKERMANN H W,SMIRNOFF W A.Study of lysogeny in Bacillus thuringiensis and B.cereus[J].Can J Microbiol,1978,24:818-826.
[2]SUN F,YUAN Z M,LI T Y.Reduction of resistance of culex pipiens larvae to the binarytoxin from Bacillus sphaericus by coexpression of cry4Ba from Bacillus thuringiensis subsp.israelensis with the binary toxin gene [J].World Journal of Microbiology and Biotechnology,2001,17:385-389.
[3]YU Z.Bacillus thuringiensis[M].Beijing:Science Press,1990.
[4]CHAPMAN H M,NORRIS J R.Four new bacteriophages of Bacillus thuringiensis[J].J Appl Bacteriol,1966,29:529-535.
[5]VERHEUST C,FORNELOS N,MAHILLON J.GIL16,a new gram-positive tectiviral phage related to the Bacillus thuringiensis GIL01 and the Bacillus cereus pBClin15 elements[J].J Bacteriol,2005,187:1966-1973.
[6]STROMSTEN N J,BENSON S D,BURNETT R M,et al.The Bacillus thuringiensis linear double stranded DNA phage Bam35,which is highly similar to the Bacillus cereus linear plasmid pBClin15,has a prophage state[J].J Bacteriol,2003,185:6985-6989.
[7]VERHEUST C,JENSEN G.,MAHILLON J.pGIL01,a linear tectiviral plasmid prophage originating from Bacillus thuringiensis serovar israelensis [J].Microbiol,2003,149:2083-2092.
[8]LIAO W,SUN F,SONG S Y,et al.Biology of two lysogenic phages from Bacillus thuringiensis MZ1 [J].Acta Microbiologica Sinica,2007,47:180-183
[9]PEDERSEN M,OSTERGAARD S,BRESCIANI J,et al.Mutational analysis of two structural genes of the lysogenic lactococcal bacteriophage TP901-1 involved in tail length determination and baseplate assembly [J].Virol,2000 ,276:315-328.
[10]YU M X,SI Z T.Experimental techniques for bacteriophages[M].Science Press,Beijing,1991,19-23.
[11]SAMBROOK J,DAVID R.Molecular cloning:A laboratory manual[M].3rd ed.New York:Cold Spring Harbor Laboratory Press,2001:147-185.
[12]ANDREWS R E,IANDOLO J J,CAMPBELL B S,et al.Rocket immunoelectrophoresis of the entomocidal parasporal crystal of Bacillus thuringiensis subsp.Kurstaki[J].Appl Environ Microbiol,1980,40:897-900.
[13]MINDICH L,BAMFORD D,MCGRA W.Assembly of bacteriophage PRD1:particle formation with wild-type and mutant viruses [J].J Virol,1982,44:1021 –1030.
[14]TETART F,DESPLATS C,KRISCH H M.Genome plasticity in the distal tail fiber locus of the T-even bacteriophage:recombination between conserved motifs swaps adhesin specificity[J].Journal of molecular biology,1998,282:543-556.
[15]LIN N T,LIU T J,LEE T C,et al.The adsorption protein genes of Xanthomonas campestris filamentous phages determining host specificity [J].J Bacteriol,1999,181:2465-2471.
[16]BRITSKAIA V S,DANILEICHENKO V V.The infection of bacilli by Mu cts phage integrated into the plasmid[J].Mikrobio,1990,52:57-63.
[17]CHISTINA S V,LONE B,HORST N.Structural characterization and assembly of the distal tail structure of the temperate lactococcal bacteriophage TP901-1[J].J Bacteriol,2005,187:4187-4197.
[18]DUPONT K,VOGENSEN F K,NEVE H,et al.Identification of the receptor-binding protein in 936-species lactococcal bacteriophages[J].Appl Environ Microbiol,2004,70:5818-5824.
[19]LEVIN M E,HENDRIX R W,CASJENS S R.A programmed translational frameshift is required for the synthesis of a bacteriophage lambda tail assembly protein[J].J Mol Biol,1993,234:124-139.
[20]MOORE S D,PREVELIGE P E.A P22 scaffold protein mutation increases the robustness of head assembly in the presence of excess portal protein [J].J Virol,2002,76:10245-10255.
[21]VIANELLI A,WANG G R,GINGERY M.Bacteriophage T4 self-assembly:localization of gp3 and its role in determining tail length [J].J Bacteriol,2000,182:680-688.
[22]DUDA R L.Expression of plasmid-encoded structural proteins permits engineering of bacteriophage T4 assembly[J].Viro,1990,179:728-737.
[23]XU J,HENDRIX R W,DUDA R L.Conserved translational frameshift in dsDNA bacteriophage tail assembly genes[J].Mol Cell,2004,16:11-21.

