cAMP红曲霉蓝光诱导途径中的作用
杨 华, 陈勉华, 王 婧, 马博雅, 张晓伟, 王昌禄
(天津科技大学食品营养与安全教育部重点实验室/食品工程与生物技术学院,天津 300457)
蓝光可以通过多种途径影响真菌代谢及生长.在粗糙脉孢菌(Neurospora crassa)中,蓝光可以影响其蛋白质磷酸化作用,生物钟节律变化,菌落形态以及产孢等生理过程[1],对粗糙脉孢菌的胡萝卜素合成以及次生代谢合成关键基因veA和fluG也有影响[2-3].除粗糙脉孢菌外,布拉氏须霉(Phycomyces blakesleeanus)、互生链格孢子菌(Alternaria alternata)的色素代谢,黑曲霉(Aspergillus niger)中的葡萄糖苷酶合成以及菌丝形态、孢子生殖都受蓝光影响[4-7].
光照作为重要的环境信号因子,可以影响真菌细胞内腺嘌呤核苷三磷酸(ATP)和腺苷-3′,5′-环化一磷酸(cAMP)的水平以及蛋白的磷酸化等[8-10].cAMP是细胞内的第二信使,cAMP信号途径是感受环境改变的重要途径:当细胞受到外界刺激时,细胞膜上的Gs-蛋白被激活,然后再激活细胞膜上的腺苷酸环化酶,催化ATP脱去一个焦磷酸形成cAMP,cAMP通过激活cAMP依赖性蛋白激酶,使靶细胞蛋白磷酸化,进而调节细胞反应,产生一系列的生理变化.cAMP途径是蓝光转导途径中的重要组成部分可以调节真菌很多生理功能,如粗糙脉孢菌以及一些曲霉产孢,黑曲霉的次生代谢等[11-12].
红曲霉是中国传统药食兼用菌种,可代谢产生多种生物活性物质,广泛用于酿酒、制药等领域[13],但因其代谢产物——桔霉素的存在,限制了红曲霉的应用.桔霉素是一种肾毒素,还具有致畸、致突变作用.目前,对桔霉素调控研究多集中于培养基的优化及产毒关键基因的敲除.但优化培养基并不能从根本上去除桔霉素,敲除产毒关键基因往往导致红曲霉代谢产物中其他生物活性成分产量减少.采用环境因子调控真菌代谢是一种行之有效的调控方法,尤其近年来发现蓝光可以调节红曲霉次生代谢产物——桔霉素、红曲色素以及Monacolin K产量以及孢子生成[14-15],但具体的调控机理还未知.
为研究蓝光对红曲霉代谢及产孢调控机理,尤其是cAMP在蓝光调控中的作用,本文通过在发酵培养基中添加能够促使红曲霉菌生成cAMP的氨茶碱,提高红曲霉细胞内cAMP水平,进而观察cAMP对红曲霉次生代谢及产孢影响,结合蓝光照射对红曲霉次生代谢及产孢影响,探讨cAMP在红曲霉蓝光诱导途径中的作用.
1 材料与方法
1.1 材料与试剂
1.1.1 供试菌株
橙色红曲霉(M.aurantiacus)MX1系天津科技大学食品生物技术实验室保藏.该菌种属高产桔霉素菌种,对外部环境较敏感,有利于研究红曲霉桔霉素代谢调节和外部环境对其代谢及表型影响.菌种接种于PDA培养基斜面上,30℃培养96 h后,保存于4℃冰箱中,每月转接活化一次.
1.1.2 试剂
氨茶碱购自Sigma公司;酵母膏购自Oxoid公司;其他用作培养基配制试剂均为分析纯,购自天津市北方天医化学试剂厂;高效液相检测用甲醇、乙腈为色谱纯,购自Merck公司.
1.1.3 培养基
种子培养基为大米粉 30 g,KH2PO42.5 g,NaNO32 g,MgSO4·7H2O 1 g 溶于 1 000 mL H2O 中,乳酸调pH至4.5.
YES培养基为蔗糖和酵母浸膏分别灭菌后混合.蔗糖质量浓度为160 g/L,酵母浸膏质量浓度为40 g/L.
PDA培养基为马铃薯200 g切成小块,水煮20 min,过滤后将H2O补足至1 000 mL,加入葡萄糖20 g,琼脂 20 g.
以上培养基灭菌条件为121℃,20 min.
1.2 仪器与设备
1200型高效液相色谱仪,美国安捷伦公司;TES133型专业级照度计,泰仕电子工业股份有限公司.
1.3 方 法
1.3.1 菌种培养方法
在活化的MX1菌种斜面中加入5 mL无菌水,用孢子铲将斜面上的孢子刮下,制成孢子悬液,倒入装有100 mL种子培养基的250 mL三角瓶中,37℃,180 r/min培养30 h,得到种子液.
将上述种子液用无菌纱布过滤,血球计数板计数,用无菌水将孢子悬液浓度调整到106个/mL.取3 mL种子液,加入装有50 mL YES培养基的250 mL三角瓶中,30℃静置培养8 d.
为检测蓝光及氨茶碱对红曲霉MX1代谢产生桔霉素和产孢的影响,将样品分为三组,分别放置在黑暗、蓝光照射(470 nm,130 lx)以及在发酵培养基中加入不同浓度的氨茶碱进行培养,用血球计数板进行孢子计数.
1.3.2 桔霉素检测方法
样品预处理方法是用移液管量取1 mL红曲霉MX1发酵液,放入离心管中,加5 mL蒸馏水,再加无水乙醇12 mL,搅拌均匀,放入60℃水浴中加热1 h,每隔20 min振荡一次,然后以3 000 r/min离心15 min,取上清液,经0.45 μm 的微孔滤膜过滤,用于HPLC分析.
高效液相色谱条件是安捷伦C18型色谱柱(4.6 mm×250 mm,粒度5 μm);流动相为V(乙腈):V(甲醇):V(水)=70:10:20,pH 2.5(用磷酸调);检测器为荧光检测器,检测波长为λex=331 nm,λem=500 nm;柱温为28℃;流速为1 mL/min.
2 结果与分析
2.1 氨茶碱对红曲霉菌落的影响
将红曲霉孢子悬液涂布到含有不同浓度氨茶碱的PDA平板上,37℃培养5 d,其结果如图1.

图1 不同浓度的氨茶碱对红曲霉MX1菌落的影响Fig.1 Effects of different concentrations of aminophylline on the colony morphology of Monascus MX1
从图1可以看出,氨茶碱的添加对红曲霉菌落及生长有显著影响,从左到右添加氨茶碱至终浓度依次为 0,5,10,15,20 mmol/L. 当氨茶碱添加量小于等于10 mmol/L时,随着氨茶碱添加量的增加,MX1菌落越来越小,越来越密集,颜色也越来越红.由于红曲色素是在红曲霉生长的中后期产生的,因此可以推断低浓度的氨茶碱可以促进红曲霉生长.当氨茶碱添加量大于10 mmol/L时,MX1菌落越来越稀疏,这说明高浓度的氨茶碱能够抑制红曲霉生长.
2.2 蓝光及氨茶碱对红曲霉产孢的影响
分别在YES培养基中添加氨茶碱至终浓度为0,5,10,15,20 mmol/L 黑暗条件下培养红曲霉 MX1 5 d,以及蓝光照射条件下培养红曲霉MX1 5 d,对发酵液中红曲霉MX1分生孢子及子囊孢子数进行分析,结果如表1.
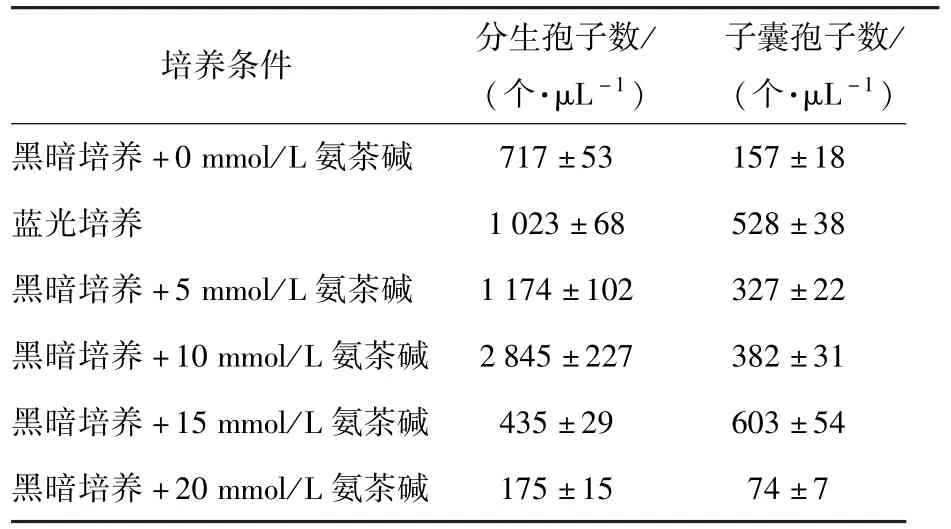
表1 蓝光诱导和氨茶碱对红曲霉MX1孢子生成的影响Tab.1 Effects of aminophylline and blue light on spore production of Monascus MX1
从表1可以看出,蓝光照射培养可以导致红曲霉MX1分生孢子及子囊孢子数量增加.其中分生孢子数提高到空白组(黑暗培养,不添加氨茶碱)的1.43倍,子囊孢子数提高到空白组的3.36倍.向接种MX1的YES液体发酵培养基中添加一定量的氨茶碱,同样可以提高分生孢子数和子囊孢子数的数量,其中添加10 mmol/L氨茶碱分生孢子数最大,是空白组的3.97倍,是蓝光培养条件下的2.78倍.向接种MX1的YES培养基中添加氨茶碱至终浓度为15 mmol/L时所生产子囊孢子数最大,是空白组的3.84倍,是蓝光培养条件下的1.14倍.由此可见,蓝光和氨茶碱都可以提高红曲霉分生孢子数及子囊孢子数.随着培养基中氨茶碱浓度的增加,MX1孢子数在达到最高值后明显减少,这表明过高的氨茶碱浓度能够抑制红曲霉产孢.
2.3 蓝光及氨茶碱对红曲霉产桔霉素的影响
在接种红曲霉MX1的YES液体发酵培养基中添加氨茶碱至终浓度为10 mmol/L,培养8 d,对样品进行桔霉素含量分析,将结果与空白组及蓝光培养条件下桔霉素含量进行对比,结果如图2.
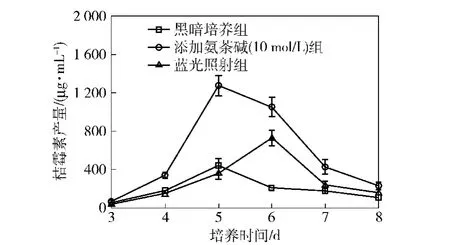
图2 氨茶碱和蓝光诱导培养对红曲霉MX1发酵生产桔霉素的影响Fig.2 Effects of aminophylline and blue light on citrinin production by fementation of Monascus MX1
由图2可以看出,蓝光照射培养和添加氨茶碱都可以提高红曲霉MX1桔霉素的产量,其中空白组和添加氨茶碱组桔霉素产量均在培养5 d达到最高,空白组桔霉素的最高产量为439 μg/mL,氨茶碱添加组桔霉素的最高产量为1 274 μg/mL.蓝光培养条件下,桔霉素产量在6 d达到了最高,为729 μg/mL.向培养基中添加10 mmol/L氨茶碱和蓝光培养都可以提高桔霉素的产量,分别为空白组的2.90倍和1.66倍.
蓝光信号对真菌的影响机理很复杂,即使在模式菌株——粗糙脉孢菌中也没有解释清楚.蓝光作为环境信号作用于真菌,能够促进真菌体内cAMP的生成.在木霉的光照机理研究中发现,cAMP可以通过激活木霉细胞内蛋白激酶的活性进而调节木霉的光照反应,包括产孢等影响[16-17].在光诱导培养的脉孢菌发酵培养基中添加能够减少细胞内cAMP含量的阿托品,则可以抑制脉孢菌的光诱导产孢效应[18].
通过蓝光诱导培养与在培养基中添加能够促使细胞内生成cAMP的氨茶碱,发现这两种方式对红曲霉MX1代谢产生桔霉素及产孢数量具有相似的影响,说明与木霉一样,蓝光对红曲霉的产孢及桔霉素代谢调控可能是通过cAMP途径进行的.
在对红曲霉MX1代谢产生桔霉素的研究中发现,黑暗培养条件下以及向培养基中添加氨茶碱至终浓度为10 mmol/L,红曲霉MX1代谢产生桔霉素的最高值均出现在培养5d,而蓝光诱导培养红曲霉MX1代谢产生桔霉素的最高值则出现在培养6 d.这说明,蓝光除能提高红曲霉MX1代谢桔霉素的产量,还能改变桔霉素合成的节律.这可能是由于在光受体蛋白中结合了一个节律启动子,蓝光能够通过这个节律启动子来调节光可诱导基因的表达节律[5].而cAMP途径则不能调节光诱导基因的表达节律.
3 结 论
在接种红曲霉MX1的YES液体发酵培养基中添加一定量能够促进红曲霉细胞内cAMP生成的氨茶碱,可提高红曲霉MX1代谢桔霉素的产量及分生孢子和子囊孢子的数量,这与蓝光诱导红曲霉MX1代谢产生桔霉素和孢子数量变化一致.蓝光可以通过或者部分通过cAMP途径调节红曲霉MX1桔霉素代谢以及孢子生产.这与木霉中蓝光信号调控途径研究结论一致[17].但cAMP并没有改变桔霉素代谢节律,可见,cAMP途径并不是蓝光诱导红曲霉代谢的唯一途径.
虽然蓝光照射对真菌毒素——桔霉素的生成有促进作用,但蓝光作为调控真菌代谢的重要方法,其对红曲霉桔霉素的代谢调控研究仍具有重要意义.目前,对红曲霉光照影响机理的研究还处于初步阶段,对红曲霉光照机理进行深入研究是全面研究红曲霉桔霉素代谢调控的有效手段之一,通过对桔霉素调控途径研究,能更好的为生产中对红曲霉次生代谢调节提供理论支持,从而减少桔霉素的生成.
[1] He Qiyang, Cheng Ping, Yang Yuhong, et al.White collar-1,a DNA binding transcription factor and a light sensor[J].Science, 2002, 297(5582):840843.
[2] Dragovic Z, Tan Ying, Görl M, et al.Light reception and circadian behavior in‘blind'and‘clock-less'mutants of Neurospora crassa[J].Embo Journal, 2002, 21(14):3643 -3651.
[3] Kumar M S,Kumar P M,Sarnaik H M,et al.A rapid technique for screening of lovastatin-producing strains of Aspergillus terreus by agar plug and neurospora crassa bioassay[J].Journal of Microbiological Methods, 2000, 40(1):99104.
[4] Häggblom P, Unestam T.Blue light inhibits mycotoxin production and increases total lipids and pigmentation in alternaria alternate[J].Applied and Environment Microbiology, 1979, 38(6):1074 1077.
[5] Froehlich A C, Liu Yi, Loros J J, et al.White collar-1,a circadian blue light photoreceptor,binding to the frequency promoter[J].Science,2002, 297(5582):815-819.
[6] Rodríguez R J, Corrochano L M.The gene for the heatshock protein HSP100 is induced by blue light and heatshock in the fungus phycomyces blakesleeanus[J].Current Genetics, 2004, 46(5):295303.
[7] 朱俊晨,王小菁.蓝光促进黑曲霉分生孢子发育和产糖化酶的研究[J].微生物学报,2005,45(2):275-278.
[8] Miroslav G, Kolarova N, Farkasë V.Membrane potential, ATP, and cyclic AMP changes induced by light in trichoderma viride[J].Experimental Mycology, 1988,12(4):295301.
[9] Gresík M, Kolarova N, Farkas V.Light-stimulated phosphorylation of proteins in cell-free extracts from trichoderma viride[J].FEBS Letters, 1989, 248(12):185-187.
[10] Kolarova N, Haplová J, Gresík M.Light-activated adenyl cyclase from trichoderma viride[J].FEMS Microbiology Letters, 1992, 72(3):275278.
[11] Calvo A M,Wilson R A,Bok J W,et al.Relationship between secondary metabolism and fungal development[J].Microbiology and Molecular Biology Reviews:MMBR,2002,66(3):447459.
[12] Pall M L.Adenosine 3′,5′-phosphate in fungi[J].Microbiological Reviews, 1981, 45(3):462480.
[13] 张维成,阎斌,吴振红.一种酿造粟米黄酒的新工艺[J].北京轻工业学院学报,1998,16(4):6974.
[14] Miyake T, Mori A, Kii T, et al.Light effects on cell development and secondary metabolism inMonascus[J].Journal of Industrial Microbiology&Biotechnology, 2005, 32(3):103 -108.
[15] Babitha S,Carvahlo J C,Soccol C R,et al.Effect of light on growth,pigment production and culture morphology ofMonascuspurpureus in solid-state fermentation[J].World Journal of Microbiology and Biotechnology,2008,24(11):26712675.
[16] Casas-Flores S,Rios-Momberg M,Rosales-Saavedra T,et al.Cross talk between a fungal blue-light perception system and the cyclic AMP signaling pathway[J].Eukaryotic Cell, 2006, 5(3):499 -506.
[17] Nemcovic M,Farkas V.Stimulation of conidiation by derivatives of cAMP in Trichoderma viride[J].Folia Microbiol, 1998, 43(4):399402.
[18] Scott W A, Solomon B.Adenosine 3′,5′-cyclic monophosphate and morphology in neurospora crassa:druginduced alterations[J].Journal of Bacteriology, 1975,122(2):454 -463.

