炭疽PA和芽孢双组分候选疫苗免疫豚鼠的免疫学初步评价
卢锦标,魏东,王国治
炭疽PA和芽孢双组分候选疫苗免疫豚鼠的免疫学初步评价
卢锦标,魏东,王国治
100050 北京,中国食品药品检定研究院结核病疫苗室
对豚鼠免疫重组 PA 抗原和甲醛灭活芽孢组成的炭疽候选疫苗,评价其免疫效果。
将豚鼠随机分成 5 个实验组,分别免疫高、中、低剂量候选疫苗、炭疽活疫苗或生理盐水;免疫后不同时间点采血进行抗体检测、XTT 法淋巴细胞增殖检测以及皮肤迟发型超敏反应检测。
抗体检测结果显示,双组分炭疽候选疫苗能诱导较强的体液免疫应答;XTT 细胞增殖结果显示,外周血淋巴细胞特异性增殖不明显,但所有候选疫苗组针对 rPA DTH 阳转率 24 h 后均为 100%。
双组分炭疽候选疫苗能诱导豚鼠产生体液免疫和细胞免疫应答。
芽孢杆菌,炭疽; 炭疽菌苗; 豚鼠; 免疫评价
炭疽是由炭疽杆菌引起的人畜共患传染病。受炭疽杆菌感染的食草动物是人类最主要的传染源,虽然人类中的炭疽发病率并不高[1],但炭疽杆菌作为细菌战或生物恐怖袭击首选,如 2001 年美国炭疽邮件事件,潜在威胁不容忽视。
我国现用的炭疽疫苗是人用减毒活疫苗,主要成分是活的炭疽芽孢,采用皮上划痕接种方式,存在接种剂量难以保证,副反应较重等问题。国外常用的炭疽疫苗有 AVA(美国)和 AVP(英国),由减毒株培养后,除菌滤液加氢氧化铝吸附制备而成,保护性抗原(protective antigen,PA)是其中最主要的免疫原,其他抗原成分较复杂,存在难定性定量,批间变异大等问题。我国目前的炭疽病预防预案是以化学药品预防为主,在服用化学药品时给予活疫苗接种,可能造成接种无效,同时化学预防还有产生耐药菌的可能,且可能对用作生物武器的抗多种常见药物的炭疽杆菌无效。因此,研究一种新型且安全有效的炭疽疫苗尤为重要。
上述两种类型的炭疽疫苗组成虽不同,但达到的免疫保护效果相近,提示除了 PA,炭疽芽孢中的抗原对免疫保护效果也起着重要作用[2-3]。本研究利用重组 PA 抗原(rPA)和甲醛灭活芽孢(formaldehyde inactivatedspores,FIS),经氢氧化铝凝胶吸附后制备炭疽双组分候选疫苗,在豚鼠模型中,评价该候选疫苗的免疫应答,为炭疽新疫苗的改进提供参考。
1 材料与方法
1.1 材料
1.1.1 试剂和仪器 rPA 抗原和甲醛灭活芽孢由中国食品药品检定研究院结核病疫苗室制备;Al(OH)3佐剂为德国 Brenntag 公司产品;XTT 和吩嗪硫酸甲酯(PMS)为美国 Sigma 公司产品;辣根过氧化物酶标记的山羊抗豚鼠 IgG 为美国 Santa Cruz biotechnology 公司产品;豚鼠淋巴细胞分离液购自天津灏洋生物技术有限责任公司;MK3 酶标仪为芬兰 Labsystems Dragon 公司产品。
1.1.2 实验动物 SPF 级 Hartley 豚鼠,6 ~ 8 周龄,由中国食品药品检定研究院实验动物中心提供。实验动物使用许可证号:scxk(京)2009-0017。实验过程中饲养于中国食品药品检定研究院清洁级动物房。
1.2 方法
1.2.1 分组及免疫 将 40 只豚鼠随机分为 5 组,每组 8 只,雌雄各半。①对照组:Al(OH)3佐剂;②高剂量组:40 μg rPA + 4 亿 FIS + Al(OH)3;③中剂量组:20 μg rPA + 2 亿 FIS + Al(OH)3;④低剂量组:10 μg rPA + 1 亿FIS + Al(OH)3;⑤活疫苗组:皮上划痕用炭疽活疫苗(5.0 × 107/只)。前 4 组第 0 周、第 2 周免疫,第 5 组仅第 0 周免疫,注射部位均为后肢肌内。
末次免疫后 1 周、3 周对每只动物进行心脏抽血,用豚鼠淋巴细胞分离液分离出淋巴细胞(PBMC)进行 XTT 增殖检测。末次免疫后 3 周、5 周心脏抽血,分离血清,用于豚鼠 ELISA 抗体检测。
1.2.2 抗体检测 将 rPA 和 FIS 分别以 5 μg/ml和 1 亿/ml 包被 96 孔酶标板,4 ℃过夜。封闭液 37 ℃封闭 2 h 后,每孔加入 100 μl 的 500 倍开始倍比稀释的待检血清,于 37 ℃反应 1 h。显色时,每孔加入 100 μl TMB 底物液,37 ℃放置5 ~ 10 min 后,每孔加入 2 mol/L 的 H2SO450 μl 终止液终止反应。检测吸光值450 nm。以大于佐剂对照组吸光值 2.1 倍的最大稀释倍数为待检血清的抗体效价,取其 10 为底的对数值。
1.2.3 淋巴细胞增殖试验(XTT法) 分离的 PBMC 调整浓度为 2.5 × 106/ml,每孔 100 μl 加入 96 孔细胞培养板。用 1640 完全培养基稀释 rPA 抗原成 20 μg/ml,稀释 FIS 为 0.2亿/ml,各加100 μl/孔,均做复孔,同时用 1640 完全培养基作阴性对照,ConA 作阳性对照。在 37 ℃,5% CO2的二氧化碳培养箱中培养 72 h。
培养结束后,配制 PMS/XTT 混合液:分别称量 PMS 0.0081 g 溶于10 ml PBS、XTT 0.01 g 溶于 10 ml PBS,两者以 1:20 体积比混合,过0.22 μm 滤膜除菌。每孔加 40 μl PMS/XTT 混合液,于 37 ℃,5% CO2的二氧化碳培养箱中继续培养 6 h。置酶联检测仪上测定吸光度,检测波长 450 nm,参考波长 630 nm。取复孔吸光值平均值,以公式 SI =450/630 nm实验孔/450/630 nm对照孔计算刺激指数。
1.2.4 rPA 的皮肤迟发型超敏反应(DTH) 参考《中国药典》方法[4],于疫苗末次免疫后第 5 周,暴露豚鼠一侧皮肤,除毛,皮内注射 50 μg/ml 的 rPA 抗原 0.2 ml,于 24 h 后观察注射部位皮肤有无红肿,并测量肿块直径大小,以红肿直径超过5 mm × 5 mm 判定为阳性反应,计算阳性反应发生率。
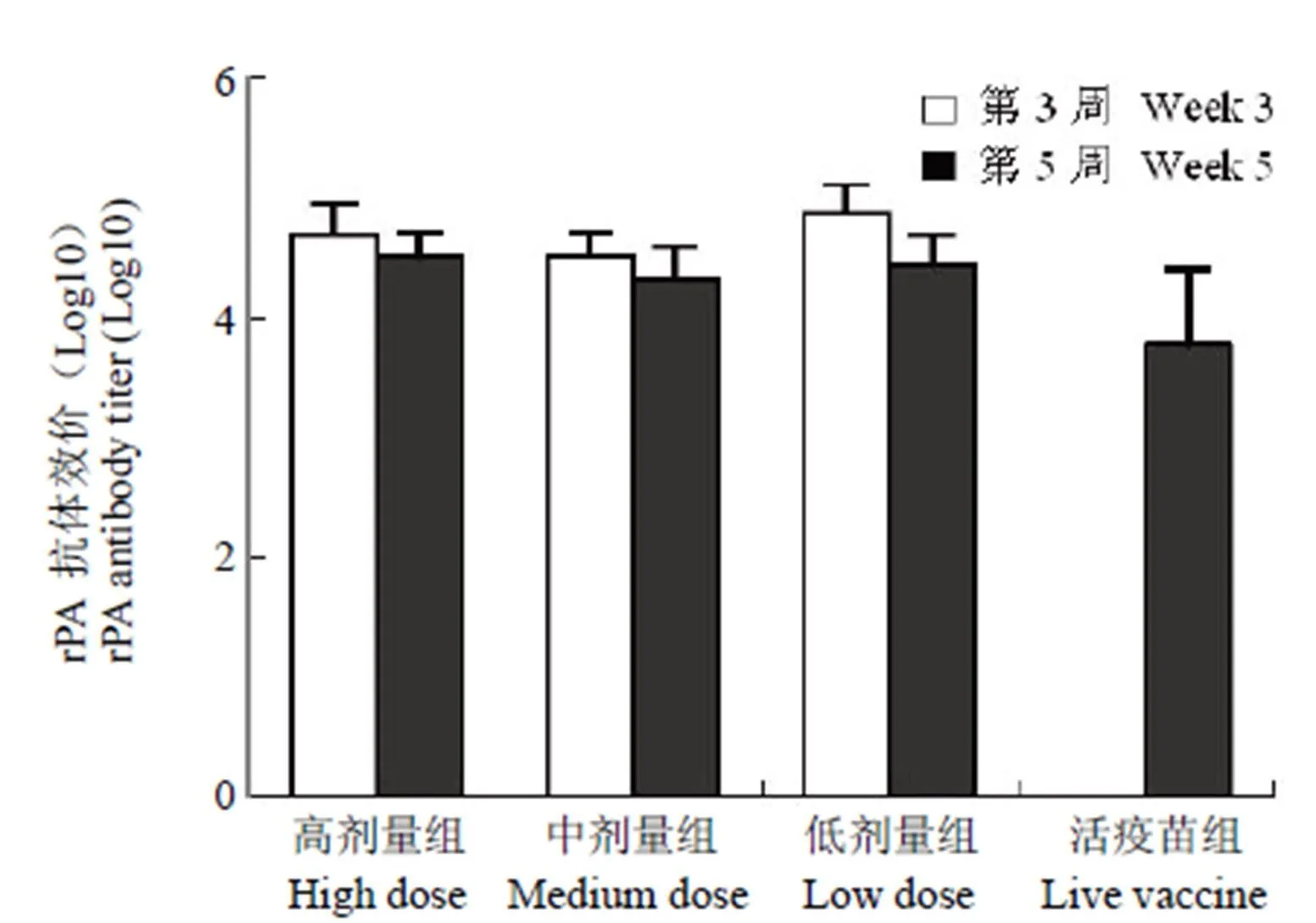
图 1 抗 rPA 抗原 IgG 抗体效价
Figure 1 Anti-rPA IgG antibody titer
1.3 统计学处理
2 结果
2.1 抗原特异性抗体效价
2.1.1 抗 rPA 抗体结果 免疫后第 3 周,高、中、低剂量组动物均能产生高滴度抗体,活疫苗组未检测到 rPA 抗体。至第 5 周,高、中、低剂量组动物抗体效价较第 3 周有小幅下降,但差异无统计学意义(> 0.05),同时活疫苗组可检测出高滴度抗体(图 1)。
2.1.2 抗 FIS 抗体结果 免疫后第 3 周,高、中、低剂量组动物均能产生高滴度 FIS 抗体,活疫苗组未检测到 FIS 抗体。至第 5 周,高剂量组动物抗体效价较第 3 周有小幅下降,中、低剂量组动物抗体效价较第 3 周有小幅上升,但差异均无统计学意义(> 0.05),同时活疫苗组可检测出高滴度 FIS 抗体,但显著低于同一时间点的其他 3 组,差异有统计学意义(< 0.001)(图2)。
2.2 抗原特异性的淋巴细胞增殖
2.2.1 rPA 抗原特异性的淋巴细胞增殖 在末次免疫后第 1 周及第 3 周,各试验组淋巴细胞刺激指数与 Al(OH)3佐剂对照组比较,均无显著差异(> 0.05)(图 3)。
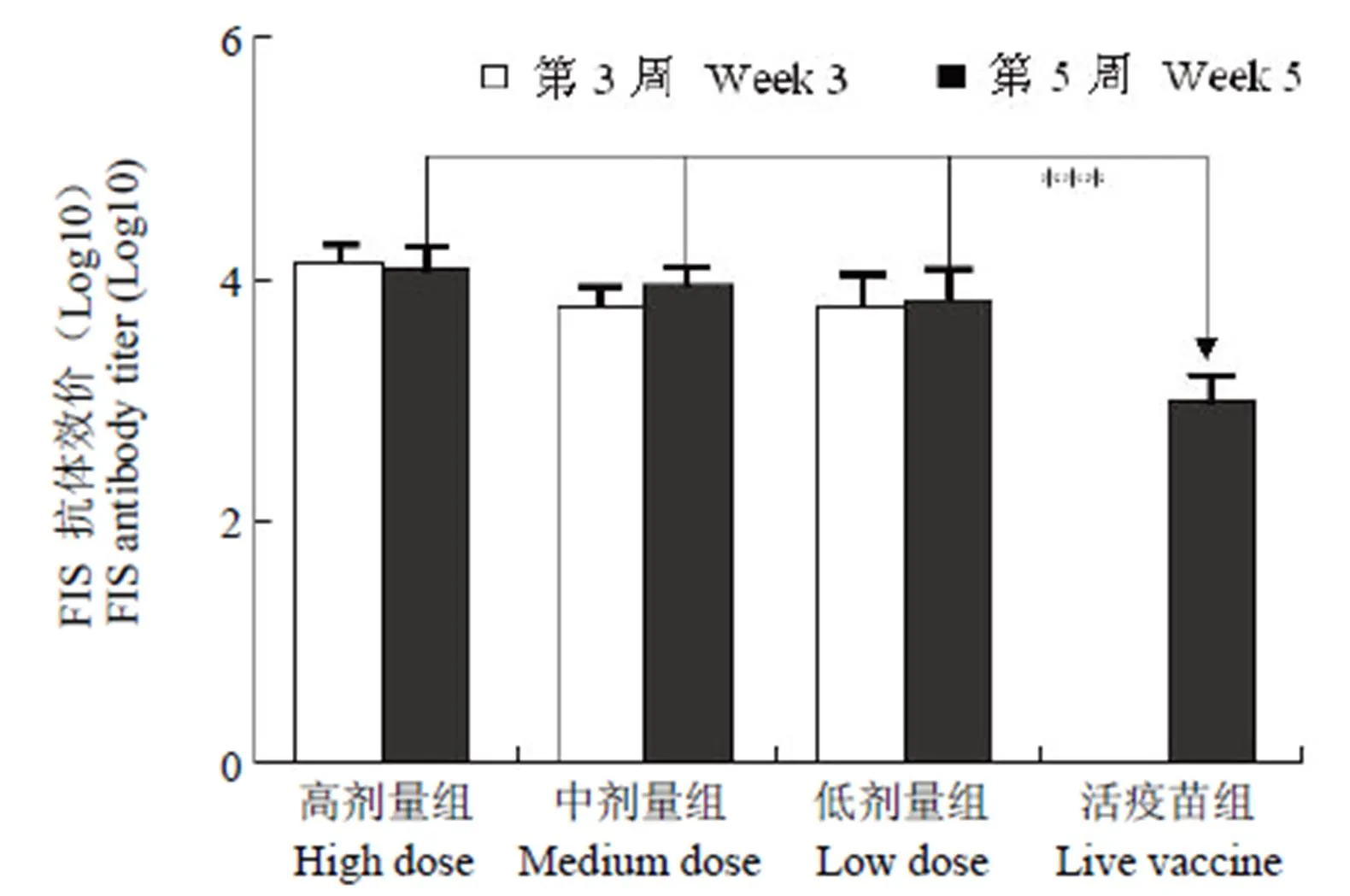
图 2 抗 FIS 抗原 IgG 抗体效价(***P < 0.001)
Figure 2 Anti-FIS IgG antibody titer (***< 0.001)
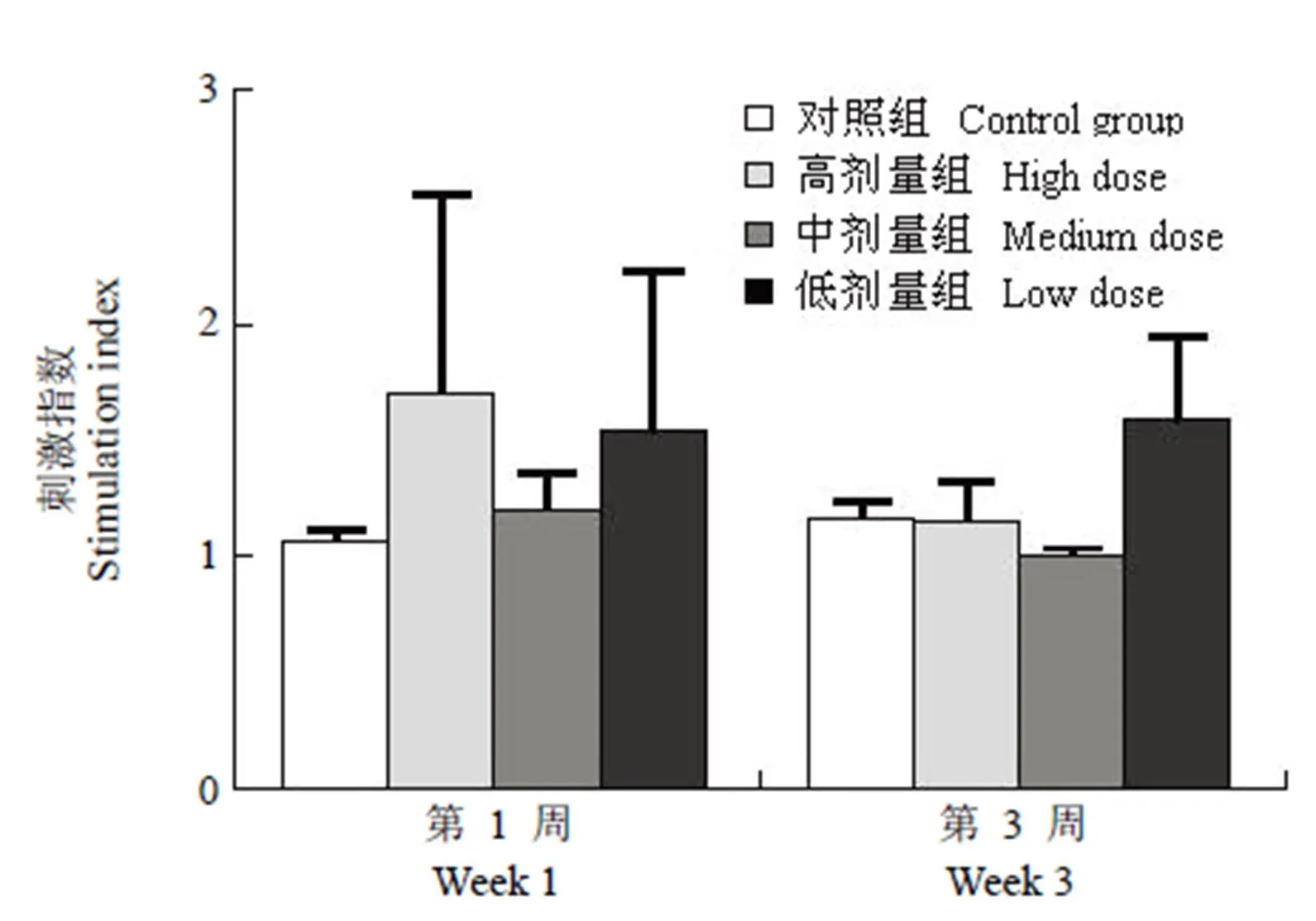
图 3 rPA 抗原特异性的淋巴细胞增殖
Figure 3 rPA-specific lymphocyte proliferation
2.2.2 FIS 抗原特异性的淋巴细胞增殖 在末次免疫后第 3 周,各试验组淋巴细胞刺激指数与 Al(OH)3佐剂对照组比较,均无显著差异(> 0.05)(图 4)。
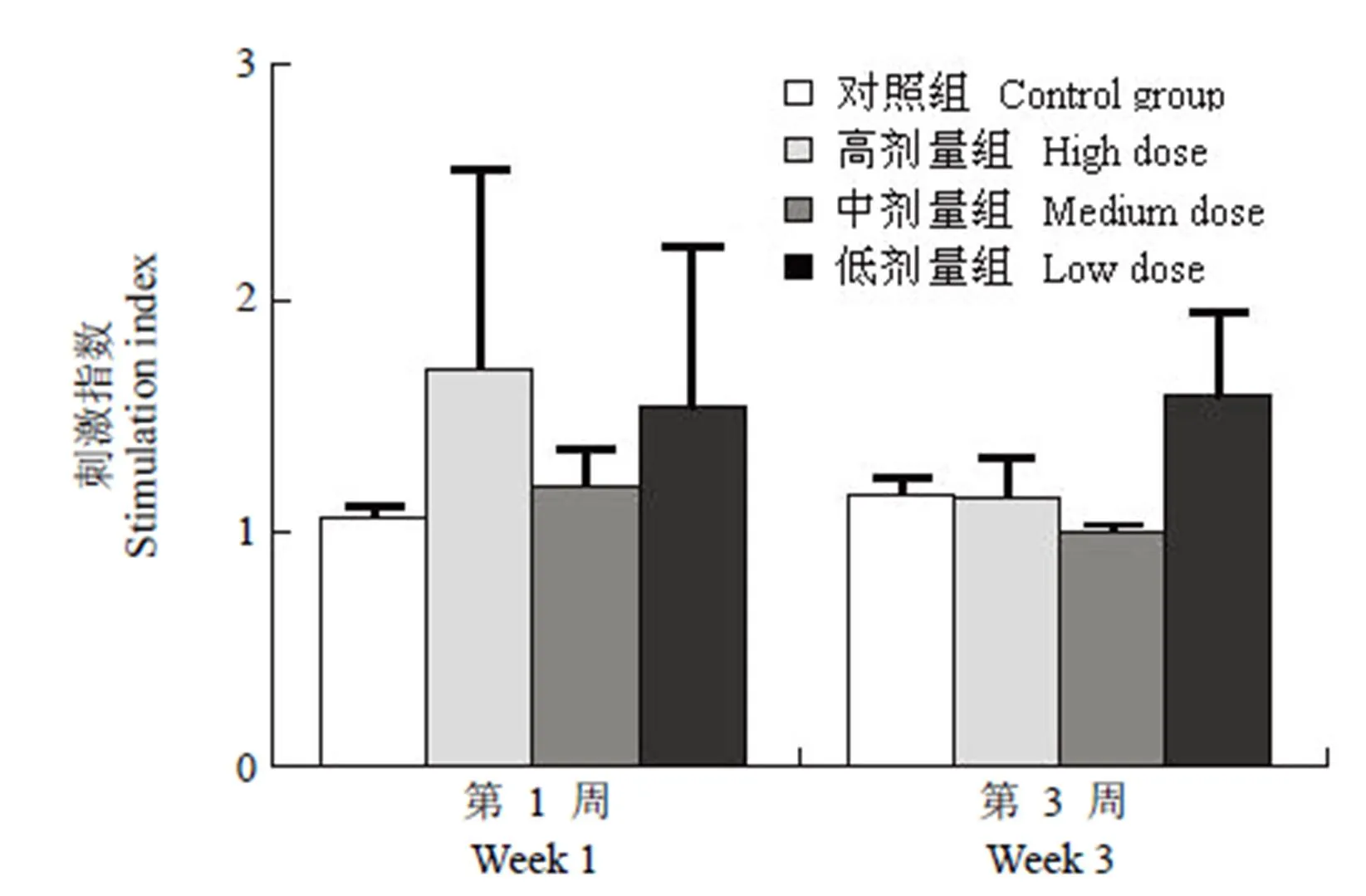
图 4 FIS 抗原特异性的淋巴细胞增殖
Figure 4 FIS antigen-specific lymphocyte proliferation
2.3 rPA 皮肤迟发型超敏反应实验
皮内注射 50 μg/ml 的 rPA 抗原 0.2 ml,24 h 后注射部位均能观察到红肿出现。以大于 5 mm ×5 mm的红肿为阳性反应,结果显示,高剂量组、中剂量组、低剂量组和活疫苗组的阳性反应发生率均为 100%,对照组无明显红肿,也无硬结块。
3 讨论
当前,新型炭疽疫苗的设计对 PA 的主导作用已达成共识,作为炭疽的主要免疫原,PA 对炭疽的预防保护有着关键作用,以 PA 为主要成分的疫苗通过诱导产生 PA 抗体对炭疽毒素产生中和作用,从而达到保护效果。但单一的 PA 组分对吸入性炭疽保护效果较差,对于部分免疫功能低下人群,PA 疫苗诱导产生的 PA 抗体滴度不高,也不足以提供完全的保护;另一方面,PA 疫苗,如AVA,对自然界某些炭疽杆菌分离株效果不佳[5]。同时考虑到炭疽杆菌在生命周期的不同形态,从芽孢出芽增殖,到营养态细胞,再到休眠体芽孢,能产生多种毒力因子,包括荚膜、外毒素等,可能存在多种具有保护作用的抗原。大量研究也表明,除了 PA,炭疽杆菌其他组分的抗原对疫苗的免疫保护效果起着重要作用[3, 6-8]。因此,单纯的 PA 疫苗需要改进成针对性更广泛的多靶向性疫苗,如 PA 加灭活芽孢,PA 加灭活菌体,PA 加荚膜多糖等。之前我们在小鼠模型上评价了 rPA 与灭活炭疽菌体抗原组成的双组分疫苗[9],本研究中,我们用 rPA 与甲醛灭活芽孢配伍,在豚鼠模型上初步评价该候选疫苗的免疫应答。
抗体检测结果表明,rPA 联合 FIS 免疫豚鼠后,高、中、低剂量组均可诱导产生高滴度 rPA 抗体和炭疽芽孢抗体,这对接种动物抵抗炭疽菌的毒素起到关键作用;活疫苗组在末次免疫 3 周后也能检测到 PA 抗体和芽孢抗体。不过,在高、中、低 3 个剂量范围内,各组间没有显著差异,表明候选疫苗的剂量范围对豚鼠可能需要进一步验证。此外,本研究中活疫苗是采用肌内注射,能保证进入体内的炭疽活芽孢数诱导较强的免疫应答,但实际应用中,炭疽活疫苗采用的是皮上划痕接种,难以控制进入人体的活芽孢数。
抗原特异性细胞免疫应答的检测中,ELISPOT 法在小鼠模型中大量应用,由于豚鼠相关免疫试剂缺乏,我们选择了淋巴细胞增殖试验(XTT 法)和皮肤迟发型超敏反应试验进行评估。XTT 法结果显示,rPA 和 FIS 抗原特异刺激后,高、中、低剂量组的刺激指数与氢氧化铝佐剂组比较均无统计学差异,这可能与该试验方法的灵敏度有关。皮肤迟发型超敏反应结果显示双组分炭疽候选疫苗和活疫苗均能诱导细胞免疫应答。
综合考虑,rPA 抗原配伍甲醛灭活芽孢,经氢氧化铝凝胶吸附后制备双组分炭疽候选疫苗,免疫豚鼠后,能诱导豚鼠产生较强的体液免疫应答和细胞免疫应答,表明该候选疫苗具有良好的免疫原性,有望发展成新型炭疽疫苗。
[1] Friedlander AM, Little SF. Advances in the development of next-generation anthrax vaccines. Vaccine, 2009, 27(S4):D28-D32.
[2] Skoble J, Beaber JW, Gao Y, et al. Killed but metabolically active Bacillus anthracis vaccines induce broad and protective immunity against anthrax. Infect Immun, 2009, 77(4):1649-1663.
[3] Wang BX, Han SB, You MQ, et al. Study on the correlation between immuno-protection and anti-spore IgG titer in potency test for live anthrax vaccine. Prog Microbiol Immunol, 2003, 31(4):5-8. (in Chinese)
王秉翔, 韩少波, 尤明强, 等. 炭疽活疫苗家兔免疫力与血清抗芽胞IgG关系的研究. 微生物学免疫学进展, 2003, 31(4):5-8.
[4] Chinese Pharmacopoeia Comminssion. Pharmacopoeia of the People's Republic of China. Volume 3, 2010. Beijing: China Medical Science Press, 2010:81. (in Chinese)
国家药典委员会. 中华人民共和国药典. 2010年版三部. 北京: 中国医药科技出版社, 2010:81.
[5] Cybulski RJ Jr, Sanz P, O'Brien AD. Anthrax vaccination strategies. Mol Aspects Med, 2009, 30(6):490-502.
[6] Kozel TR, Thorkildson P, Brandt S, et al. Protective and immunochemical activities of monoclonal antibodies reactive with the Bacillus anthracis polypeptide capsule. Infect Immun, 2007, 75(1): 152-163.
[7] Koehler TM. Bacillus anthracis physiology and genetics. Mol Aspects Med, 2009, 30(6):386-396.
[8] Lee DY, Chun JH, Ha HJ, et al. Poly-gamma-d-glutamic acid and protective antigen conjugate vaccines induce functional antibodies against the protective antigen and capsule of Bacillus anthracis in guinea-pigs and rabbits. FEMS Immunol Med Microbiol, 2009, 57(2):165-172.
[9] Wei D, Lu JB, Wang GZ. Research of the immunological response of anthrax candidate vaccine. China Med Pharm, 2012, 2(11):24-26. (in Chinese)
魏东, 卢锦标, 王国治. 炭疽双组分疫苗的研究. 中国医药科学, 2012, 2(11):24-26.
Preliminary immunological evaluation of a two-component anthrax candidate vaccine comprised of PA and Spores in Guinea pigs
LU Jin-biao, WEI Dong, WANG Guo-zhi
Division of Tuberculosis Vaccines, National Institutes for Food and Drug Control, Beijing 100050, China
To evaluate the immune response in guinea pigs vaccinated with a two-component anthrax candidate vaccine comprised of PA and spores.
Guinea pigs were randomly divided into five groups and vaccinated with high-dose, medium-dose and low-dose candidate vaccine, anthrax live vaccine and normal saline, respectively. Serum antibody, XTT cell proliferation and DTH were detected at different times after the last vaccination.
Antibody detection indicated the two-component anthrax candidate vaccine induced strong humoral immune response. XTT proliferation test showed specific proliferation of peripheral blood lymphocytes was not obvious. However, in all candidate vaccine groups DTH conversion rate to rPA was 100% in 24 h.
The two-component anthrax candidate vaccine could induce both humoral and cellular immune response in guinea pigs.
Bacillus anthracis; Anthrax vaccines; Guinea pigs; Immunological evaluation
WANG Guo-zhi, Email: tbtestlab@163.net
“艾滋病和病毒性肝炎等重大传染病防治”国家科技重大专项(2009ZX10004-804)
王国治,Email:tbtestlab@163.net
2012-12-09
10.3969/cmba.j.issn.1673-713X.2013.02.008

