桑叶HILIC特征指纹图谱研究
东莎莎,赵恒强,王 晓,崔清华,耿岩玲,刘代成,刘建华,王小如
(1.山东师范大学 生命科学学院,山东 济南 250014;2.山东省科学院 中药过程控制研究中心,山东省大型精密分析仪器应用技术重点实验室,山东省分析测试中心,山东 济南 250014;3.国家海洋局第一海洋研究所,青岛市现代分析技术及中药标准化重点实验室,山东 青岛 266061;4.山东中医药大学 药学院,山东 济南 250355)
桑叶为桑属植物桑树(Morus alba L.)的树叶,据《中药志》记载,桑叶具有“清风散热、清肺润燥、凉血明目”等功效[1]。现代研究表明,桑叶中含有多种活性物质,如黄酮类、生物碱、有机酸、氨基酸、挥发油、三萜类等化合物,具有降血糖、降血压、降低胆固醇、抗衰老、提高免疫力、抗菌、抗病毒、防癌等多种生理功能[2]。目前,国际国内市场对桑叶药材的需求越来越大[3],桑叶功能活性成分在食品、医药、保健品中的应用范围也越来越广[4]。然而不同产区桑叶的品质差别显著[5],严重影响了桑叶药材的开发利用和产品质量稳定性。因此,开展桑叶药材的质量控制和真伪鉴别方法研究,对控制桑叶药材质量,保障桑叶药材合理开发利用具有重要意义。
指纹图谱技术已成为国际上公认的控制中药或天然药物质量的最有效手段[6]。色谱指纹图谱有很强的分离效能,且能够与多种检测器联用,可实现各种波谱信息的定性及定量分析[7],现已普遍应用于中药的质量控制。桑叶药材所含化学成分种类多,极性差异大。根据不同种类化学成分的特点发展与之适应的分析方法,对有效表征桑叶化学成分,全面控制其质量具有重要意义。目前已发展了多种针对桑叶药材的指纹图谱方法,主要有高效液相色谱法(HPLC)[8-9]、气相色谱 -质谱法(GCMS)[10]、高效毛细管电泳法(HPCE)[11]等。另外,在2010版《中国药典》中也采用反相高效液相色谱法(RP-HPLC)对桑叶有效成分进行分析[12]。但HPLC法主要针对中等极性成分,GC-MS法主要针对弱极性和挥发性成分。HPCE法虽然较适用于中等极性和强极性化学成分的分析,但其灵敏度低、重复性差、与质谱联用复杂等缺点,限制了其应用。
亲水色谱法(HILIC)是20世纪90年代新发展起来的一种色谱分离技术,它采用强极性材料作为固定相,特别适合强极性和亲水性化合物的保留和分离[13]。另外,其采用高比例的乙腈-水作为流动相,与质谱联用可使目标化合物更易离子化、信号较强。相反,用RP-HPLC分离强极性和亲水性化合物时,流动相中因需要有高比例的水,而影响色谱柱使用寿命;另外,高比例的水会影响化合物在电喷雾离子源中的离子化效率,不利于质谱鉴别。由此可见,HILIC相比RP-HPLC更适合亲水性化合物的分析测定。目前,HILIC法在中草药和天然药物中极性成分的分析研究中已有应用[14-15],表现出良好的应用前景,但在桑叶药材强极性成分的分析和质量控制研究中的应用未见报道。本文首次开展桑叶药材的HILIC特征指纹图谱研究,为全面、有效地控制桑叶药材的质量和真伪鉴别提供方法和技术支持。
1 实验部分
1.1 仪器与材料
安捷伦1200高效液相色谱仪(自动进样器、在线脱气机、梯度泵、恒温箱、二极管阵列检测器);G6520A型飞行时间质谱仪,配有ESI离子源(美国Agilent公司);万分之一电子分析天平(Mettcer AE240)、指纹图谱相似度评价软件为“中药色谱指纹相似度评价系统”(中国药典委员会2004A);KQ2400 KDE型高功率数控超声波仪(昆山市超声仪器有限公司);Buchi型旋转蒸发仪(瑞士步琪有限公司)。
甲醇、乙腈(色谱纯,美国Fisher Scientific),甲醇(分析纯,天津市广成化学试剂有限公司),甲酸、甲酸铵(色谱纯,天津市科密欧化学试剂有限公司),其余试剂均为分析纯,实验用水为Milli-Q超纯水(18 MΩ)。12批不同产地的桑叶样品购于济南市各大药店,样品信息见表1。

表1 桑叶样品来源Table 1 Samples used in the works
1.2 供试品溶液的制备
桑叶药材粉碎,过20~40目筛,精密称取桑叶粉末0.5 g,置于具塞锥形瓶中,加入50 mL 50%甲醇,超声提取20 min,重复提取1次,将滤液过滤后合并,于55℃下旋蒸至干,用90%的乙腈重新溶解提取物并定容至5 mL,过0.22 μm微孔滤膜后作为供试品溶液。
1.3 亲水色谱条件
XBridgeTMAmide亲水色谱柱(4.6 mm×250 mm,3.5 μm,美国Waters公司),流动相:A为水(含0.2%甲酸、20 mmol/L甲酸铵、20%甲醇),B为乙腈,流速0.8 mL·min-1;柱温为25℃;检测波长为322 nm;进样量20 μL,梯度洗脱程序为:0→15→25→30→40→50→55→65→70 min,B%:92%→90%→90%→87%→86%→82%→80%→80%→50%。
1.4 电喷雾飞行时间质谱条件
进入ESI-TOF/MS的流动相流速为0.4 mL/min;ESI+模式;扫描范围(m/z):50~1 500;干燥气流速:10.0 L·min-1;喷雾气压:275.8 kPa;气体温度:300℃;毛细管电压:4.5 kV;破碎电压:120 V;锥孔电压:60 V;参比液:m/z 121.050 9,922.009 8;分辨率:9 500±500(922.009 8)。
2 结果与讨论
2.1 样品溶液制备方法的优化
超声提取技术利用超声产生的强烈振动,加速药物有效成分进入溶剂,从而提高提取率,缩短提取时间,并且避免了高温对提取成分的影响[16]。本研究将超声提取法用于桑叶亲水色谱指纹图谱研究。提取溶剂、提取时间、提取次数等参数均是影响提取率的关键因素。对比了纯水和不同比例甲醇水作为提取溶剂时的HILIC色谱图。结果表明,甲醇水提取物的HILIC色谱图中,色谱峰明显增多,分布均匀,峰强度亦明显增大,而纯水提取物色谱峰主要分布在色谱图的中间和后半时间段。说明HILIC法不但对强极性成分有较好的保留和分离效果,同时也适用于部分中等极性成分的保留和分离。其对应的亲水色谱图反应出的化学成分信息量明显增加,指纹特征更加明显,特征性更强,提高了指纹图谱的整体性和特征性。因此,最终采用50%甲醇水溶液作为提取溶剂。在优化的提取溶剂条件下,考察了不同提取时间(15、20、25 min)和提取次数(1、2、3次)的影响。结果表明,选择桑叶样品的提取时间为20 min,连续提取2次时,桑叶甲醇水提取物特征峰较高、指纹特征明显。因此,最终选择提取时间为20 min,连续提取2次。
2.2 亲水色谱条件优化
本研究在前期工作中曾对桑叶甲醇水提取液在反相色谱柱上的保留和分离情况进行初步研究。结果表明,桑叶甲醇水提取液在反相色谱图的前半段色谱峰峰形较差、分离度不好,说明桑叶提取物中的强极性成分在反相柱上的保留和分离效果较差。因此,本研究采用亲水柱用于桑叶甲醇水提取物的色谱分离研究,并对亲水色谱条件进行优化。由于桑叶的化学成分复杂,采用等度洗脱难以实现其分离,因此选择梯度洗脱。乙腈-水体系常用于亲水色谱流动相,桑叶甲醇水提取液中的强极性和中等极性成分共存,单独采用乙腈-水体系难以实现各化合物的有效分离。而采用乙腈-水-甲醇三元混合体系时,桑叶甲醇水提取物中各化合物具有良好的保留和分离效果。考察了流动相pH值和缓冲盐浓度等对亲水色谱分离效果的影响,结果表明,选择0.2%HCOOH+20 mmol/L HCOONH4作为流动相A时,桑叶甲醇水提取物中各化合物的分离度较好,峰形尖锐。采用光电二极管阵列检测器考察桑叶样品在不同波长(100~400 nm)下的亲水色谱图,结果表明,在203、256、265 nm和322 nm时色谱峰均较多,但在203、256 nm和265 nm时,色谱图基线不平,干扰较大;而在322 nm处色谱峰较多,各峰分离度较好,基线平稳,因此,本研究选择检测波长为322 nm。改变色谱柱温度对色谱分离效果影响不大,但温度对色谱柱的重现性有一定影响,在本研究过程中,色谱柱温度控制在25℃(室温),以保证色谱分析过程的重现性和稳定性。在优化的亲水色谱条件下,桑叶甲醇水提取物的亲水色谱图如图1所示。
2.3 指纹图谱的建立及特征峰的指认
取10批不同批次的桑叶样品,按“1.2”方法制备成供试品溶液,按“1.3”亲水色谱条件进样分析,记录其色谱图,建立桑叶样品的HILIC特征指纹图谱,10批桑叶样品的色谱图见图2。在本研究所建立的分析系统下,10批桑叶甲醇水提取物化学成分的出峰时间均在65 min之前,主要有17个共有峰。其中,特征性明显的主要有4个色谱峰,这4个色谱峰即构成桑叶HILIC指纹图谱的特征峰(分别为峰3、9、11、15)(见图1)。其中9号峰(绿原酸)的峰面积最大,化学性质稳定,保留时间以及峰面积的重复性良好,特征性强,与其它相邻峰分离良好,采用化学工作站计算该峰的纯度发现该峰为一纯化合物,因此选择9号峰为参照峰(相对保留时间和相对峰面积均设为1),用于计算各共有峰的相对保留时间及相对峰面积(见表2~3)。从表2~3数据可以看出,各共有峰相对保留时间的RSD均小于5%,进一步说明本方法的可靠性;各峰相对峰面积的RSD值较大,但不同桑叶样品指纹图谱的轮廓特征一致(见图2)。
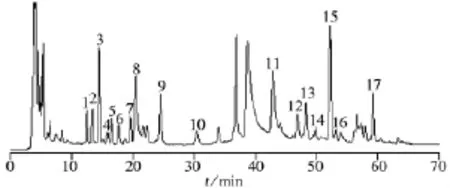
图1 桑叶提取物的亲水色谱图Fig.1 HILIC chromatogram for the extract of mulberry leaves

图2 10批桑叶的HILIC特征指纹图谱Fig.2 HILIC characteristic fingerprint of 10 batches of mulberry leaves

表2 相对保留时间Table 2 Relative retention time
2.4 方法学考察
2.4.1 精密度 精密称取桑叶样品,按“1.2”方法制成供试品溶液,按“1.3”亲水色谱条件连续进样6次,分别测得其中4个特征峰的峰面积和保留时间,计算其相对标准偏差(RSD)。4个特征峰保留时间的RSD依次为0.86%、0.62%、0.28%、0.22%,均小于1%,峰面积RSD依次为1.9%、2.1%、3.8%、0.59%,均小于5%,结果表明仪器精密度良好。
2.4.2 重复性 精密称取同一桑叶样品6份,按“1.2”方法制成供试品溶液,按“1.3”亲水色谱条件进样测定,测得4个特征峰的峰面积和保留时间,并计算其相对标准偏差。4个特征峰保留时间的RSD依次为0.65%、0.38%、0.28%、0.26%,均小于1%,峰面积RSD依次为1.2%、4.5%、1.3%、4.2%,均小于5%,结果表明方法重现性良好。2.4.3 稳定性 按照“1.3”亲水色谱条件,将供试品溶液分别在0、2、4、8、12、24 h进样分析,记录色谱图。4个特征峰保留时间的RSD依次为0.81%、0.75%、0.24%、0.18%,均小于1%,峰面积RSD依次为2.7%、2.9%、5.0%、5.0%,均不大于5%,表明样品在24 h内化学性质稳定。

表3 相对峰面积Table 3 Relative peak area
在优化的亲水色谱条件下,采用亲水色谱-电喷雾飞行时间质谱联用技术,对桑叶甲醇水提取物HILIC色谱图中的4个特征峰进行表征。结果表明,在正离子模式下,4个特征峰有较好的质谱信号。采用离子源预设的参数,各特征峰的信号较强。根据电喷雾飞行时间质谱获得的化合物的精确分子量信息和DAD检测器获得的紫外吸收信息,并参考相关文献对4个特征峰进行了初步鉴别,结果见表4。从表4可以看出,4个特征峰中3、9、11号峰分别为槲皮苷、绿原酸、芦丁,均为桑叶中的重要活性成分。
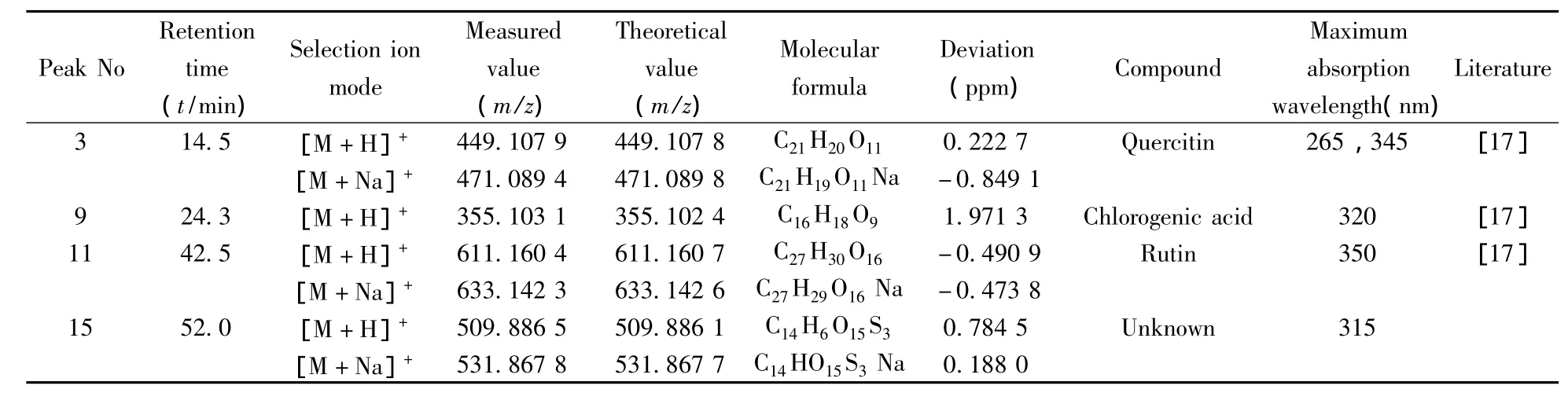
表4 4个特征峰的电喷雾飞行时间质谱鉴别结果Table 4 ESI-TOF/MS accurate mass measurements of the 4 characteristic peaks
2.5 相似度评价
通过“中药色谱指纹图谱相似度评价系统”(《中国药典》2004 A版)对10批山东产区桑叶药材的指纹图谱进行相似度分析。首先将色谱工作站数据导入中药指纹图谱相似度计算软件,选定上述17个共有峰进行谱峰匹配,采用共有模式作为对照指纹图谱,用于10批桑叶药材的相似度评价,相似度评价结果均在0.90以上(见表5),说明这10批桑叶药材的质量差别不明显。而两个安徽、湖北来源的桑叶样品相似度较低,其值均在0.90以下,说明不同产区的桑叶药材质量差异显著。由此可以看出,本研究发展的HILIC特征指纹图谱能够反映桑叶药材的固有属性,结合相似度分析,可以用于不同产区桑叶药材的辨别。
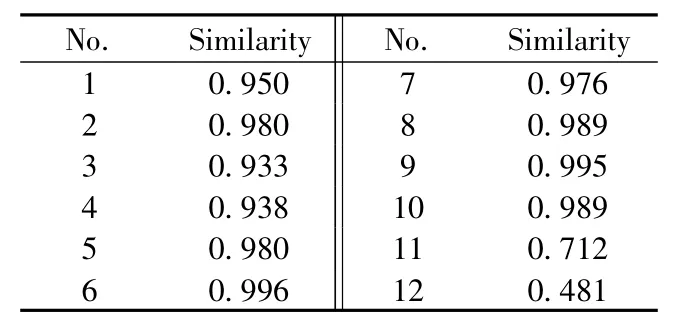
表5 相似度计算结果Table 5 Similarity calculations
3 结论
本研究以桑叶甲醇水提取物为研究对象,建立了桑叶药材的HILIC特征指纹图谱。在优化的亲水色谱条件下,桑叶甲醇水提取物中的各化合物分离良好。方法学考察结果表明,该方法具有较好的精密度、重复性和稳定性。在多批次样品分析的基础上建立的桑叶亲水色谱指纹图谱,结合相似度分析可用于不同产区桑叶药材的正确区分。本研究为更加全面、有效地控制桑叶药材的质量和真伪鉴别研究提供了方法和技术支持。
[1] Xiao P G,Li D P,Yang S L.Modern Chinese Materia Medica(Ⅲ).Beijing:Chemical Industry Press(肖培根,李大鹏,杨世林.新编中药志(第3卷).北京:化学工业出版社),2001:485.
[2] Wu H H,Jiang H D,Gao C H,Qian W C,Lou L J,Liu L P.Chin.J.Pharm.Anal.(吴好好,蒋惠娣,高处寒,钱文春,楼丽静,柳丽萍.药物分析杂志),2007,27(3):374-377.
[3] Wu S F,Wang S Y,Tang J.Food Sci.(吴胜芳,王淑英,汤坚.食品科技),2003,29(10):95-97.
[4] Liu X M,Xiao G S,Chen W D.J.Chin.Med.Mater.(刘学铭,肖更生,陈卫东.中药材),2001,24(2):144-147.
[5] Lu Z H,Wu S W,Tang J,Yang N G,Zhang Y,Cao W.Food Sci.(鲁战会,吴生文,唐健,杨宁国,张燕,曹薇.食品科学),2007,1:75-79.
[6] Xu J N,Long Q,Qin X L.Lishizhen Med.Mater.Med.Res.(徐今宁,龙卿,秦秀丽.时珍国医国药),2006,17(11):2311-2313.
[7] Yi L Z,Wu H,Liang Y Z.Chin.J.Chromatogr.(易伦朝,吴海,梁逸曾.色谱),2008,26(2):166-171.
[8] Li Z,Hu H R.World Journal of Integrated Traditional and Western Medicine(李钟,胡海荣.世界中西医结合杂志),2007,2(5):280-283.
[9] Liu L,Sun L,Yang W J,Ainiwaer A.J.Xinjiang Med.Univ.(刘龙,孙莲,杨文菊,艾尼娃尔·艾克木.新疆医科大学学报),2008,31(5):585-587.
[10] Sun L,Yang W J,Liu L.China J.Chin.Mater.Med.(孙莲,杨文菊,刘龙.中国中药杂志),2009,34(7):879-883.
[11] Zhang J,Tan H R,Mu L,Liu C L,Lu C Z,Zhan Y L,Xu J P.Sci.Sericult(张军,檀华蓉,穆莉,刘朝良,陆翠珍,詹永乐,徐家萍.蚕业科学),2008,34(1):119-123.
[12] China Pharmacopoeia Committee.China Pharmacopoeia(Vol.Ⅰ).Beijing:China Medical Science Press(国家药典委员会.中华人民共和国药典(1部).北京:中国医药科技出版社),2010:279.
[13] Alpert A J.J.Chromatogr.A,1990,499:177 -196.
[14] Li R P,Huang J X.Progr.Chem.(李瑞萍,黄俊雄.化学进展),2006,18(11):1508-1513.
[15] Zhao H Q,Chen J H,Shi Q,Li X,Zhou W H,Zhang D L,Zheng L,Cao W,Wang X R,Lee F S.J.Sep.Sci.,2011,34(19):2594-2601.
[16] Cheng Y M,Chen R H.Lishizhen Med.Mater.Med.Res.(程咏梅,陈仁华.时珍国医国药),2007,18(6):1445-1447.
[17] You Y Y,Wan D G.Lishizhen Med.Mater.Med.Res.(游元元,万德光.时珍国医国药),2011,22(11):2596-2598.

