对海盐制备试剂级氯化钠实验的改进
桑雅丽
(赤峰学院化学化工学院,内蒙古赤峰024000)
对海盐制备试剂级氯化钠实验的改进
桑雅丽
(赤峰学院化学化工学院,内蒙古赤峰024000)
本文在给定的实验条件下,结合实验实际情况,对实验装置及实验内容进行了改进,同时通过多组实验探索不同的试剂用量对氯化钠的产率和纯度的影响,从中找出BaCl2溶液,Na2CO3溶液和盐酸的最佳用量.节省了实验时间,提高了产品等级和试剂纯度,达到了较好的实验效果.
氯化钠;提纯;试剂用量;实验装置
海盐的主要成分是氯化钠.除了氯化钠外,还含有泥砂、草屑等不溶性杂质以及钾、钙、镁、硫酸盐等可溶性无机盐.若要提取试剂级氯化钠必须除去各种杂质.在实验开展过程中,能够让学生练习溶解、过滤、蒸发、结晶、气体的发生和净化等基本操作,因此一直作为无机化学实验课程的保留实验.但是,在实验过程中,实验装置和试剂的用量及浓度对实验进度和结果有一定的影响.在给定的实验条件和试剂的用量范围下,本文通过实验对海盐制备试剂级氯化钠的反应装置进行了改进,对部分实验内容和试剂用量进行了探索.
1 实验原理
海盐中的不溶性杂质可用溶解过滤的方法除去.可溶性无机盐可以用化学方法除去[1]:在海盐溶液中加入稍过量的BaCl2溶液时,可将SO42-转化为难溶解的BaSO4沉淀而除去.过滤溶液,除去BaSO4沉淀.再加入NaOH和Na2CO3溶液,由于发生了下列反应:

食盐中的杂质Mg2+,Ca2+及沉淀SO42-时加入的过量Ba2+便相应地转化为难溶的Mg(OH)2,CaCO3,BaCO3沉淀而过滤除去.过量的NaOH和Na2CO3可用盐酸中和.少量可溶性杂质(如KCl),通过向饱和NaCl溶液中通入HCl气体,由于同离子效应,NaCl晶体析出,而KCl的溶解度比NaCl大,无需对产品重结晶,K+残留在母液中被除去.吸附在NaCl晶体上的HCl可用酒精洗涤除去,再进一步水浴加热,除掉少量水、酒精和HCl,即得到纯度很高的NaCl[2].

图1 原精制氯化钠装置图
2 原实验内容
2.1 海盐提纯
用台秤称取10.0g海盐,放入小烧杯中.加入35mL蒸馏水,用酒精灯加热,并搅拌促其溶解.至沸,在搅拌下,滴加1-2mL1mol·L-1BaCl2溶液至沉淀完全(BaCl2溶液滴入时不再产生新的浑浊),继续加热煮沸10分钟,使BaSO4颗粒长大而易于沉淀和过滤.为了试验沉淀是否完全,取下烧杯,待沉淀沉降后于上层清液中加入1-3滴BaCl2,至无浑浊产生为止.在上述液体中趁热加入1mL2mol?L-1NaOH溶液和4-5mL1mol·L-1Na2CO3溶液,待沉淀沉降后,过滤,弃去沉淀.将滤液转移至广口瓶,搅拌下逐滴加入2mol·L-1HCl,调至溶液的pH=1.组装HCl气体发生装置,并将HCl气体的导出管与缓冲瓶、装有NaCl母液的广口瓶、装有NaOH溶液的吸收瓶,依次相连,最后将尾气吸收管导入盛有NaOH稀溶液的烧杯中,二次吸收过剩的HCl.称取20.0g化学纯NaCl于蒸馏烧瓶内,用滴液漏斗将20mL浓硫酸缓慢滴加至烧瓶内,用酒精喷灯控制气体发生速率,使HCl气体平稳放出,经缓冲瓶至装有NaCl母液的广口瓶,此时有NaCl晶体析出.反应至无NaCl晶体析出时,停止反应.冷却,减压过滤,95%乙醇淋洗2-3次后,水浴烘干,称量,计算产率.并对产品的纯度进行检验.
2.2 纯度检验
Fe3+的限量分析
在酸性介质中,Fe3+与SCN-生成血红色配离子[Fe(SCN) n](3-n)+(n=1~6),其颜色,随配位体数目n的增大而变深.
试样溶液配制:分析天平称量3.00g NaCl于25mL比色管中,10mL蒸馏水溶解,加入2.00mL25%KSCN溶液和2mL3mol·L-1HCl溶液,用蒸馏水稀释至刻度,摇匀.将试样溶液与标准溶液进行目视比色,确定产品的纯度等级.
SO42-的限量分析
SO42-与BaCl2溶液反应,生成难溶的BaSO4白色沉淀而使溶液产生混浊.溶液的混浊度,在BaCl2的含量一定时,与SO42-浓度成正比.
试样溶液配制:分析天平称量1.00g NaCl于25mL比色管中,10mL蒸馏水溶解,加入3.00mL25%BaCl2溶液、1mL3mol·L-1HCl溶液和5mL95%乙醇,用蒸馏水稀释至刻度,摇匀.将试样溶液与标准溶液进行目视比色,确定产品的纯度等级.
3 改进实验内容
常规的海盐制备试剂级氯化钠实验存在着下列问题:(1)实验过程中使用酒精喷灯作为加热装置(见图1),导致反应温度过高,反应速率过快,大量气体溢出,难以控制氯化氢气体发生速率.(2)实验所用仪器为普通支管烧瓶和广口瓶,市售恒压滴液漏斗多为磨口玻璃制品,故不适用于本实验反应过程.(3)为了试验SO42-沉淀是否完全,直接在溶液中滴加BaCl2溶液时,由于溶液中的沉淀不能在短时间内沉降完全,此时溶液浑浊.因此很难判断出SO42-是否已经完全沉淀.导致成品中含有杂质离子,除杂不彻底,产品纯度低,从而影响实验结果.(4)实验除杂过程中给出Na2CO3溶液的用量范围,但没有明确的体积用量,无法判断其用量对产品的产率和纯度的影响.一般说来,引入过多的Na2CO3,后续反应需要过多的盐酸中和,因此除杂过程引入了过多的NaCl,导致NaCl的产率比实际产率偏高,为实验带来误差.(5)中和滤液用的盐酸浓度过低,引入大量水溶液,致使溶液中NaCl的浓度过低,后续反应中通入氯化氢气体后产品析出量过少或很难达到饱和析出,从而降低了NaCl的实际产率.(6)过滤溶液中的沉淀时采用普通过滤方法,沉淀颗粒附着在滤纸上,过滤速度很慢,导致此过程耗时过长.
3.1 实验装置的改进

图2 改进后的精制氯化钠装置图
在氯化氢气体发生装置中(见图2),用酒精灯代替了酒精喷灯,避免了温度过高,HCl气体产生过快,不易控制气体发生速度的情况.使用酒精灯后,产生HCl气体速度平稳,易于控制.可防止气体溢出或液体倒吸.同时将实验用的恒压滴液漏斗简化为普通滴液漏斗,HCl气体产生过程中,烧瓶内气体增多产生压强,导致滴液漏斗滴加过慢或者气体由滴液漏斗溢出.故用滴液漏斗将浓硫酸全部滴加至烧瓶内,然后关闭旋塞,用酒精灯控制气体发生速率,使HCl气体平稳放出.在一定程度上加快了反应进程,有效防止了气体的溢出,避免环境受到污染.
3.2 实验内容的改进
在SO42-除杂过程中,增加离心检验步骤,具体操作:为了试验SO42沉淀是否完全,取1mL溶液于离心管中,离心机内离心分离1-2min,然后于离心管的上层清液中加入2滴BaCl2,检验有无浑浊产生,至无浑浊产生为止.将化学除杂后得到的溶液使用普通过滤方法改为减压过滤,加快了过滤速度,缩短了实验时间,提高了实验效率.将调节溶液pH=1的2mol·L-1盐酸溶液用6mol·L-1盐酸溶液代替.除杂后的滤液中含有大量的OH-和CO32-,因此用来中和滤液的盐酸用量很大,使用低浓度的盐酸溶液会在反应中引入大量的水,导致滤液中的NaCl浓度偏低.使用6mol·L-1盐酸溶液代替后,在一定程度上保持了原滤液中NaCl的浓度,通入氯化氢气体后很快析出NaCl晶体,减少了实验失败的风险.
3.3 试剂用量的改进
通过多组实验(见表1),对比探索BaCl2溶液的用量范围(1.0-2.2 mL)、Na2CO3溶液的用量范围(4.0-5.2 mL)和盐酸溶液的用量范围(1.7-2.2 mL)发现:当加入1.1mLBaCl2溶液、4.1mLNa2CO3溶液和1.7mL盐酸溶液时,得到NaCl产品为8.2g,产率为82%,Fe3+纯度等级为二级,SO42-纯度等级为一级,此时产品的纯度和试剂等级最好.当逐渐增加BaCl2溶液用量时,引入溶液中的Cl-不断增多;当逐渐增加Na2CO3溶液用量时,引入溶液中的Na+也不断增多,随着溶液中Cl-和Na+的不断增多,向饱和NaCl溶液中通入HCl气体时,析出的NaCl晶体也会增多,从而提高了产品的实际产量和产率,但是却降低了产品的纯度和试剂等级.给实验带来不必要的误差.
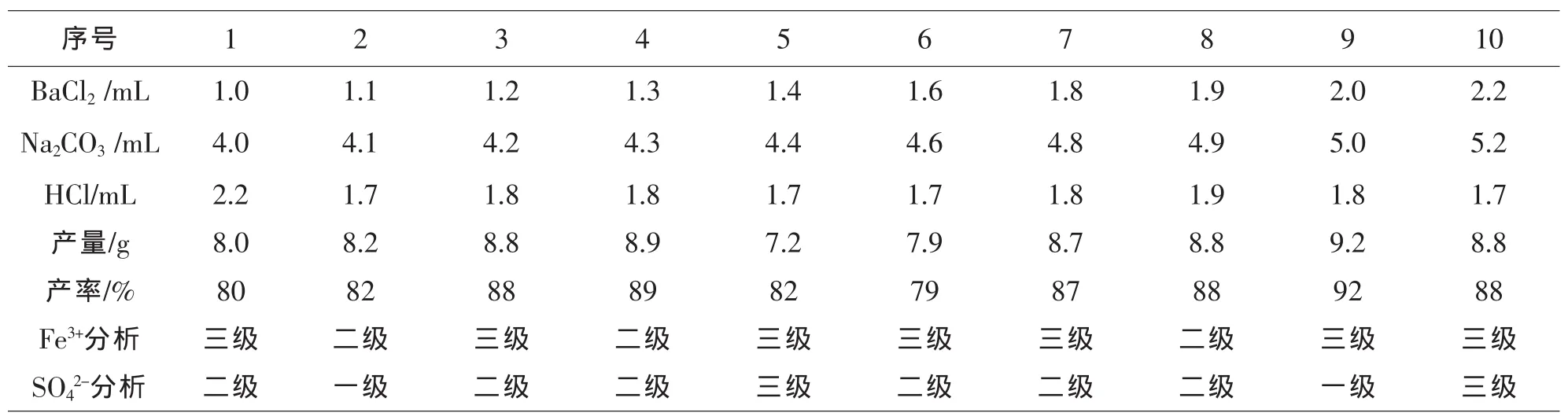
表1 实验制备试剂级氯化钠的试剂用量、产量产率及纯度检验数据
4 结论
本文依据实验教材,结合实验开展的条件和实验过程中出现的问题,通过实验对部分实验装置和实验内容进行了改进,同时探索了所用BaCl2溶液和Na2CO3溶液的最佳用量及其与产品的产率和纯度之间的关系.在此实验改进的基础上开展学生实验,不但节省了实验时间和试剂用量,而且提高了实验效率.
〔1〕北京师范大学无机化学教研室,等.无机化学实验(第三版)[M].北京:高等教育出版社,2001.
〔2〕袁红梅,赵雪英.由海盐制备试剂级氯化钠[J].枣庄学院学报,2006(5).
O614.112
A
1673-260X(2013)09-0007-02

