D201树脂对绿原酸的吸附、解吸性能研究
赵升强,欧仕益,邱瑞霞
(暨南大学食品科学与工程系,广东广州 510632)
绿原酸是由咖啡酸与奎尼酸组成的缩酚酸,异名咖啡鞣酸,化学名3-O-咖啡酰奎尼酸,是植物经莽草酸途径代谢产生的一种苯丙素类化合物[1-2]。绿原酸具有多种生物活性,如清除自由基、降压、预防诱变和癌肿、护肝利胆、抗菌消炎等[3-6]。它不仅可以入药,而且广泛应用于保健食品。因绿原酸主要存在于忍冬科忍冬属、菊科蒿属等植物中[7],目前绿原酸的提取分离研究大都集中于杜仲、金银花等药用植物,而从大众作物废料如薯类洗液中进行提取的研究并不多。马铃薯中的酚酸含量占干重的0.1%~0.3%,芽中含量高达0.8%,约有50%存在于皮及邻近组织中,而马铃薯酚酸中90%为绿原酸[8-11]。马铃薯在我国种植广泛,且其产量逐年上升,其产生的经济效益越来越受到人们关注,国内马铃薯精制淀粉以20%的速度增长,马铃薯休闲食品的生产也日趋火热[12],马铃薯加工业不断扩大发展,其生产过程中产生大量马铃薯洗液,现阶段都以废水形式处理掉。而马铃薯洗液中含有大量水溶性酚酸,马铃薯去皮去芽清洗过程酚酸大都随洗液流失掉,因此从马铃薯洗液中提取绿原酸具有重要意义。大孔树脂因具有良好的吸附性能,吸附迅速,解吸容易等特点,而被广泛应用于水溶性化合物的纯化[13]。从马铃薯洗液中提取绿原酸尚未见诸报道,但欧仕益[14]等人发现D201树脂能从麸皮类酶解液中有效分离阿魏酸,传统方法如沉淀法和萃取法多用于较高绿原酸含量植物组织中绿原酸的提取[15],而预实验中发现马铃薯洗液中绿原酸含量较低且利用传统方法中的乙醇沉淀法和乙酸乙酯萃取法提取绿原酸并不可行。本文对D201对绿原酸的吸附解吸特性进行基础研究,旨在为采用D201从马铃薯洗液中提取绿原酸进行工业化生产提供理论借鉴。
1 材料与方法
1.1 材料与仪器
D201、AB-8 安徽三星树脂科技有限公司;D301 苏州争光树脂有限公司;绿原酸标准品 湖南怀化盛德生物科技有限责任公司;无水乙醇、氯化钠、盐酸、冰醋酸 均为分析纯。
自制马铃薯洗液(马铃薯洗净去皮,清洗,切成厚1~2mm,长款1~2cm 的薄片,清洗,合并洗液)。
UV-9600紫外-可见分光光度计 北京瑞利分析仪器公司;SHA-BA水浴恒温振荡器 金坛市医疗仪器厂;部分自动收集器 上海沪西分析仪器厂有限公司;玻璃柱(10mm×300mm)。
1.2 实验方法
1.2.1 树脂预处理[14]树脂用去离子水浸泡24h,然后用2倍体积质量分数4%HCl浸泡3h,适当搅拌,然后用去离子水洗至中性;然后用2倍体积质量分数4%NaOH浸泡3h,不时搅拌,然后用去离子水洗至中性,用去离子水浸泡备用。
1.2.2 静态吸附实验 用量筒量取3mL经预处理的各种型号湿树脂于具塞锥形瓶中,加入8mg/mL绿原酸溶液,置于30℃摇床中在90r/min下震摇24h,测定上清液中绿原酸浓度,计算树脂对绿原酸的吸附量;然后将上述树脂用5BV去离子水清洗后加入洗脱剂(去离子水∶无水乙醇∶浓盐酸 =24∶25∶1(V/V/V)),置于 30℃摇床中在 90r/min下震摇24h,测定上清液中绿原酸浓度,计算树脂解吸率。
解吸率(%)=树脂解吸绿原酸质量(mg)/树脂吸附绿原酸质量(mg)×100
1.2.3 树脂对绿原酸的最低吸附浓度的确定 取10mL树脂于150mL具塞锥形瓶中,加入浓度为1mg/mL的绿原酸溶液100mL,于室温下搅拌达到吸附平衡,测定上清液中绿原酸浓度,得到该树脂的最低吸附浓度。
1.2.4 树脂对绿原酸的吸附动力学 分别取5.0mL树脂于7个100mL具塞锥形瓶中,分别加入8mg/mL的绿原酸溶液50mL置于30℃摇床中在90r/min下震荡,分别于 0.5、1、1.5、2.5、3.5、4.5、5.5h 取 20mL 样品测定溶液绿原酸浓度,根据吸附率随吸附时间的变化关系得到吸附动力学曲线。
吸附率(%)=树脂吸附绿原酸质量(mg)/吸附前溶液中绿原酸质量(mg)×100
1.2.5 洗脱剂的选择 取10mL树脂装柱,将100mL 8mg/mL绿原酸溶液(自然pH)以9BV/h过柱完后用5BV去离子水洗涤,再用100mL不同配比的洗脱剂进行洗脱,洗脱流速为6BV/h,测定洗脱液中绿原酸的浓度,确定最适洗脱剂。
1.2.6 动态洗脱曲线绘制 取10mL树脂装柱,将一定量绿原酸过柱完后用5BV去离子水洗涤,采用一定量洗脱剂进行洗脱,洗脱流速为6BV/h,每次收集9mL洗脱液测定绿原酸浓度。以洗脱液中绿原酸浓度为纵坐标,洗脱液体积(按柱体积计)为横坐标绘制动态解吸曲线。
1.2.7 验证实验 向1L自制马铃薯洗液中加入100mL树脂后搅拌2h,后用500mL洗脱剂洗脱1.5h,洗脱液真空低温旋转蒸发乙醇,然后用HPLC[16]测定吸附前和解吸后溶液中绿原酸纯度,为防止样液褐变,向样液中加入100mg NaHSO[17]3。
1.2.8 绿原酸含量测定[18]精确称取绿原酸标准品299.9mg,用50%甲醇定容至100mL。分别吸取标准液0、0.2、0.4、0.6、0.8、1.0mL,用 50% 甲醇定容至100mL,在波长326nm下测定吸光度,同时用50%甲醇溶液作为空白,以吸光度A为纵坐标,浓度C(μg/mL)为横坐标作标准曲线,得标准曲线回归方程为A=0.0523C-0.0045(R2=0.9994);根据标准曲线计算样品液中绿原酸浓度。
2 结果与分析
2.1 树脂确定
吸附量和解吸率是评价树脂性能的重要指标,由表1中可以看出,D201和D301都有较高的吸附量和解吸率,D301吸附量最大。取10mL树脂采用湿法装柱,将100mL 8mg/mL绿原酸溶液(自然pH)以9BV/h过柱后按1.2.6法对D201和D301进行动态洗脱。
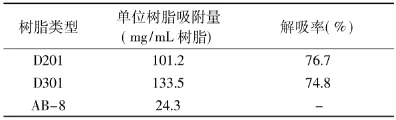
表1 不同树脂的绿原酸吸附容量与洗脱效果Table1 Adsorption and desorption capacity of three kinds of resins for chlorogenic acid
图1是D201和D301动态洗脱曲线。从图中可以看出,D201具有较高初始洗脱浓度且洗脱峰集中;采用5BV洗脱液洗脱时,D201洗脱率可达82%,而D301仅有55.1%;两者总体洗脱率D201为91.7%而D301为82.8%。最低吸附浓度也是评价树脂树脂吸附特性的重要指标,它衡量树脂在什么浓度以上能从提取液中有效吸附绿原酸。经测定,D201对绿原酸的最低吸附浓度为0.6μg/mL。综合考虑,选择D201作为研究对象。
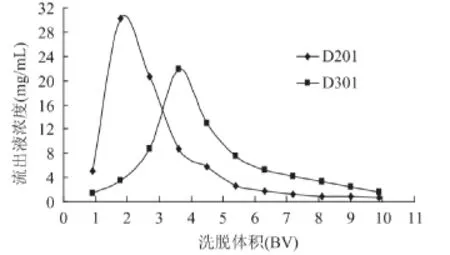
图1 D201和D301动态洗脱曲线Fig.1 Desorption dynamic curves of D201 and D301 resins for chlorogenic acid
2.2 静态吸附动力学
吸附速率也是评价树脂的一个重要指标,选用的树脂应该不仅具有高的吸附量,而且具有快速达到吸附平衡的能力。实验表明:D201对绿原酸吸附速度较快,2h后已基本达到吸附平衡(图2)。
2.3 洗脱剂的选择
实验研究了不同配比的洗脱剂对绿原酸的洗脱效果(表2)。从表中可以看出,含盐酸的洗脱剂洗脱效果最为理想,最高可达91.72%;乙醇浓度对解析效果亦有重要影响,实验表明50%(V/V)乙醇最为合适。实验中还发现乙醇浓度高于60%时洗脱会产生大量气泡,低于40%时洗脱效果不理想。综合考虑,以选择无水乙醇∶浓盐酸∶去离子水 =50∶2∶48(v/v/v)洗脱剂为宜。
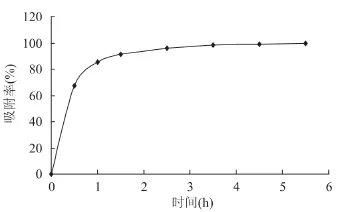
图2 吸附动力学曲线Fig.2 Adsorption kinetic of D201 resins for chlorogenic acid

表2 洗脱剂配比对洗脱效果的影响Table2 Effect of elution solutions on the desorption capacity of D201 for chlorogenic acid
2.4 验证实验
图3~图5分别是绿原酸标准品,绿原酸提取浓缩液和马铃薯洗液的HPLC图,从中看出经过D201吸附后,洗脱液中的杂质大幅减少,绿原酸浓度和纯度都得到较大提升。
图3 绿原酸标准品HPLC图Fig.3 The HPLC of standard chlorogenic acid sample
3 结论

图4 绿原酸洗脱液HPLC图Fig.4 The HPLC of chlorogenic acid in eluting sample
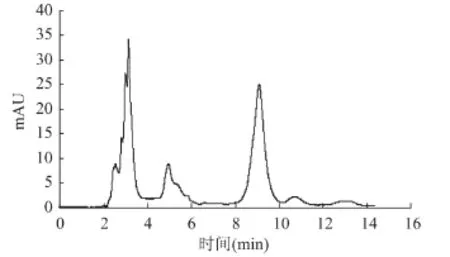
图5 绿原酸马铃薯洗液HPLC图Fig.5 The HPLC of chlorogenic acid in potato washing water
D201对绿原酸具有较大吸附容量,易被解吸且洗脱效果好,并能在极低浓度溶液中发生吸附。绿原酸的最佳洗脱剂配比为无水乙醇∶浓盐酸∶去离子水=50∶2∶48(v/v)。实验表明可利用D201提取纯化马铃薯洗液中绿原酸,但提取工艺有待进一步优化,且添加的NaHSO3对绿原酸提取率的影响有待进一步研究。
[1]尹青,张华.中空型聚苯乙烯基阴离子交换纤维吸附分离绿原酸的研究[J].食品科技,2009,34(6):191-194.
[2]周舟,彭淼,钟晓红.绿原酸提取分离及检测研究进展[J].长江大学学报,2011,8(2):243-246.
[3]刘军海,裘爱泳.大孔吸附树脂对杜仲叶中绿原酸吸附性能研究[J].中成药,2007,29(7):1090-1093.
[4]Sweetie P,Kanatt,Ramesh C,et al.Potato peel extract—a natural antioxidant for retarding lipid peroxidation in radiation processed lamb meat[J].Agricultural and Food Chemistry,2005,53:1499-1504.
[5]Tracy L,Farrell TP,Dew LP,et al.Absorption and Metabolism of chlorogenic acids in cultured gastric epithelial monolayers[J].Drug Metabolism and Disposition,2011,39:2338-2346.
[6]常翠青,陈吉棣,王香生.有机酸对人血管内皮细胞的保护作用[J].中华预防医学杂志,2001,35(2):79-82.
[7]李玉珍,肖怀秋.绿原酸分析测定方法研究新进展[J].江苏调味副食品,2010,27(6):39-43.
[8]张春秋.马铃薯块茎中类胡萝卜素和酚酸的研究[D].北京:中国农业科学院,2007.
[9]吴文标,盛德贤,吕世安,等.马铃薯酚类化合物的研究[J].中国马铃薯,2001,15(3):158-162.
[10]周胜男.马铃薯中酚类物质的提取、纯化及检测方法研究[D].合肥:安徽农业大学,2010.
[11]Hyon WI,BOON SS,Seung UL,et al.Analysis of phenolic compounds by high-performance liquid chromatography and liquid chromatography/mass spectrometry in potato plant flowers,leaves,stems,and tubers and in home- processed potatoes[J].Agricultural and Food Chemistry,2008,56:3341-3349.
[12]李勤志.中国马铃薯生产的经济分析[D].武汉:华中农业大学,2008.
[13]周林,妙颜,郭祀远 .Progress inthe application of macroporous adsorption resin[J].昆明理工大学学报,2003,6(28):99-102.
[14]刘子立,欧仕益,黄雪松,等.离子交换法从酶解液中提取阿魏酸[J].中药材,2004,27(12):910-913.
[15]王辉,田呈瑞,马守磊,等.绿原酸的研究进展[J].食品工业科技,2009,30(4):341-345.
[16]郭晓园,罗磊.金银花中绿原酸检测方法对比研究[J].食品科技,2010,35(4):251-254.
[17]马玉荣,鲜切马铃薯褐变控制技术研究[D].泰安:山东农业大学,2010.
[18]郑喜群,蒋继丰,刘晓兰,等.水提醇沉法从葵花籽中提取绿原酸[J].食品科学,2006,27(1):159-161.

