杭椒干制过程中类胡萝卜素含量的变化
井 凤,刘 峰,傅茂润,李红梅,刘 伟,王 晓,*
(1.山东省科学院山东分析测试中心,山东 济南 250014;2.山东农业大学食品科学与工程学院,山东 泰安 271018;3.山东省科学院生物研究所,山东 济南 250014)
辣椒(Capscum annuum L.)是世界上第三大蔬菜作物,辣椒色素已成为红色素的首选产品,广泛应用于制药、食品、保健品和化妆品等行业。辣椒色素是一种四萜类天然类胡萝卜色素,主要包括红色素和黄色素两部分,红色素的主要成分为辣椒红素、辣椒玉红素及其衍生物,黄色素的主要成分是β-胡萝卜素和玉米黄素等[1-3]。辣椒红素约占辣椒总色素的50%~60%,β-胡萝卜素为辣椒黄色素的主要成分。辣椒类萝卜素不仅具有VA的活性,还具有淬灭自由基、增强人体免疫力、预防心血管疾病和防癌抗癌等生理功能[4-5]。
目前对辣椒类胡萝卜素的研究主要集中于辣椒生长过程中的变化[4-5],而对辣椒采后加工过程中的变化研究相对较少。辣椒果实达到商品成熟采摘后,在干制贮藏过程中类胡萝卜素的生物合成依然进行,这一过程受光照和温度的影响,当含水量下降到一定值时类胡萝卜素的生物合成中断[6]。研究还发现[3],干制的加工方法会影响到红辣椒的色素含量。因此,温度、光照、果实含水量是影响类胡萝卜素生物合成的主要因素。
本研究以杭椒为试材,系统研究光照、温度、果实含水量等因素对辣椒总类胡萝卜素含量的影响,并测定辣椒红素和β-胡萝卜素的含量变化,探寻杭椒干制过程中辣椒总类胡萝卜素和辣椒红素、β-胡萝卜素与含水量、温度、光照之间的相关关系,找出促进辣椒色素生成最佳调控措施,为建立合理的杭椒加工工艺提供基础理论指导。
1 材料与方法
1.1 材料
杭椒采自于山东省济南市济阳蔬菜基地,选择大小均匀,无机械损伤,果实硬度和成熟度一致,处于商品成熟期深绿色的杭椒,用自来水冲洗干净。
1.2 试剂与仪器
异丙醇、甲醇、二氯甲烷、丙酮(分析纯) 天津广成化学试剂有限公司;丙酮(色谱纯) 天津市科密欧化学试剂有限公司;氢氧化钾 淄博化学试剂厂;氯化钙 济南化工分厂;辣椒红素 实验室自制;β-胡萝卜素 美国Sigma公司。
PQX-280A-3H人工气候箱 宁波莱福科技有限公司;722E型可见分光光度计 上海光谱仪器有限公司;Agilent1120高效液相色谱仪 美国安捷伦公司;R-3旋转蒸发仪 瑞士Buchi公司;Scientz-10N冷冻干燥机 宁波新芝科技股份有限公司。
1.3 方法
1.3.1 材料的处理
温度处理组:将杭椒洗净后于3个人工气候培养箱放置,分别标号1、2、3。设定每个培养箱的参数分别为:1号,温度25℃、湿度50%、光照;2号,温度30℃、湿度50%、光照;3号,温度35℃、湿度50%、光照。确保杭椒表面获得1000lx的光照度。
光照处理组:将杭椒洗净后于2个人工气候培养箱放置,分别标号A、B。设定每个培养箱的参数为:A:温度30℃,湿度50%,光照;B:温度30℃,湿度50%,避光。
取样时间为每天上午9:00,观察杭椒外观颜色并将各处理杭椒按全红、半红、微红分类,计算各类杭椒占总数比例,取样时按3类杭椒所占的比例,每个培养箱取30个,将样品去籽,去梗,放入冷冻干燥机避光冷冻干燥,粉碎,过50目筛,置-20℃冰箱中密封保存待用。
1.3.2 类胡萝卜素含量测定
叶绿素、类胡萝卜素含量的测定方法依据赵世杰等[7]的方法,准确称取杭椒粉末0.5g放入石英研钵中,加入少量石英砂,用80%的丙酮水溶液作提取剂反复研磨样品至无色,过滤,定容至50mL棕色容量瓶中,以80%丙酮水溶液为空白参比,在波长663、646、470nm处测定提取液的吸光度,实验重复3次。然后按下面的公式计算类胡萝卜素的含量。

式中:V为提取液体积/mL;m为样品质量/g。
1.3.3 水分含量的测定
参照国标GB 8858—1988《水果、蔬菜产品在减压下干燥测定干物质含量以及用共沸蒸馏法测定水分量》[8]的方法,取30个杭椒分成3组,每组10个,测定其含水量。
1.3.4 辣椒红素、β-胡萝卜素含量的测定
称取杭椒粉末2.0g,加80%的丙酮研磨,过滤,将滤液蒸干得到辣椒色素提取物。辣椒色素提取物的皂化参考井凤等[9]的方法得到辣椒色素粗品。将辣椒色素粗品用色谱丙酮定容至5mL,微孔滤膜过滤待用。样品重复处理3次。称取辣椒红素、β-胡萝卜素标准品2.5mg和1.0mg,用丙酮溶解,置10mL 棕色容量瓶中定容。其他低质量浓度标准品溶液用丙酮稀释而成。
HPLC条件:色谱YMC ODS-C30(4.6mm×250mm,5μm)。流动相A 为水,B 为丙酮,梯度洗脱条件:0~10min B(80%~80%),10~25min B(80%~90%),25~30min B(90%~100%),30~35min B(100%~ 100%);流速1.0mL/min,检测波长450nm,柱温30℃,进样量5μL。
2 结果与分析
2.1 总类胡萝卜素的含量变化
2.1.1 温度的影响
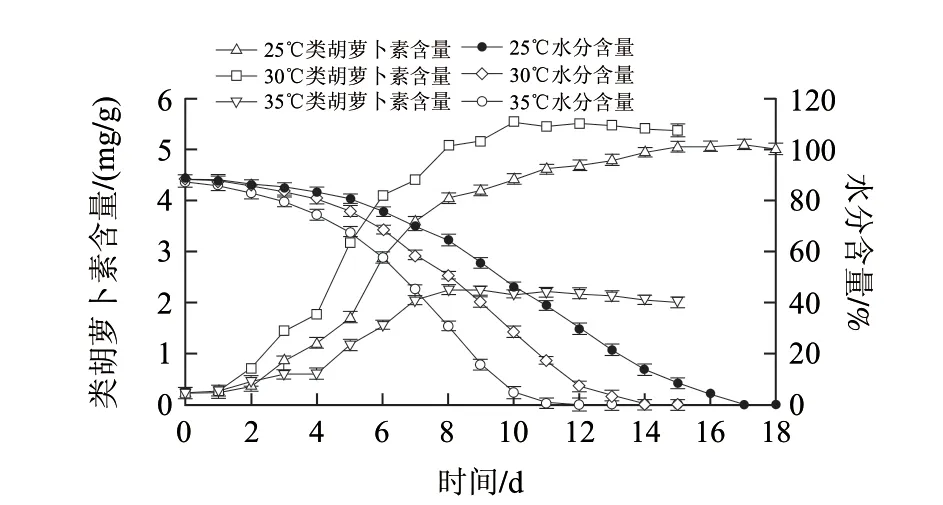
图 1 光照下不同温度处理中类胡萝卜素和水分含量的变化Fig.1 Changes of carotenoids and water content at different treatment temperatures under light
由图1可以看出,温度对杭椒中类胡萝卜素含量影响较大,25、30、35℃处理组最终总类胡萝卜素的含量分别为5.15、5.49、2.34mg/g。干制起始阶段,总类胡萝卜素呈增加的趋势,30、35℃处理中,4~8d类胡萝卜素的含量增幅最快,增幅分别为3.28、1.46mg/g,水分含量从80.8%降到50.8%,74.5%减少到45.1%;25℃处理中,5~11d类胡萝卜素的含量增幅最快,为2.94mg/g,水分含量从80.8%降到38.9%。此后,25℃处理组中类胡萝卜素含量缓慢增长,30、35℃处理组其含量分别在第10天和第8天达到最大值后稍有下降。
研究发现[10-12],温度高于30℃会抑制类胡萝卜素的合成。番茄红素的合成在辣椒类胡萝卜素的合成中处于中间位置[13],30℃以上的高温会抑制番茄果实的番茄红素合成,37℃完全抑制番茄红素的合成[14-15],从而导致其他类胡萝卜素的减少。高温通过减少mRNA的含量影响ACC氧化酶的合成[16],35℃的高温使番茄中的ACC急剧增加,乙烯含量下降,ACC氧化酶的活性降低,抑制果实成熟[17]。可见高温抑制与果实成熟有关的mRNA的积累,蛋白质的合成减少,酶的活性降低,导致类胡萝卜素含量降低。本研究发现30℃处理组类胡萝卜素的含量是35℃组的2.34倍,35℃的高温抑制了辣椒类胡萝卜素的合成。在干制后期,总类胡萝卜素的变化处于一个相对平稳的过渡状态,其含量没有大幅度的变化,但30、35℃处理组其含量稍有下降,可能受温度的影响,仍然存在着小幅的降解与转化。

表1 5组处理方程拟合的参数Table 1 Parameters of the fitted equations
Minguez-Mosquera等[6]研究表明,在35℃光照条件,杭椒干制过程中类胡萝卜素的生物合成分成两个阶段:第一阶段色素含量快速增加,第二阶段在此基础上色素缓慢减少,但最终总类胡萝卜素含量增加;当水分含量达到65%~60%时第一阶段结束,第二阶段开始进行。由图1可见,杭椒中水分含量在80%~50%之间辣椒类胡萝卜素合成速率最快,随后随着水分的逐渐降低类胡萝卜素并没有损失,而是增加的速率变缓,直到水分含量到30%时,30、35℃处理组类胡萝卜素的含量不再增加,而是缓慢的降低。25℃处理组类胡萝卜素一直在缓慢的增加,这可能是由于在第一步的过程中类胡萝卜素的生物合成不完全。
对上述3组样品分别以水分含量和时间、类胡萝卜素含量和时间的关系拟合方程,得到类胡萝卜素合成和水分含量损失的动力学方程y=(C0-C1)/[1+e(t-t1/2)/dt],式中,C0表示水分含量和类胡萝卜素的最大值,C1表示水分含量和类胡萝卜素的最小值,t1/2表示水分含量和类胡萝卜素含量达到一半时(C0/2)的时间/d,dt是一个变化的常数。不同条件下,类胡萝卜素合成和水分含量损失动力学模型的拟合度R2值均在0.98以上,拟合度较好。由表1可知,25、30、35℃光照条件下类胡萝卜素含量达到一半时(即C0/2)需要的时间(t1/2)分别为5.687、4.703、5.055d,对应的水分含量为77.5%、75.1%、66.9%。干制后其总类胡萝卜素为:5.15、5.49、2.34mg/g,与拟合结果(C0)的5.004、5.412、2.193mg/g基本一致。可见30℃光照条件下类胡萝卜素的合成最快,且类胡萝卜素含量最高。
2.1.2 光照的影响

图 2 30℃条件下光照和避光类胡萝卜素和水分的含量变化Fig.2 Changes of carotenoidsand water content under light or darknessat 30 ℃
由图2可知,光照和避光两组总类胡萝卜素的最大含量分别达到5.49mg/g和2.58mg/g,光照组的含量远远大于避光组的,这与大量研究表明光下生长植物的总类胡萝卜素含量高于遮阴生长植物的相符合[18]。类胡萝卜素在叶绿体的光合作用中起着至关重要的作用,但当叶绿体光合天线的辅助色素,帮助叶绿素接受光能;而另一方面,在高温、强光下能通过叶黄素循环,以非辐射的方式耗散光系统Ⅱ(PSⅡ)的过剩能量保护叶绿素免受破坏[19-20],因此,光对类胡萝卜素的合成有影响,适度的光照促进植物组织类胡萝卜素合成。避光处理中,类胡萝卜素增幅最快的是在4~8d,为1.38mg/g,相应的水分含量是80.2%~53.4%;9~12d类胡萝卜素的含量增加缓慢达到了2.58mg/g,增幅仅为0.20mg/g,水分含量为70.5%~31.4%;13~15d类胡萝卜素的含量一直维持在2.57mg/g左右。其拟合结果见表1,类胡萝卜素含量达到一半时需要的时间(t1/2)4.756d,对应的水分含量为77.1%。干制完成后总类胡萝卜素理论含量(C0)为2.571mg/g,与实验结果一致。光照组类胡萝卜素的含量变化和温度处理下的结果一致。由图2还可以看出,光照、避光两种处理对杭椒含水量的影响无差异,而对类胡萝卜素变化的影响较大。
2.2 辣椒红素和β-胡萝卜素的含量变化
辣椒红素约占辣椒总色素的50%~60%,β-胡萝卜素为辣椒黄色素的主要成分,因此,测定样品干制过程中辣椒红素和β-胡萝卜素的含量变化具有重要意义。皂化后杭椒样品的液相图谱和标准品的液相图谱如图3所示。

图 3 辣椒红素、β-胡萝卜素对照品(A)和杭椒样品(B)的HPLC图谱Fig.3 HPLC chromatograms of capsanthin and β- carotene reference materials (A) and chili pepper sample (B)
2.2.1 温度的影响

图 4 光照下不同温度处理中辣椒红素和β-胡萝卜素的含量变化Fig.4 Changes of capsanthin and β- carotene content at different treament temperatures under light
由图4可知,25、30、35℃处理组辣椒红素的最大含量分别为2.01、2.13、0.65mg/g。25、30℃处理组4~8d辣椒红素的含量增幅最快,分别增幅为1.30、0.675mg/g;35℃处理组4~7d辣椒红素的含量增幅最快,为0.348mg/g。此后,25℃处理组辣椒红素缓慢增加至2.01mg/g;30℃处理组到12d缓慢增加至2.13mg/g,15d辣椒红素的含量稍有降低至2.05mg/g;35℃处理组8~10d辣椒红素增长缓慢最终为0.654mg/g;至15d含量略有下降为0.593mg/g。25、30、35℃处理组辣椒红素含量变化分别和总类胡萝卜素含量的变化趋势基本相同,但温度对辣椒红素含量的影响明显。β-胡萝卜素的含量缓慢增加,25、30、35℃处理组最大含量分别达到了0.206、0.225、0.120mg/g。25、30、35℃β-胡萝卜素的含量一直在增加,35℃条件下其含量没有受到明显的抑制。有研究表明[21],β-胡萝卜素通过3种不同途径合成:一条途径是番茄红素转化成β-胡萝卜素;另一条途径是通过链孢红素→β-玉米类胡萝卜素;第3条途径是由ζ-胡萝卜素的同分异构体7’,8’,11’,12’-四氢番茄红素转化成7’,8’,11’,12’-四氢化-γ-胡萝卜素→β-玉米类胡萝卜素。高温抑制第一条途径,但还有另外两条途径可能会促进β-胡萝卜素的合成。
2.2.2 光照的影响
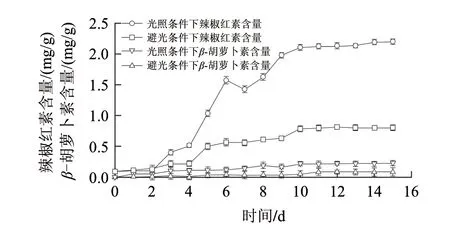
图 5 30℃条件下光照(有光、避光)条件下辣椒红素和β-胡萝卜素含量变化Fig.5 Changes of capsanthin and β- carotene content under light or darkness at 30 ℃
由图5可知,光照、避光处理中辣椒红素的最大含量分别为2.13mg/g和0.813mg/g。避光处理中,4~5d辣椒红素的含量增幅最大,为0.279mg/g;6~12d辣椒红素含量增幅缓慢,其含量是0.564~0.813mg/g;此后含量基本不变。光照处理中的辣椒红素的含量与温度处理的结果基本相同。两个处理辣椒红素的变化趋势分别与总的类胡萝卜素含量的变化趋势基本相同。β-胡萝卜素的含量呈缓慢增加趋势,光照处理最大含量为0.225mg/g,避光处理最大含量为0.0834mg/g。
3 结 论
3.1 在杭椒干制过程中温度和光照对辣椒类胡萝卜素的合成影响很大。30℃光照,水分含量在80%~50%之间最有利于其合成,总类胡萝卜素、辣椒红素和β-胡萝卜素的含量最终达到5.49、2.13、0.225mg/g。杭椒含水量在80%~50%时,类胡萝卜素合成速度最快。
3.2 干制过程中,辣椒红素和β-胡萝卜素的含量变化与总类胡萝卜素含量的变化趋势基本相同,而35℃光照条件下β-胡萝卜素的含量一直呈增加趋势,并没有出现降低的趋势。
3.3 辣椒类胡萝卜素合成速度与最终含量与干制温度、光照条件密切相关。25、30、35℃光照和30℃避光条件类胡萝卜素含量达到一半时需要的时间(t1/2)分别为5.687、4.703、5.055、4.756d,与实验结果基本一致。本实验揭示了杭椒干制过程中类胡萝卜素与含水量、温度、光照之间的相关关系,建立了相关数学模型,为杭椒加工工艺的研究提供了理论指导。
[1] MÍNGUEZ-MOSQUERA M I, PÉREZ-GÁLVEZ A, GARRIDOFERNÁNDEZ J. Carotenoid content of the varieties Jaranda and Jariza (Capsicum annuum L.) and response during the industrial slow drying and grinding steps in paprika processing[J]. Journal of Agricultural Food Chemistry, 2000, 48(7): 2972-2976.
[2] DELI J, MOLNÁR P, MATUS Z, et al. Carotenoid composition in the fruits of red paprika (Capsicum annuum var. lycopersiciforme rubrum) during ripening: biosynthesis of carotenoids in red paprika[J]. Journal of Agricultural Food Chemistry, 2001, 49(3): 1517-1523.
[3] KIM S, PARK J, HWANG I K. Composition of main carotenoids in Korean red pepper (Capsicum annuum L.) and changes of pigment stablity during the drying and storage process[J]. Journal of Food Science, 2004, 69(1): 39-44.
[4] HORNERO-MÉNDEZ D, GÓMEZ-LADRÓN de GUEVARA R, MÍNGUEZ-MOSQUERA M I. Carotenoid biosynthesis changes in fi ve red pepper (Capsicum annuum L.) cultivars during ripening cultivar selection for breeding[J]. Journal of Agricultural Food Chemistry, 2000, 48(9): 3857-3864.
[5] MÍNGUEZ-MOSQUERA M I, HORNERO-MÉNDEZ D. Formation and transformation of pigments during the fruit ripening of Capsicum annuum cv. Bola and Agridulce[J]. Journal of Agricultural Food Chemistry, 1994, 42(1): 38-44.
[6] MÍNGUEZ-MOEQUERA M I, JAREN-GALH M, GARRIDOFERNHDEZ J. Competition between the processes of biosynthesis and degradation of carotenoids during the drying of peppers[J]. Journal of Agricultural Food Chemistry, 1994, 42(3): 645-648.
[7] 赵世杰, 史国安. 董新纯. 植物生理学实验指导[M]. 北京: 中国农业科学技术出版社, 2002: 55-57.
[8] GB 8858—1988 水果蔬菜产品中干物质和水分含量的测定方法[S].
[9] 井凤, 傅茂润, 段文娟, 等. 辣椒红素对照品的制备[J]. 食品与发酵工业, 2011, 37(9): 199-202.
[10] GOODWIN T W, JAMIKORN M. Biosynthesis of carotenes in ripening tomatoes[J]. Nature, 1952, 170: 104-105.
[11] CHENG T S, FLOROS J D, SHEWFELT R L, et al. The effect of high-temperature stress on ripening of tomatoes (Lycopersicon esculentum)[J]. Journal of Plant Physiology, 1988, 13(4): 459-464.
[12] LURIE S, NUSSINOVITCH A. Compression characteristic, firmness and texture perception of heated and unheated apples[J]. Journal of Food Science & Technol, 1996, 31(1): 1-5.
[13] 檀萍, 秦松. 类胡萝卜素代谢工程研究进展[J]. 食品与发酵工业, 2008, 34(3): 120-125.
[14] CHANG Y H, RAYMUNDO L C, GLASS R W, et al. Effect of high temperature on CPTA-induced carotenoid biosynthesis in ripening tomato fruits[J]. Journal of Agricultural Food Chemistry, 1977, 25(6): 1249-1251.
[15] TOMES M L. Tempterature inhibition of carotene synthesis in tomato[J]. Botanical Gazette, 1963, 124(3): 180-185.
[16] LURIE S, HANDROS A, FALLIK E, et al. Reversible inhibition of tomato fruit gene expression at high temperature[J]. Plant Physiol, 1996, 110(4): 1207-1214.
[17] ATTA-ALY M. Effect of high temperature on ethylene biosynthesis by tomato fruit[J]. Postharvest Biology and Technology, 1992, 2(1): 19-24.
[18] LOPE M, EMILIA CANDELA M, SABATER F. Carotenoids from capsicum annuum fruits: influence of spectral quality of radiation[J]. Biologla Plantarum, 1986, 28(2): 100-104.
[19] NIYOGI K K. Photoprotection revisited: genetic and molecular approaches[J]. Annu Review of Plant Biology, 1999, 50: 391-417.
[20] GOODWIN T W, BRITTON G. Distribution and analysis of carotenoida[M]. London: Academic Press, 1988: 61-132.
[21] TRAN T L H, RAYMUNDO L C. Biosynthesis of carotenoids in bittermelon at high temperature[J]. Phytochemistry, 1999, 52(2): 275-280.

