耐异烟肼和链霉素的结核分枝杆菌临床分离株与敏感株差异蛋白表达研究
何秀云 朱传智 逄宇 黄香玉 蒋丽气 赵雁林 庄玉辉
目前,结核分枝杆菌(Mycobacterium tuberculosis Mtb)H37Rv全基因组序列已知,但许多蛋白质功能仍不清楚。Mtb耐药机制、致病机制研究还有待于揭示更多Mtb蛋白功能。虽然,目前治疗结核病依然采用利福平(RFP)、异烟肼(INH)、链霉素(S)和吡嗪酰胺(PZA)的联合化疗,但RFP、INH和S耐药现象严重。研究发现INH耐药的分子诊断标识有katG,inhA,kasA,oxyR-ahpC 间隔区突变,但仍有高达40%的耐INH菌株不能检测到上述基因突变[1]。编码核糖体S12蛋白的rpsL 基因突变(K43R,K88Q)是S耐药的主要分子标识,其次是编码16SrRNA的rrs基因突变(530茎环和915位核苷酸)[2]。但仍有约30%S耐药结核分枝杆菌未检测到rpsL或rrs基因突变,推测结核分枝杆菌S耐药还存在其他机制[3]。
宿主免疫功能和感染的Mtb毒力强弱决定了机体感染Mtb的结果。不同Mtb临床分离株和不同分枝杆菌的差异可从基因水平进行解释,已发现增强胞内生长基因(enhanced intracellular survival,eis)、增强胞内生长速率的基因(in vivo growth,ivg),增强侵入位点(mycobacterial enhanced entry locus,mel2)与 Mtb毒力有关[4-5]。但基因表达与否与所处的环境有关,单从基因水平无法解释菌株在不同培养条件下差异表达蛋白[6]。
寻找与结核分枝杆菌INH和S耐药相关的新蛋白,以进一步解析结核分枝杆菌INH和S耐药机制是以后研究工作的重点内容之一。蛋白质组学可全面了解某组织、细胞器、甚至某生物的整体蛋白,其在疾病诊断标识、疾病机制研究等方面已发挥重要作用。基于经典双向凝胶电泳的蛋白质组学存在低分辨率和低敏感度,以及无法对不溶性蛋白质、高分子量蛋白质、极酸性蛋白质和极碱性蛋白质进行分析的缺点。而定量蛋白质组学能全面定量分析差异表达蛋白,为大范围鉴定蛋白及其复合物提供了有效的途径[7]。核素标记相对和绝对定量(isobaric tags for relative and absolute quantitation,iTRAQ)技术是美国Applied Biosystems公司研发的一种新的体外多肽标记技术,该技术定量准确性高,联用液相色谱分离弥补了凝胶分离在蛋白质疏水性,相对分子质量和等电点方面的限制[10];该技术不仅可以对任何类型的蛋白质进行鉴定,并可同时对8个样品进行定量,从而缩小了不同样品不同批次间的试验误差,有较好的重复性[8]。本研究采用iTRAQ技术分析耐INH和S的Mtb临床分离株02166、INH和S敏感株01105和H37Rv的菌体蛋白,通过Mascot搜索及生物信息学对蛋白定量分析,旨在寻找与结核分枝杆菌INH和(或)S耐药相关的新蛋白。
材料和方法
一、菌株
Mtb临床分离株02166和01105由国家疾病预防控制中心国家结核病参比实验室从临床分离、鉴定(毒力、耐药性和基因型)和保存。02166菌株和01105菌株均为北京基因型、毒力高于H37Rv。02166菌株对INH和S耐药、对RFP、EMB、Km、Ofx敏感,01105菌株对上述抗结核药均敏感。02166菌株、01105菌株及H37Rv抽提菌体蛋白的菌体由国家结核病参比实验室提供。菌体经钴60照射灭活,保存于-80℃备用。
二、主要试剂和仪器
iTRAQ-8plex标试剂盒购自ABI公司;胰蛋白酶(trypsin)、三乙基碳酸氢铵(triethylammonium bicarbonate,TEAB)购自Sigma公司;Bradford定量试剂盒购自美国伯乐Bio-Rad公司;三氯乙酸(trichloroacetic acid,TCA)、羟乙基哌嗪乙硫磺酸{2-[4-(2-Hydroxyethyl)-1-piperazinyl]ethanesulfonic acid,HEPES}、3-[3-(胆酰胺丙基)二甲氨基]丙磺酸内盐{3-[(3-Cholamidopropyl)dimethylammonium]-1-propanesulfonate,CHAPS}、苯甲基磺酰氟化物(phenylmethyl sulfonylfluoride,PMSF)、二硫苏糖醇(dithiothreitol,DTT)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、乙腈、碘乙酰胺(iodoacetamide,IAM)等试剂均为进口分装试剂,磷酸二氢钾(KH2PO4)、氯化钾(KCl)、丙酮、甲酸等为国产分析纯。低温超高压连续细胞破碎机JN3000为广州聚能生物科技有限公司产品;超声波细胞粉碎仪JY92-Ⅱ为宁波新芝生物科技股份有限公司产品;半制备型高压液相色谱 (high pressure liquid chromatography,HPLC)系统为日本島津产品,Luna 5uSCX 100A色谱柱(250×4.60mm,5μm)为美国菲罗门公司(Phenomenex)产品;Nano-LC MicroTOF-QⅡ为美国Bruker公司产品;C18反相色谱柱(100×0.075mm,5μm)为美国 Agilent产品。
三、菌体蛋白iTRAQ分析
(一)菌体蛋白提取
灭活的 Mtb经1×PBS(pH 7.4)洗涤30min,4℃、8000×g离心30min,弃上清。30ml裂解液[Tris-Cl 20mmol/L,pH 8.5;1mmol/L乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA),1mmol/L PMSF充分悬浮沉淀,低温超高压连续细胞破碎机将菌细胞破碎、功率不超过1500W,1次循环后将菌液再重新进样,4次循环破菌,溶液总体积不超过50ml。4℃、20000×g离心30min,取20ml上清加入5ml 50%TCA/丙酮(100ml丙酮溶解50g TCA),冰水浴2h,4℃、20000×g离心30min。-20℃预冷丙酮洗涤沉淀3次,每次洗涤均4℃、20000×g离心30min;沉淀自然晾干,即为制备好的Mtb全菌体蛋白样品,冻存于-80℃备用。
(二)菌体蛋白复溶及定量
取部分制备好的Mtb全菌体蛋白样品沉淀于1.5ml离心管,加入复溶缓冲液(8mol/L尿素,4%CHAPS,30mmol/L HEPES,pH 调至8.0~8.3),加入PMSF至终浓度1mmol/L、EDTA至终浓度2mmol/L,混匀并冰上放置5min。加入DTT至终浓度10mmol/L,超声(超声波发射2s、间歇3s、功率240W)5min助溶,15℃、20000×g离心25min。取上清,加入DTT至终浓度10mmol/L,56℃恒温水浴1h,迅速加入IAM至终浓度55~100mmol/L,暗室室温静置1h。加入4倍于样品溶液体积的预冷丙酮,-20℃沉淀至少3h。4℃、20000×g离心20min,弃上清。300μl 50%TEAB、0.1%SDS溶液复溶沉淀,超声(超声波发射2s、间歇3s、功率240W)3min助溶。Bradford试剂盒测定蛋白质含量。
(三)蛋白质酶解
每个样品取100μg蛋白,含0.1%SDS的50%TEAB补齐体积至3个样品为相同体积。每100μg蛋白质样品加入3.3μg胰蛋白酶,37℃水浴24h;补加1μg胰蛋白酶,37℃水浴12h。酶解样品真空冷冻干燥,30μl含0.1%SDS的50%TEAB复溶肽段。取1μl复溶肽段经ZipTipⓇPipette Tips脱盐,1μl基质洗脱的蛋白样品直接上样基质辅助激光解析电离飞行时间质谱仪(matrix-assisted laser desorption/ionization time of flight mass spectrometry,MALDI-TOF-MS)检测肽质量指纹图谱以评价胰蛋白酶消化效果。
(四)标记肽段
将iTRAQ-8plex标记试剂盒中的标记试剂(113、115和121)平衡至室温,每管标记试剂中加入70μl异丙醇,颠倒混匀后加入到对应的酶解肽段样品中,113标记临床分离株01105、115标记临床分离株02166、121标记 H37Rv。混匀、稍离心后,室温静置2h。
(五)半制备型HPLC分离肽段
A 液(25%乙腈,10mmol/L KH2PO4,磷酸调pH值至3.0孔径0.22μm有机膜过滤)平衡系统,10~20min;标记的样品用A液稀释10倍,全部上样,流速1ml/min。洗脱梯度:0%~5%B液(25%乙腈,2mol/L KCl,10mmol/L KH2PO4,磷酸调pH值至3.0,孔径0.22μm 有机膜过滤),1min;5%~30%B液,20min;30%~50%B液,5min;50%B液,5min;50%~100%B液,5min;分部收集样品。收集样品用C18反相色谱柱除盐,低温抽干、0.1%甲酸复溶肽段用于Nano LC分离。
(六)Nano LC分离及质谱鉴定
HPLC分离并脱盐的0.1%甲酸复溶肽段上样。流动相 A 液:H2O,0.1%甲酸;B液:乙腈,0.1%甲酸。洗脱梯度为:0%~5%B液,0~10min;5%~45%B液,10~80min;45%~80%B液,80~85min;80%B液,85~100min;80%~5%B液,100~105min;5%B 液,105~120min。流速0.0003ml/min。Nano LC 分离的样品直接注入MicroTOF-QⅡ质谱仪,一级质谱(mass spectrometry,MS)扫描质荷比(m/z)范围为300~2000。每个一级质谱图自动选择3个最强母离子进行串级扫描,MS-MS扫描 m/z范围为200~3000,每组样品质谱鉴定3次重复。MicroTOF-QⅡ质谱仪检测参数:离子源(ESI,正离子扫描),扫描范围(Auto MS2,m/z 50~2000),Set capillary(1400V),干燥热源 (150 ℃),碰 撞池 (500.0VPP),传输时 间(150μs),前脉冲存储时间(2.0μs),校准方法(自动调谐优化电压,外标法校准质量数)。
(七)生物信息学分析
质谱扫描完毕,得到质谱信号图。质谱数据分析软件DataAnalysis 4.0(美国Bruker公司)打开质谱信号图,打开baf数据,自动分析标峰得到mgf文件。合并mgf文件。将合并后的mgf文件进行Mascot检索(SwissProt下载的Mtb数据库为搜索数据库进行本地搜索)。Mascot检索参数:酶(enzyme):胰蛋 白 酶 (trypsin);数 据 库 (database):swissprot-rat;肽段电荷 peptide charge:+,++,+++;仪器(instrument):ESI-QUAD-TOF;固定修饰(fixed modification):脲甲基化carba-midomethyl(C);可变修饰(variable modification):Gln->pyro-Glu(N-term Q),氧化反应 oxidation(M),iTRAQ-8plex(K),iTRAQ-8plex(N-term)和iTRAQ-8plex(Y);肽质量值误差范围(peptide tol):0.1u(monoisotopic);MS-MS碎片离子的质量值误差范围(MS-MS tol):0.1u;最大错配(max missed cleavages):1。筛选:P<0.05。差异表达蛋白质定量以Mascot搜库结果为基础,以mz 113和mz 121为对照组,依据Mascot的加权方式,根据一组肽段核素报告基团的相对含量的比例进行定量,02166菌株分别与01105菌株和H37Rv的直接比值显示相对定量结果,根据不同肽段鉴定次数进行统计学分析,从而判定相对定量结果的统计学意义(P<0.05)[9](DataAnalysis 4.0软件直接给出统计结果,P<0.05或P>0.05)。若蛋白质标记的报告基团信息丢失,则该蛋白无定量信息。
结 果
一、菌体蛋白鉴定及相对定量
02166菌株与01105菌株比较有153个差异表达蛋白,其中,表达上调蛋白12个(3个蛋白上调倍数>1.2);表达下调蛋白141个(104个蛋白下调倍数<0.8)。02166菌株与 H37Rv菌株比较有129个差异表达蛋白,表达上调蛋白33个(20个蛋白上调倍数>1.2);表达下调蛋白96个(67个蛋白下调倍数<0.8)。
01105菌株与H37Rv菌株比较差异表达蛋白有130个,表达上调蛋白113个(74个蛋白上调倍数>1.2);下调表达蛋白27个(11个蛋白下调倍数<0.8)。
02166菌株与01105菌株和H37Rv比较共同差异表达蛋白有86个,共同表达下调69个(其中Rv3118、Rv2626c和Rv2986c表达下调倍数<0.5),共同表达上调6个(Rv0234c和Rv2466c表达上调倍数>1.2),11个蛋白表达下调或上调不一致表1 67个蛋白在02166菌株与01105菌株比较中差异表达,却在02166菌株与H37Rv比较中无差异表达;43个蛋白在02166菌株与H37Rv比较中差异表达,却在02166菌株与01105菌株比较中无差异表达。
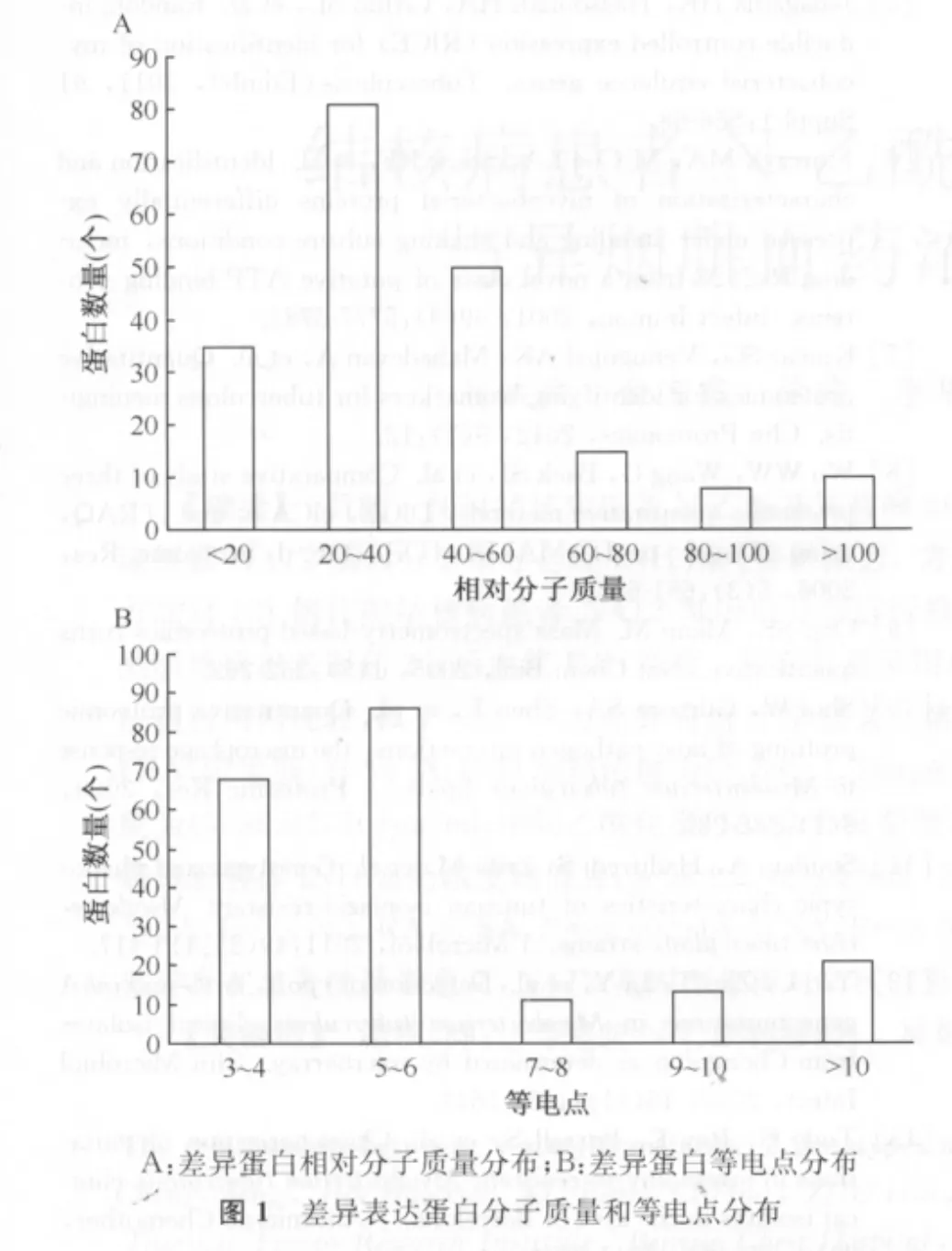
二、差异表达蛋白相对分子质量和等电点分布
02166菌株与01105菌株或H37Rv比较无冗余的差异表达蛋白共196个,其理论相对分子质量和等电点分布广泛,相对分子质量范围为7.63~326.22;等电点范围为3.74~12.48。83.4%差异表达蛋白相对分子质量小于60,77.4%差异表达蛋白等电点小于7(图1A,B)。
三、差异表达蛋白功能分析
根据巴斯德研究所功能分类树(http://genolist.pasteur.fr/tuberculist)对差异表达蛋白进行功能分类,差异表达蛋白主要参与脂类代谢(1)、中间代谢和呼吸(7)和保守假定蛋白(10);两组差异表达蛋白均无属于稳定RNAs(4)、插入序列和噬菌体(5)、PE/PPE 家 族 蛋 白 (6)、未 知 功 能 蛋 白 (8)(图2)。
四、核糖体蛋白和参与脂类代谢蛋白
9个核糖体蛋白在02166菌株与01105菌株和H37Rv比较中均下调表达,其中Rv0056、Rv0651、Rv0652、Rv0701和Rv0719为50S核糖体蛋白,Rv2785c、Rv2909c和Rv3458c为30S核糖体蛋白,Rv1630为可能的核糖体蛋白S1。Rv0641(50S核糖体蛋白)和Rv0707(30S核糖体蛋白)仅在02166菌株与01105菌株比较中下调表达,Rv2442c和Rv3456c(50S核糖体蛋白)仅在02166菌株与H37Rv比较中分别下调和上调表达。
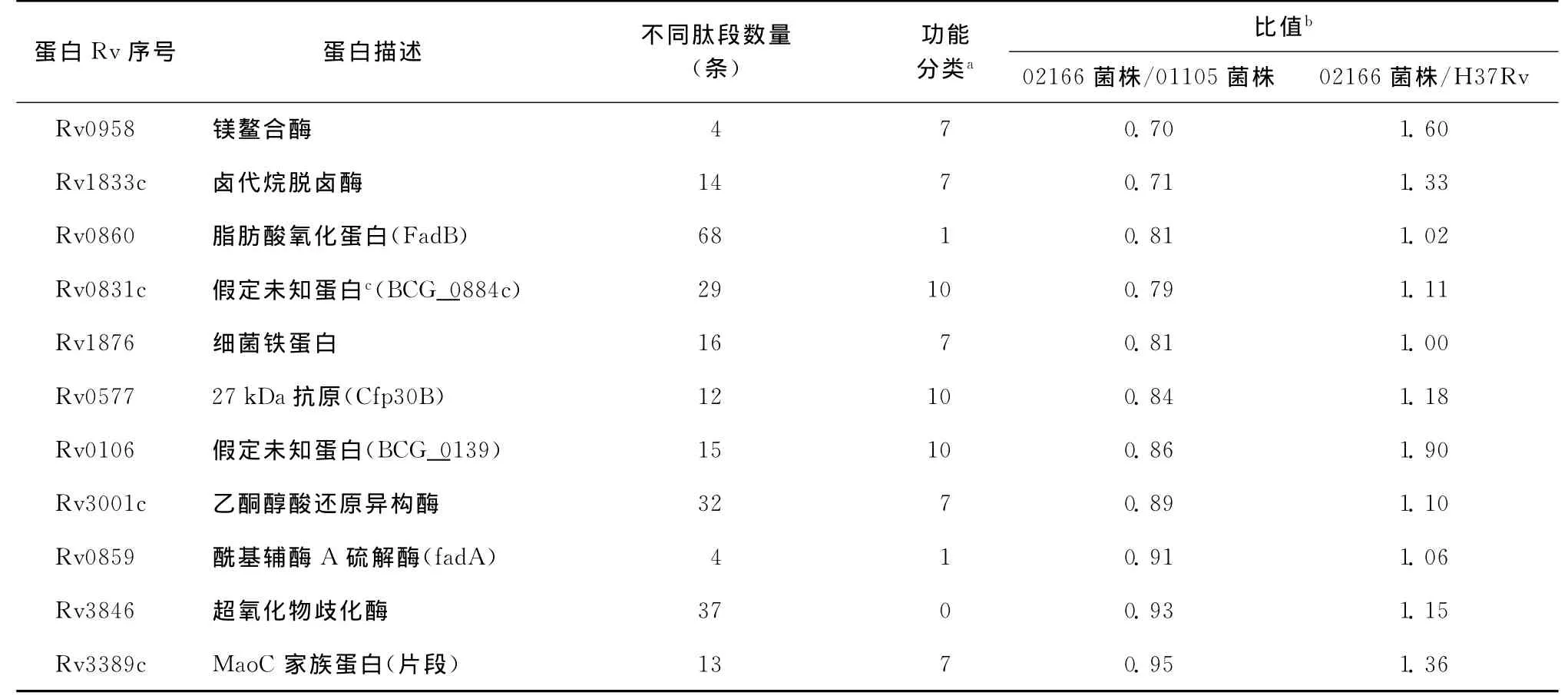
表1 02166菌株与01105菌株和H37Rv比较表达上调或下调不一致的蛋白

34个脂类代谢(1)蛋白在INH耐药菌株中差异表达:Rv3804c、Rv3140、Rv2245、Rv0824c、Rv1925、Rv3130c、Rv3801c、Rv1094、Rv2941和 Rv3800c在02166菌株与01105菌株和H37Rv比较中均下调表达;Rv0154c、Rv0222、Rv0242c、Rv0503c、Rv1070c、Rv1492、Rv2187、Rv2247、Rv2831 和 Rv3274c在02166菌株与01105菌株比较中下调表达,Rv0873和Rv1181在02166菌株与01105菌株比较中上调表达;Rv0231、Rv1074c、Rv1483、Rv2244、Rv2246、Rv2524c、Rv2940c、Rv3720和 Rv3774在02166菌株与H37Rv比较中下调表达,而Rv1543、Rv1544和Rv3061c在02166菌株与H37Rv比较中上调表达。
讨 论
研究表明iTRAQ技术可用于鉴定大分子、极酸、极碱蛋白,不仅可以弥补双向电泳不足,而且iTRAQ定量鉴定的蛋白数量多于经典双向凝胶电泳[10]。本研究采用iTRAQ技术有效地定量鉴定了耐INH和S Mtb临床分离株02166、药物敏感临床分离株01105和标准株H37Rv之间的差异蛋白,02166菌株菌体蛋白与01105菌株和H37Rv比较共同差异表达蛋白有86个,且差异表达蛋白的相对分子质量和等电点分布范围广泛。
katG (Rv1908c)、aphC (Rv2428)、kasA(Rv2245)和inhA(Rv1484)基因突变与部分耐INH的 Mtb临床分离株相关[11-12]。Rv2245和 Rv1484参与脂肪酸合成,Rv1908c和Rv2428参与解毒作用。本研究发现,Rv1908c和Rv2245在02166菌株与01105菌株和H37Rv比较中均下调表达,Rv2428只在02166菌株与H37Rv比较中下调表达,Rv1484在02166菌株与01105菌株和H37Rv比较中均未出现差异表达。药物S主要与细菌核糖体30S亚基单位结合,抑制蛋白合成。研究表明,rpsL和rrs基因突变与S耐药相关[13],rpsL编码30S核糖体蛋白S12(Rv0682)。本研究未鉴定到Rv0682,但发现9个核糖体蛋白在02166菌株与01105菌株和H37Rv比较中均下调表达,其中Rv0056、Rv0651、Rv0652、Rv0701和Rv0719为50S核糖体蛋白,Rv2785c、Rv2909c和Rv3458c为30S核糖体蛋白,Rv1630为可能的核糖体蛋白S1。生物信息学分析发现 Rv0056、Rv0652、Rv0701、Rv1630和Rv2785c在Mtb中均为药物/化合物优先作用靶点(http://tdrtargets.org/)。但这5个核糖体蛋白在02166菌株中下调表达与Mtb S耐药的关系,有待进一步试验验证。
基于双向电泳的蛋白质组学的研究鉴定到5个蛋白(Rv1446c、Rv3028c、Rv0491、Rv2971和Rv2145c)在INH耐药Mtb中上调表达[14]。S耐药株上调表达Rv0350、Rv0440、Rv1240、Rv3075c、Rv2971、Rv3028c、Rv2145c、Rv2031c和 Rv0569,进一步采用silico docking分析表明只有Rv0350、Rv0440和Rv2971与S呈现有意义的相互作用[15]。因此,Rv2971、Rv3028c和Rv2145c在S耐药株和INH耐药株中均上调表达。本研究发现Rv0440、Rv2145c和Rv3028c在02166菌株与01105菌株和H37Rv比较中均下调表达,Rv0350和Rv2971、Rv1240分别在02166菌株与01105菌株比较中上调和下调表达、Rv3075和Rv2031在02166菌株与H37Rv比较中下调表达,Rv0491、Rv0569和Rv1446c在本研究中未鉴定到。这种不同蛋白质组学方法发现不同差异表达蛋白的现象较常见[16]。
综上所述,定量蛋白质组学能有效鉴定到差异表达蛋白。Rv0234c、Rv2466c、Rv3118、Rv2626c和Rv2986c在02166菌株与01105菌株和H37Rv比较中均差异表达(下调倍数<0.5或上调倍数>1.2),9个核糖体蛋白在02166菌株与01105菌株和H37Rv比较中均下调表达。这些蛋白与INH和S耐药关系还未见报道,因此,值得进一步探讨这些蛋白与Mtb INH、S耐药的关系,为进一步研究结核分枝杆菌INH、S耐药机制提供新靶点。
[1]Espasa M,González-Martín J,Alcaide F,et al.Direct detection in clinical samples of multiple gene mutations causing resistance of Mycobacterium tuberculosis to isoniazid and rifampicin using fluorogenic probes.J Antimicrob Chemother,2005,55(6):860-865.
[2]Ulger M,Aslan G,EmekdaşG,et al.Investigation of rpsL and rrs gene region mutations in streptomycin resistant Mycobacterium tuberculosis complex isolates.Mikrobiyol Bul,2009,43(1):115-120.
[3]Nhu NT,Lan NT,Phuong NT,et al.Association of streptomycin resistance mutations with level of drug resistance and Mycobacterium tuberculosis genotypes.Int J Tuberc Lung Dis,2012,16(4):527-531.
[4]Zhang M,Gong J,Lin Y,et al.Growth of virulent and avirulent Mycobacterium tuberculosis strains in human macrophages.Infect Immun,1998,66(2):794-799.
[5]Janagama HK,Hassounah HA,Cirillo SL,et al.Random inducible controlled expression(RICE)for identification of mycobacterial virulence genes.Tuberculosis(Edinb),2011,91 Suppl 1:S66-68.
[6]Florczyk MA,McCue LA,Stack RF,et al.Identification and characterization of mycobacterial proteins differentially expressed under standing and shaking culture conditions,including Rv2623from a novel class of putative ATP-binding proteins.Infect Immun,2001,69(9):5777-5785.
[7]Kumar SG,Venugopal AK,Mahadevan A,et al.Quantitative proteomics for identifying biomarkers for tuberculous meningitis.Clin Proteomics,2012,9(1):12.
[8]Wu WW,Wang G,Baek SJ,et al.Comparative study of three proteomic quantitative methods,DIGE,cICAT,and iTRAQ,using 2Dgel-or LC-MALDI TOF/TOF.J Proteome Res,2006,5(3):651-658.
[9]Ong SE,Mann M.Mass spectrometry-based proteomics turns quantitative.Nat Chem Biol,2005,1(5):252-262.
[10]Shui W,Gilmore SA,Sheu L,et al.Quantitative proteomic profiling of host-pathogen interactions:the macrophage response to Mycobacterium tuberculosis lipids.J Proteome Res,2009,8(1):282-289.
[11]Soudani A,Hadjfredj S,Zribi M,et al.Genotypic and phenotypic characteristics of tunisian isoniazid-resistant Mycobacterium tuberculosis strains.J Microbiol,2011,49(3):413-417.
[12]Yao C,Zhu T,Li Y,et al.Detection of rpoB,katGand inhA gene mutations in Mycobacterium tuberculosis clinical isolates from Chongqing as determined by microarray.Clin Microbiol Infect,2010,16(11):1639-1643.
[13]TudóG,Rey E,Borrell S,et al.Characterization of mutations in streptomycin-resistant Mycobacterium tuberculosis clinical isolates in the area of Barcelona.J Antimicrob Chemother,2010,65(11):2341-2346.
[14]Jiang X,Zhang W,Gao F,et al.Comparison of the proteome of isoniazid-resistant and-susceptible strains of Mycobacterium tuberculosis.Microb Drug Resist,2006,12(4):231-238.
[15]Sharma P,Kumar B,Gupta Y,et al.Proteomic analysis of streptomycin resistant and sensitive clinical isolates of Mycobacterium tuberculosis.Proteome Sci,2010,8:59.
[16]Mehaffy C,Hess A,Prenni JE,et al.Descriptive proteomic analysis shows protein variability between closely related clinical isolates of Mycobacterium tuberculosis.Proteomics,2010,10(10):1966-1984.

