高酒精耐受性产酒酵母菌的选育
姚小飞,吴晓慧,叶 璐
(1.武汉生物工程学院生物工程系,湖北 武汉430415;2.华中农业大学,湖北 武汉430205;3.武汉市汉铁高级中学,湖北 武汉430010)
目前,发酵生产工业酒精的菌种主要以酵母菌为主。酒精是酵母菌厌氧发酵的重要产物,而过多的酒精对酵母菌细胞本身具有毒害作用,会影响细胞膜成分和细胞代谢。因此,酵母菌的产酒精能力与耐酒精能力是密不可分的。Thomas直接以抑制菌株生长时的酒精浓度来表达该菌株的酒精耐受性,并根据不同酒精浓度耐受性将菌株分为3个等级[1]。我国测定酵母菌耐受酒精浓度的方法基本属于此种范畴[2,3]。
作者结合酵母菌产酒精能力的检测,利用鉴别性平板技术更快速地选育优良的高酒精耐受性产酒酵母菌,具有生产实践意义。
1 实验
1.1 样品来源
采集某高粱酿酒厂的大曲酒糟作为实验样品。
1.2 培养基
PDA液体培养基:马铃薯200g、葡萄糖20g、蒸馏水1000mL,pH值自然。
YPD固体培养基:酵母膏1%、蛋白胨2%、葡萄糖2%、琼脂2%、蒸馏水,pH值自然。
TTC上层培养基[4]:葡萄糖5g,琼脂15g,TTC 0.5g,蒸馏水1000mL。
TTC下层培养基:葡萄糖10g,蛋白胨2g,酵母膏1.5g,磷酸二氢钾1.0g,硫酸镁0.4g,琼脂20g,蒸馏水1000mL,pH 值5.5~5.7。
1.3 方法
1.3.1 产酒酵母菌的分离
取适量样品置于PDA液体培养基(添加12%酒精)中,于28℃下富集培养24h。将培养液进行梯度稀释。分别取10-5、10-6、10-7稀释度的菌悬液各0.1 mL涂布于TTC下层培养基上,于28℃下恒温培养24h后,在其上覆盖一层TTC上层培养基,于28℃保温培养3h,观察显色反应。根据颜色现象选取产酒精能力强的菌株进一步划线纯培养[5]。
1.3.2 产酒酵母菌的酒精发酵能力检测
采用二氧化碳失重法[6,7]测定酵母菌的发酵产酒精能力。利用酒精计测定酵母菌发酵的酒精含量。
1.3.3 产酒酵母菌酒精耐受能力检测
向已经灭菌的YPD固体培养基中加入不同体积的无水酒精,调整体积分数分别为12%、14%、16%、18%、19%、20%,将初筛的菌株分别接种至不同酒精体积分数的平板上,标记静置10min后,于28℃下恒温培养48h。
1.3.4 酵母菌的鉴定
用美蓝对酵母菌进行染色,观察酵母菌个体形态。用测微尺测定酵母菌的大小。观察酵母菌群体在固体培养基和液体培养基中的培养特征。
分别对筛选得到的酵母菌进行氮源同化试验[8,9]、糖发酵试验、淀粉水解试验、脂肪水解试验、尿素酶试验、重氮基蓝B(DBB)试验,对酵母菌进行鉴定。
1.3.5 酵母菌的紫外诱变
参照文献[10]方法进行酵母菌生长曲线的绘制。
分别取生长期的菌液3mL加至9套平皿中,搅拌均匀,在254nm波长下,分别经紫外线照射(垂直距离30cm)10s、20s、30s、40s、80s、120s、160s、200s、240s后,取出1mL处理菌液稀释至10-2,取0.1mL涂于平板上,包扎后置于暗处28℃培养48h。以照射时间为横坐标、致死率为纵坐标绘制酵母菌的生长曲线。
采用致死率为60%~80%的条件进行诱变操作,将诱变后的菌液涂布于含20%、21%、22%酒精的YPD固体培养基平板上,于28℃下恒温培养48~72 h后观察。
2 结果与讨论
2.1 产酒酵母菌的分离
培养液涂布于TTC显色平板后,共筛选出26株具有不同产酒精能力的酵母菌。其中12株呈深红色、9株呈微红色、5株呈粉红色,分别编号后进一步划线分离。
2.2 产酒酵母菌的酒精发酵能力和酒精耐受能力检测
对初筛得到的12株呈深红色的酵母菌菌株分别进行酒精发酵实验,结果如表1所示。

表1 初筛菌株的酒精发酵能力Tab.1 The fermentation ability of the preliminarily-screened strains
由表1可以看出,S5、S9、S13、S15、S16、S17、S24等7株酵母菌的产酒精能力较强,检测这7株酵母菌的酒精耐受能力,结果见表2。

表2 7株酵母菌的酒精耐受性Tab.2 Alcohol tolerance of the seven yeast strains
由表2可知,随着酒精体积分数的增大,酵母菌的生长逐渐受到抑制。比较7株菌株,其中仅有菌株S17可以耐受19%的酒精。因此,将菌株S17作为后续实验的目标菌株。
2.3 菌株S17的鉴定
2.3.1 形态大小观察
菌株S17的个体形态见图1,菌落形态见图2。


由图1可知,S17营养细胞呈圆形或椭圆形,繁殖方式主要为芽殖,细胞大小为(2.1~3.5)μm×(7.1~13)μm。
由图2a可知,菌株S17的菌落为圆形,大小为4.0~5.5mm,边缘整齐,有明显的凸起,菌落呈乳白色,透明度较差,质地光滑较湿润。图2b为TTC显色平板上的划线分离结果。
2.3.2 生理生化试验
菌株S17的氮源同化及糖发酵试验结果分别见表3、表4,其它生化试验结果见表5。

表3 菌株S17对氮源的同化情况Tab.3 The nitrogen assimilation for strain S17

表4 菌株S17对糖类的发酵情况Tab.4The carbohydrate fermentation for strain S17

表5 菌株S17的其它生理生化指标Tab.5 The physiological and biochemical characters identification of strain S17
综合上述形态观察和生理生化试验结果,参照《酵母菌的特征与鉴定手册》,初步确定S17属于酒香酵母属(Brettanomyces)。
2.4 菌株S17的紫外诱变
2.4.1 菌株S17的生长曲线
以培养时间为横坐标、OD600值为纵坐标,绘制菌株S17的生长曲线,结果如图3所示。
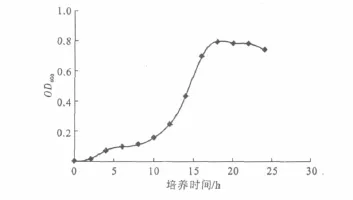
图3 菌株S17的生长曲线Fig.3 The growth curve of strain S17
由图3可知,菌株S17培养至18~20h即到达稳定期。因此,选择培养20h的酵母菌细胞作为最佳出发菌种。
2.4.2 菌株S17的致死曲线
经平板菌落计数,计算出紫外线照射不同时间的致死率,结果如图4所示。

图4 菌株S17的致死曲线Fig.4 The mortality curve of strain S17
由图4可知,随着紫外线照射时间的延长,菌株S17的致死率呈上升的趋势。照射时间为120s时,致死率就达到了82%;照射时间为160s时,致死率达到90%。因此,选择最佳紫外线照射时间为120s。
2.4.3 正突变株的筛选
将生长期酵母菌悬液经紫外线照射120s后,适当稀释涂布于含20%、21%、22%酒精的YPD固体培养基平板上进行筛选,结果在含20%酒精的平板上筛选出一株正突变株,标记为酵母菌S-T-01。
3 结论
从某高粱酿酒厂的酒糟中,通过TTC平板显色实验,共筛选到26株具有产酒精能力酵母菌。对26株酵母菌分别进行酒精发酵能力和酒精耐受能力检测,最终获得一株耐受19%酒精的酵母菌株,编号为S17。对菌株S17进行形态观察及生理生化试验,鉴定菌株S17属于酒香酵母属(Brettanomyces)。对菌株S17进行紫外诱变以提升其耐酒精的能力。结果表明,菌株S17经紫外线照射120s,筛选到一株可以耐受20%酒精的正突变株,相比原始菌株的酒精耐受力提高了1%。
[1]苏艳秋,朱卫华,吴鹏,等.耐高温、耐高酸产酒精酵母的筛选与鉴定[J].微生物学杂志,2009,29(2):43-47.
[2]李艾,郝玉翠,郝斌.耐高温高产酒精酵母的筛选及生理特性的初步研究[J].唐山学院学报,2009,22(3):74-76.
[3]寇运同,胡勇松,王忠彦,等.高产酒精酵母SP-48的基本生理特性研究[J].酿酒,2004,31(2):22-25.
[4]秦人伟,周悦.耐高酒精酵母菌株的选育[J].酿酒科技,1994,(6):22-24.
[5]秦成国.玉米粉高浓度酒精发酵的研究[J].酿酒科技,1997,(4):52-54.
[6]王滨,张国红.浓醪酒精发酵酵母菌的选育[J].天津轻工学院学报,2001,9(3):33-36.
[7]张学群,张柏青.啤酒工艺控制指标及检测手册[M].北京:中国轻工业出版社,1993:385-386.
[8]杨汝德.现代工业微生物学教程[M].北京:高等教育出版社,2010:9-13.
[9]Bamett J A.酵母菌的特征与鉴定手册[M].青岛:中国海洋大学出版社,1991:168.
[10]李用芳,李学梅.面包酵母原生质体的制备,再生及紫外线诱变的初步研究[J].生物技术,2000,10(2):23-26.

