静息细胞转化制备6-脱氧-6-氨基(N-羟乙基)-α-L-呋喃山梨糖的研究
顾亚云,陈建华
(中国药科大学分子生物学教研室,江苏南京210009)
静息细胞转化制备6-脱氧-6-氨基(N-羟乙基)-α-L-呋喃山梨糖的研究
顾亚云,陈建华
(中国药科大学分子生物学教研室,江苏南京210009)
以N-羟乙基葡萄糖胺为底物,采用氧化葡萄糖酸杆菌静息细胞转化制备6-脱氧-6-氨基(N-羟乙基)-α-L-呋喃山梨糖,考察了生物转化条件(温度、p H值、摇床转速、细胞浓度、底物浓度、金属离子、转化时间等)对转化反应的影响,并通过单因素实验和正交实验,确定摇瓶转化的最优条件如下:反应温度为25℃,p H值为6.0,摇床转速为200 r· min-1,细胞浓度为60 g·L-1,底物浓度为60 g·L-1,转化时间为48 h,在此条件下目标产物的产率为87.5%。研究还发现在转化液中添加Mg2+对转化具有促进作用。
氧化葡萄糖酸杆菌;静息细胞;生物转化
降糖药米格列醇(Ⅰ)是一种新型的α-葡萄糖苷酶抑制剂,其通过抑制小肠粘膜上皮细胞表面的α-葡萄糖苷酶来延缓碳水化合物的吸收,降低餐后高血糖,适用于餐后高血糖为主要表现的患者[1]。Grabner等[2]提出了一种简便的化学生物组合工艺合成米格列醇,合成路线如图1所示。该路线简便、无污染,关键中间体6-脱氧-6-氨基(N-羟乙基)-α-L-呋喃山梨糖(Ⅱ)的制备是该工艺的关键和难点。
作者在此用氧化葡萄糖酸杆菌静息细胞高效转化N-羟乙基葡萄糖胺(Ⅲ)制备6-脱氧-6-氨基(N-羟乙基)-α-L-呋喃山梨糖(Ⅱ),以期获得高效、低成本的米格列醇生产工艺。

图1 以N-羟乙基葡萄糖胺为底物合成米格列醇的化学生物组合法路线Fig.1 The synthetic route of miglitol with N-hydroxyethyl-glucosamine as substrate by the combined biotechnological-chemical method
1 实验
1.1 菌株、试剂与仪器
氧化葡萄糖酸杆菌(Gluconobacter oxy dans),自行保藏。
浓盐酸、甲醇、氨水、氯化钠、氢氧化钠,南京化学试剂有限公司;硫酸镁、硫酸铜,上海美兴化工股份有限公司;碘、琼脂粉、L-谷氨酸钠,国药集团化学试剂有限公司;N-羟乙基葡萄糖胺,山东新时代有限公司。
HP1100系列高效液相色谱仪(包括Agilent 1100系列泵系统、自动进样器、紫外检测器和示差折光检测器),安捷伦科技有限公司;冷冻离心机,德国希格玛离心机有限公司;台式恒温振荡培养箱,上海智城分析仪器制造公司;721型可见分光光度计,上海精密科学仪器有限公司。
1.2 培养基及溶液配制
斜面培养基:山梨醇4%,酵母粉1.25%, KH2PO40.3%,MgSO4·7 H2O 0.1%,谷氨酸钠0.1%,琼脂2%。
种子培养基:山梨醇4%,酵母粉1.25%, KH2PO40.3%,MgSO4·7H2O 0.1%,谷氨酸钠0.1%。
发酵培养基:山梨醇10%,酵母粉1.5%, KH2PO40.3%,MgSO4·7 H2O 0.1%,谷氨酸钠0.1%。
转化液配制:精确称取一定量N-羟乙基葡萄糖胺溶于水中,定容,用浓盐酸调p H值至6.0,经0.45μm微孔过滤器过滤,得到无菌转化底物溶液。
1.3 方法
1.3.1 静息细胞的制备
在无菌操作下,取一环纯化的斜面菌种接入装有50 m L种子培养基的250 m L三角摇瓶中,30℃、220 r·min-1下振荡培养24 h。将种子培养液按5%(体积分数)接种到装有100 m L发酵培养基的500 m L三角摇瓶中,30℃、220 r·min-1下振荡培养至对数生长期的末期。8000 r·min-1下离心,取菌体,蒸馏水洗涤2次得静息细胞。
1.3.2 静息细胞的转化
取适量静息细胞加入到装有20 mL转化液的250 m L三角瓶中,25℃、200 r·min-1下摇床培养一定时间。
1.3.3 HPLC检测
色谱条件:Lichrospher 5-NH2色谱柱(4.6 mm× 250 mm);柱温35℃;流动相为乙腈-水(90∶10);流速1.0 mL·min-1;进样量20μL。根据峰面积计算6-脱氧-6-氨基(N-羟乙基)-α-L-呋喃山梨糖的含量[3]。
2 结果与讨论
2.1 原始菌株静息细胞的转化条件
2.1.1 温度对转化的影响
取一定量的静息细胞,加入到20 m L/250 m L的反应体系中,分别于不同温度下反应1 h,测定反应液中的产物含量,结果见图2。
由图2可知,随着温度的升高,反应液中的产物含量先增加后减少,温度为25℃时的产物含量最大,表明此时静息细胞的催化活性最强。因此,选择最适温度为25℃。

图2 温度对转化的影响Fig.2 Effect of temperature on the conversion
2.1.2 p H值对转化的影响
取一定量静息细胞,加入到20 m L/250 m L的反应体系中,调节体系p H值,于25℃下反应1 h,测定反应液中的产物含量,结果见图3。

图3 p H值对转化的影响Fig.3 Effect of p H value on the conversion
由图3可知,反应体系的p H值为6.0时,反应液中的产物含量最大。因此,选择最适p H值为6.0。
2.1.3 摇床转速对转化的影响
取一定量的静息细胞,加入到20 m L/250 m L的反应体系中,于25℃、p H值6.0、不同摇床转速下反应1 h,测定反应液中的产物含量,结果见图4。

图4 摇床转速对转化的影响Fig.4 Effect of rotation speed on the conversion
由图4可知,随着摇床转速的加快,反应液中的溶氧水平也逐步提高,产物含量有所增加,但摇床转速超过200 r·min-1后,产物含量反而减少。因此,选择最适摇床转速为200 r·min-1。
2.1.4 细胞浓度对转化的影响
精确称取一定量浓度为20 g·L-1、40 g·L-1、60 g·L-1、80 g·L-1、100 g·L-1的静息细胞,加入到20 m L/250 m L的反应体系中,于25℃、p H值6.0、200 r·min-1下反应1 h,测定反应液中的产物含量,结果见图5。

图5 细胞浓度对转化的影响Fig.5 Effect of cell concentration on the conversion
由图5可知,细胞浓度从20 g·L-1提高至60 g ·L-1时,反应液中的产物含量也随之增加;但细胞浓度大于60 g·L-1时,产物含量反而有所减少。因此,选择最适细胞浓度为60 g·L-1。
2.1.5 底物浓度对转化的影响(图6)

图6 底物浓度对转化的影响Fig.6 Effect of substrate concentration on the conversion
由图6可知,随着底物浓度的增大,反应液中产物含量先增后减,在底物浓度为80 g·L-1时产物含量最大;进一步提高底物浓度,底物对细胞活性的抑制作用开始显现,产物含量减少。因此,选择最适底物浓度为80 g·L-1。
2.1.6 金属离子对转化的影响
金属离子主要是作为酶的激活剂或抑制剂影响转化的过程。一些金属离子对转化的影响见图7。

图7 不同金属离子对转化的影响Fig.7 Effect of various metal ions on the conversion
由图7可知,在转化液中添加Mg2+对转化具有促进作用,而Fe3+、Cu2+、Ca2+、Mn2+、Co2+在不同程度上抑制了静息细胞的活性,其中又以Fe3+的抑制作用最强。
2.1.7 正交实验优化转化条件
以转化时间、底物浓度及细胞浓度为考察因素,进行正交实验进一步优化转化条件,正交实验的结果与分析见表1。

表1 正交实验结果与分析Tab.1 Results and analysis of orthogonal experiment
由表2可知,优化的转化条件为:底物浓度60 g· L-1,静息细胞浓度60 g·L-1,转化时间48 h。
2.1.8 验证实验
采用对数生长末期(24 h)的菌体作为静息细胞,底物浓度为60 g·L-1,细胞浓度为60 g·L-1,浓盐酸调p H值至6.0,装液量为20 m L/250 m L,在25℃、200 r·min-1下转化48 h,测定产物含量。经计算,6-脱氧-6-氨基(N-羟乙基)-α-L-呋喃山梨糖的产率为87.5%,证明所确定的优化转化条件可靠。
2.2 静息细胞的重复使用性(图8)
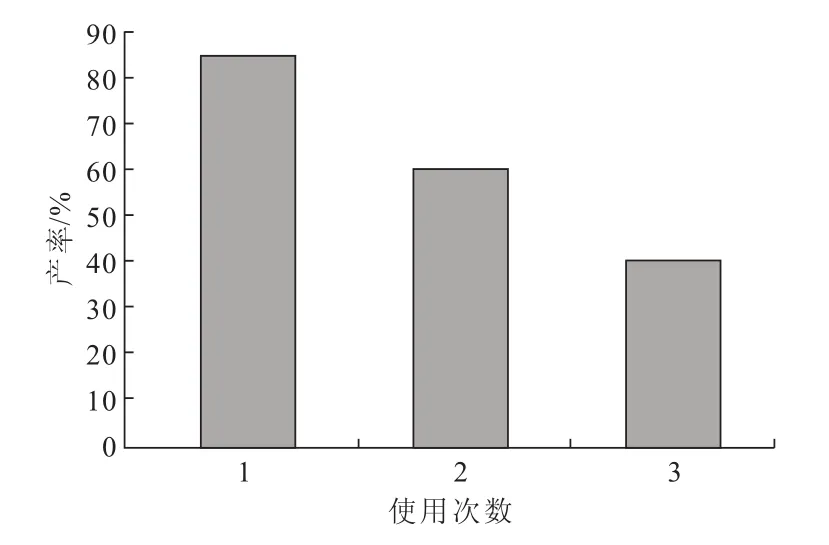
图8 静息细胞的重复使用性Fig.8 The reusability of resting cells
由图8可知,随着使用次数的增加,静息细胞的催化能力明显下降,表明细胞的稳定性较差。
2.3 讨论
氧化葡萄糖酸杆菌是一种专性好氧的革兰氏阴性菌,属于醋酸杆菌科(Acetobacteraceae),是微生物工业的理想菌种。参与微生物氧化的山梨醇脱氢酶[4]为依赖PQQ的膜结合脱氢酶,定位于内膜,主要进行不完全氧化,催化底物反应的过程中无需底物和产物的透膜运输,大大提高了其应用价值。
静息细胞转化[5]是将菌体生长与产物形成过程分开,当菌体生长到对数末期后,收获细胞,然后以细胞为催化剂,进行催化反应。该法利用对菌体生长抑制较小的碳源,解除底物和产物对细胞生长的抑制;转化过程中不涉及菌体生长,有利于产物的分离提取;转化过程操作简单。据报道[6],氧化葡萄糖酸杆菌生长进入对数生长末期时,其静息状态细胞膜脱氢酶的氧化活力最高。本研究采用对数生长末期的菌体作为静息细胞进行转化,通过对生物转化条件的优化,目标产物的产率达到87.5%,为高效合成米格列醇奠定了基础。
3 结论
以N-羟乙基葡萄糖胺为底物,采用氧化葡萄糖酸杆菌静息细胞转化制备6-脱氧-6-氨基(N-羟乙基)-α-L-呋喃山梨糖,通过单因素实验和正交实验,确定最优的转化条件如下:反应温度为25℃,摇床转速为200 r ·min-1,p H值为6.0,细胞浓度为60 g·L-1,底物浓度为60 g·L-1,转化时间为48 h,在此条件下目标产物的产率为87.5%。研究还发现在转化液中添加Mg2+对转化具有促进作用。
[1] Lesley J S,Caroline M S.Miglitol:A review of its therapeutic potential in typeⅡdiabetes Mellitus[J].Drugs,2000,59(3):521-549.
[2] Grabner R W,Landis B H,Wang P T,et al.Process for producing N-substituted-1-deoxynojirimycin[P].EP 0 477 160,1991-09-19.
[3] Chen J,Chen J H,Zhou C L.Simple-high performance liquid chromatographic methods for the quantitative determination of dihydroxyacetone and glycerol in the fermentation broth and a comparison with a visible spectrophotometric method to determine dihydroyacetone[J].Chromatographi Science,2008,46(10):912-916.
[4] Yang X P,Wei L J,Lin J P,et al.Membrane-bound pyrrolo-quinoline quinone-dependent dehydrogenase in Gluconobacter oxydans M5,responsible for production of 6-(2-hydroxyethyl)amino-6-deoxy-l-sorbose[J].Appl Environ Microbiol,2008,74(16):5250-5253.
[5] 尹秀莲,游庆红.氧化葡萄糖酸杆菌培养及转化1,2-丙二醇生产D-乳酸研究[J].中国酿造,2010,(3):64-66.
[6] Claus G W.Effect of intracytoplasmic membrance development on oxidation of sorbitol and other polyols by Gluconobacter oxydans [J].Bacteriol,1982,150(2):934-943.
Synthesis of 6-(N-Hydroxyethyl)amino-6-deoxy-α-L-sorbofuranose by Transformation with Resting Cells
GU Ya-yun,CHEN Jian-hua
(Department of Molecular Biology,China Pharmaceutical University,Nanjing 210009,China)
With N-hydroxyethyl-glucosamine as substrate,6-(N-hydroxyethyl)amino-6-deoxy-α-L-sorbofuranose was synthesized through biotransformation with resting cells of Gluconobacter oxy dans.The effects of biotransformation conditions such as temperature,p H value,rotation speed,cell concentration,substrate concentration, metal ions and transformation time on the transformation reaction were explored.Through single factor experiment and orthogonal experiment,the optimal transformation conditions were determined as follows:temperature was 25℃,p H value was 6.0,rotation speed was 200 r·min-1,cell concentration was 60 g·L-1,substrate concentration was 60 g·L-1,transformation time was 48 h.Under above conditions,yield of the target compound reached 87.5%.It was found that adding Mg2+to the transformation liquor was benefit to the biotransformation.
Gluconobacter oxydans;resting cells;biotransformation
TQ 233.1
A
1672-5425(2013)07-0047-04
10.3969/j.issn.1672-5425.2013.07.013
2013-04-15
顾亚云(1988-),女,江苏南通人,硕士研究生,研究方向:生物转化,E-mail:guyayun19881121@126.com;通讯作者:陈建华,教授,E-mail:jhchen@cpu.edu.cn。

