阴离子表面活性剂作为添加剂种子生长法制备尺寸可调的单分散金纳米棒
黄颖娟 周晓燕 李在均*,,2 顾志国 王光丽
(1 江南大学化学与材料工程学院;2 食品胶体与生物技术教育部重点实验室,无锡 214122)
0 引 言
金是一种贵金属材料,化学性质稳定。金纳米颗粒沿袭了其体相材料的性质,因此具有相对稳定却非常丰富的化学物理性质[1-2]。金纳米棒是一种尺度从几纳米到上百纳米的棒状金纳米材料。随横纵比变化,金纳米棒具有从可见到近红外连续的可调表面等离子体共振波长,极高的表面电场强度增强效应,极大的光学吸收、散射截面,以及从50%到100%连续可调的光热转换效率。因独特的光学、光电、光热、光化学、以及分子生物学性质,金纳米棒已被广泛应用于太阳能电池[3]、表面增强光谱[4]、传感[5-6]、生物成像与治疗[7]、给药[8]、超透镜[9]、纳米激光[10]、光记录[11]和等离子体尺[12]等领域,是目前材料科学界关注的研究热点方向。
金纳米棒的制备主要是电化学法[13]、模板法[14]和金种生长法[15]。电化学法是在含有丙酮、环己烷、银离子和十六烷基三甲基溴化铵(CTAB)的混合溶液中,分别以金片和铂片为阳极和阴极,进行电化学还原金离子制备金纳米棒。电化学法使用毒性的有机溶剂,限制了它的应用范围。模板法是利用多孔Al2O3膜或聚碳酸脂介孔膜为模板,通过控制电化学沉积时间得到长度可控的金纳米棒。模板法操作较为复杂,且只有单层金纳米棒生成,产量低,不能用于大量金纳米棒的制备。金种生长法是目前金纳米棒制备的主要方法。采用强还原剂先还原Au3+为Au0得到粒径为2~3 nm 的金种子液,然后用弱还原剂将Au3+还原到金种表面。通常,阳离子表面活性剂CTAB 被作为引导金种子生长的“软模板”,使金晶体定向生长得到各向异性的金纳米棒。金种生长法操作简单,绿色环保,但所制得的金纳米棒中往往含有较多的形貌杂质,如针、片及球形的金纳米颗粒,使用前需要严格的分离纯化,既耗时,又造成较大浪费。更为重要的是,传统金种子生长法制备的金纳米棒中含有高浓度的CTAB。CTAB 的生物毒性限制了产品在生物医学和光学传感器方面的应用。为制备尺寸可调的单分散金纳米棒,人们对金种生长法的反应条件进行了深度优化[16-18],并建立了许多改进的金种生长法。如,双表面活性剂法[19-20]、碘离子法[21]和芳香族的添加物法。然而,目前的金种生长法仍存在诸多问题,还不能满足生物分析等特殊领域应用对金纳米棒的要求。
我们以不同阴离子表面活性剂作为添加剂,采用种子生长法制备金纳米棒,并考察它们的形貌及光学性质。研究发现,十二烷基苯磺酸钠(SDBS)的作用优于十二烷基磺酸钠(SDS)。由于SDBS 的引入提高了CTAB 的表面活性和胶束结构的稳定性,使CTAB 浓度降至0.04 mol·L-1仍能得到高产率的金纳米棒,所制备的金纳米棒的形貌单一,粒径分布窄,光学性质稳定。与传统的金种生长法相比,方法在金纳米棒的尺寸可调、单分散性和生物毒性方面得到明显改进,所提到的金纳米棒产品可广泛应用于生物医学及分析科学领域。
1 材料与方法
1.1 主要试剂和仪器
氯金酸 (HAuCl4)、 十六烷基三甲基溴化铵(CTAB)、十二烷基苯磺酸钠(SDBS)、十二烷基磺酸钠(SDS)、抗坏血酸、硝酸银和硼氢化钠(NaBH4)均为分析纯试剂,购于上海国药集团化学试剂有限公司;实验用水均为二次蒸馏水,由普通蒸馏水再经高纯石英亚沸蒸馏器蒸馏制得。
HH-S 数显恒温水浴锅(江苏金坛医疗仪器厂);S4800 型扫描电镜(日本日立公司);Cary Esclipse 型荧光分光光度计(美国瓦里安有限公司);TU-1901 紫外可见分光光度计;DCA-315 表面张力仪 (美国Thermo Cahn 公 司);In Via 型 拉 曼 光 谱 仪 (英 国Renishaw)。
1.2 金纳米棒的制备
取0.2 mol·L-1CTAB 溶 液5 mL 入 三 口 烧 杯中,开启机械搅拌器(500 r·min-1),滴加0.5 mmol·L-1HAuCl4溶液5 mL,待溶液中搅拌均匀后快速加入新鲜配制的0.01 mol·L-1NaBH4溶液0.6 mL,当溶液由浅黄色变为棕黄色,继续搅拌2 min,取5 mL种子液用超纯水稀释8 倍,在25 ℃下静置0.5 h,备用。
25 ℃条件下,取0.2 mol·L-1CTAB 溶液2 mL置于小烧瓶中,依次加入14 mmol·L-1SDBS 溶液1 mL、0.1 mol·L-1HCl 溶液0.24 mL 和4 mmol·L-1硝酸银溶液0.12 mL,开启磁力搅拌器,加入1 mmol·L-1HAuCl4溶液2 mL,混合均匀,加入0.039 4 mol·L-1抗坏血酸0.18 mL,再加入0.32 mL 超纯水。溶液由深棕黄色变为无色后,加入0.04 mL 已制备好的金种子,搅拌2 min,待溶液混合均匀后,密封放入30 ℃水浴加热5 h 得紫红色产物。所制得产物于5~10 ℃静置一段时间,过虑除去析出的CTAB,收集滤液备用。
2 结果与讨论
2.1 阴离子表面活性剂的选择
为考察不同阴离子表面活性剂的作用,2 种最为常见的阴离子表面活性剂SDBS 和SDS 作为添加剂分别应用于种子生长制备金纳米棒。图1 是0.04 mol·L-1CTAB 下未使用添加剂(a)及添加了2.4 mmol·L-1SDS(b)或SDBS(c)制备的金纳米棒的表面等离子共振吸收光谱。图1 显示,3 种不同生长液所得到的金纳米棒的表面等离子共振吸收光谱十分相似,都具有金纳米棒表面等离子共振吸收光谱的典型特征。位于510 nm 波长处有一较弱的代表金纳米棒横向表面等离子共振吸收峰[22],位于800 nm波长处有一较强的代表金纳米棒纵向表面等离子共振吸收峰[23],这说明在3 种生长液中都可以制备长度相近的金纳米棒。然而,使用的阴离子表面活性剂种类不同所制备的金纳米棒在800 nm 处的表面共振吸收强度却相差较大,这说明添加剂的引入对金纳米棒的产率存在较大影响。在SDBS 存在下,金纳米棒在800 nm 处的吸收最强,这说明SDBS 对金纳米棒的形成具有促进作用。在SDS 存在下,金纳米棒在800 nm 处的吸收强度最小,这说明SDS的加入对金纳米棒的形成是无益的。因此,我们选择SDBS 作为添加剂制备高产率的高金纳米棒。
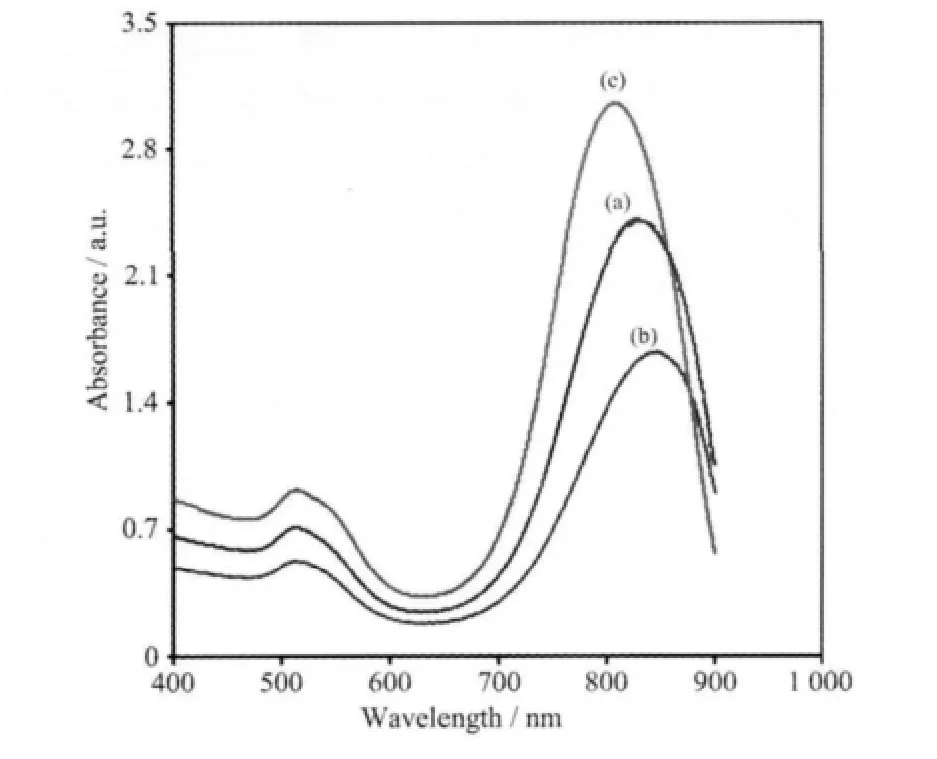
图1 金纳米棒表面等离子共振吸收光谱Fig.1 Surface plasmon resonance absorption spectra of gold nanorods
2.2 CTAB 的作用及用量影响
含有HAuCl4的生长液本身为浅黄色,加入CTAB 后溶液颜色迅速变为橙黄色(图2),这种颜色的改变应源于Au3+存在形式的变化。生长液中主要的成分是CTAB 离解产生的季铵盐阳离子(CTA+)和Br-,CTA+缺少足够的电荷密度不具有同Au3+配合的能力,唯有Br-能将HAuCl4分子中的Cl-置换而生成了HAuBr4。我们还采用KBr 替代CTAB 重复上面的实验,所得到的现象几乎完全相同,仅吸收峰位置发生了微小变化。
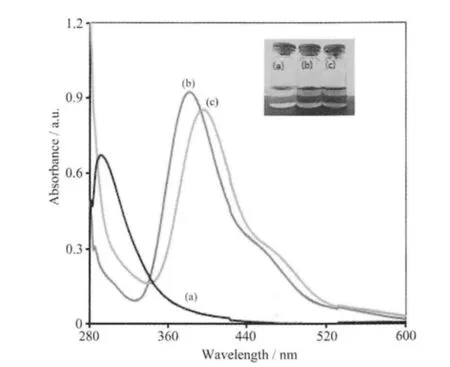
图2 HAuCl4 溶液(a)及加入CTAB (b)或KBr (c)后吸收光谱Fig.2 Absorption spectra of HAuCl4 solution before (a)and after added CTAB (b) or KBr (c)
这一事实说明CTAB 中的Br-在生长液中首先与HAuCl4反应生成HAuBr4,然后才被抗坏血酸还原成Au0。由于AuBr4-比AuCl4-更稳定,使电对(Au3+/Au)的电极电势进一步降低,Au3+还原更容易。因此,CTAB 中的Br-起到了加速Au3+→Au0转变的作用。
CTAB 的季铵盐阳离子是一种阳离子型表面活性剂,它在种子生长合成金纳米棒的过程中主要是起“软模板”作用,在金纳米棒表面形成双分子层状胶束。胶束内层的亲水头基位于金晶体表面[24],金配离子通过胶束的疏水通道由水相进入胶束内部,并还原成金原子而沉积在金晶体表面,使金晶体逐渐生长最终形成金纳米棒。研究表明,胶束的结构、性质影响金纳米棒的产率及形貌特征[25]。SDBS 是一种具有特殊分子结构的化合物,它进入到CTAB 胶束中可能会导致生长液中胶束的数量、结构及性质发生改变,从而影响到金晶体的生长。为此,我们考察了在SDBS 存在下CTAB 浓度对金纳米棒制备的影响。图3 是采用传统方法(d)及改进方法在CTAB 浓度为0.01 (b),0.02 (c)和0.04 mol·L-1(a)所制备的金纳米棒的表面等离子共振吸收光谱。从图3 可知,金纳米棒在800 nm 处吸收峰的强度随着CTAB 浓度的增加而增大。当CTAB 的浓度超过0.04 mol·L-1,吸收强度增加很少。可见,在SDBS 存在下仅需0.04 mol·L-1CTAB 就得到高产率的金纳米棒。说明SDBS 能提高CTAB 的表面活性,有利于形成稳定的胶束体系。由于CTAB 具有一定的生物毒性,低浓度CTAB 的使用可获得低生物毒性的金纳米棒产品,为金纳米棒在生物标记、医学检测等领域的广泛应用奠定了基础。因此,0.04 mol·L-1CTAB 被选择作为“软模板”用于金纳米棒的制备。

图3 不同CTAB 浓度下制备的金纳米棒的表面等离子共振吸收光谱Fig.3 Surface plasmon resonance absorption spectra of gold nanorods obtained in different concentration of CTAB
2.3 抗坏血酸和金种子用量的影响
抗坏血酸作为还原剂实现Au3+→Au+1→Au0的转变,然后Au0在金种子表面定向生长形成金纳米棒。正因为抗坏血酸和金种子的如此重要作用,它们的用量往往对金纳米棒的产率及光学性质产生较大影响。图4 是抗坏血酸浓度分别为0.95(a),1(b),1.2(c),1.3(d)和1.4 mmol·L-1(e)所制备的金纳米棒的表面等离子体共振光谱。随着抗坏血酸的浓度增加金纳米棒的横向表面等离子共振峰基本稳定在510 nm,但纵向等离子共振峰从814 nm 移动到了666 nm 左右。高浓度的抗坏血酸存在下,Au3+被迅速还原为Au0,Au0在金种子表面上的堆积速度过快,打破了因Br-在金种不同晶面上吸附能力不同所带来的金晶体生长各向异性,得到的金纳米棒横向宽而纵向短,代表金纳米棒“纵”的吸收峰蓝移且半峰宽增加,形成类似“狗骨头”状的产品。为了制备形貌单一和较大横纵比的金纳米棒,1.2 mmol·L-1的抗坏血酸溶液被选择。

图4 不同抗坏血酸浓度下制备的金纳米棒表面等离子共振吸收光谱Fig.4 Surface plasmon resonance absorption spectra of gold nanorods obtained in different concentration of ascorbic acid
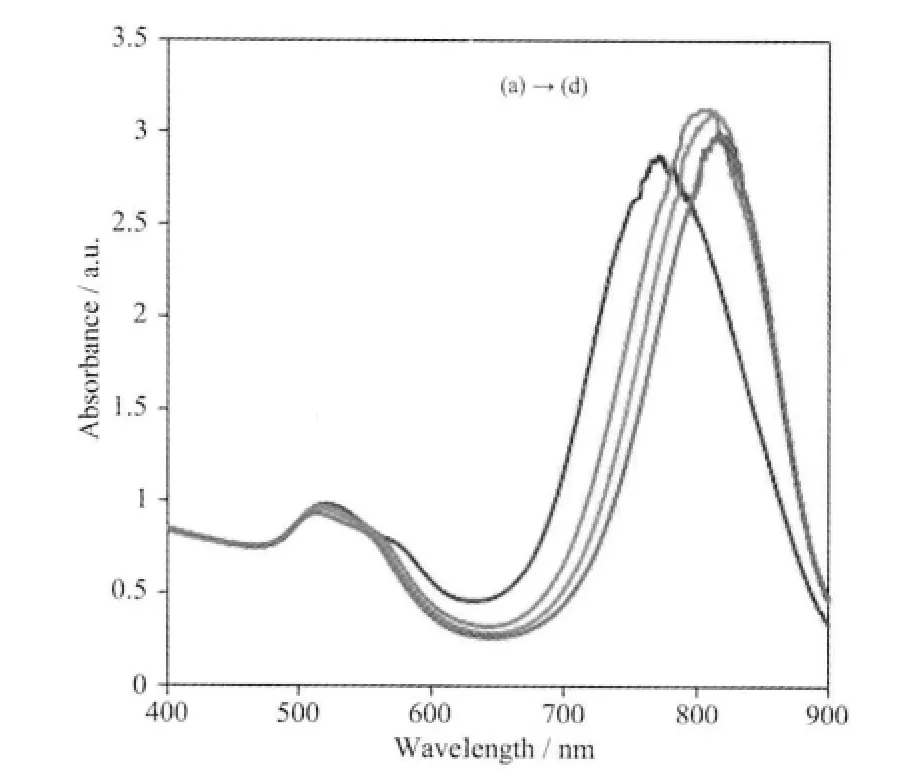
图5 金种子液用量的影响Fig.5 Effect of the amounts of gold seed
金种是金纳米棒各向异性生长的“核”。金种过少生长液中用于制备金纳米棒的“核”少,导致金纳米棒的产率低。金种过多又会产生球状颗粒,这是因为在金元素总量不变的情况下金核增加,提供给每个金核的金量减少[26]。图5 是金种子量分别为0.02 (a),0.04 (b),0.06(c)和0.08 mL(d)所制备的金纳米棒的表面等离子体共振吸收光谱。随着加入金种量的增加金纳米棒的纵向等离子共振吸收峰波长缓慢增加,但增加幅度不明显,说明在SDBS 体系下金种的量在一定浓度范围内对合成金纳米棒的横纵比影响不大,综合考虑0.04 mL 金种子液被选择。
按以上的优化条件,我们成功制备了金纳米棒,并对其光学性质及形貌进行了研究。结果显示,金纳米棒的横向表面等离子共振峰位于510 nm,纵向表面等离子共振峰位于800 nm,峰型高而窄。从金纳米棒的SEM 图(图6),相对于传统方法改进的种子合成法所得到的金纳米棒产品中不规则的金纳米颗粒很少,金纳米棒的单分散性好,金纳米棒的长为(60±0.2) nm,直径(10±0.3) nm。这与表面等离子体共振光谱得到的结果相一致。此外,我们还考察了金纳米棒溶液的表面等离子共振吸收随放置时间的变化情况。金纳米棒溶液在室温放置10 周其表面等离子共振吸收光谱几乎没有变化,说明SDBS 体系所合成的金纳米棒光学性质稳定,这有利于提高金纳米在分析中应用时检测的重现性和精密度。
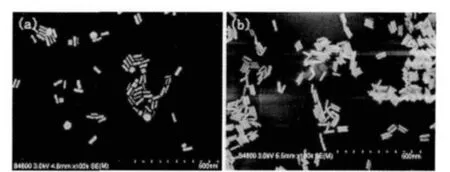
图6 传统方法(a)及改进方法(b)制备的金纳米棒SEM 图Fig.6 SEM images of gold nanorods obtained by the classical method (a) and improved method (b)
2.4 不同横纵比金纳米棒的制备
生长液中硝酸银的浓度是调控金纳米棒横纵比最为重要的手段之一。Jorge Pere-Juste 研究发现,Ag+与CTAB 形成络合物,当金种逐渐生长至临界尺寸时,棒状的晶面将变得足够大时,由于Ag+的存在使CTAB 在棒的横向部位排列更加有序,金纳米棒横向部位即{110}面的生长速度将变得非常缓慢,CTAB 优先吸附在棒的{110}面,且形成高度有序的双层结构,从而抑制了晶种在横向部位的生长[20],金纳米棒在溶液中逐步稳定为规则的棒状结构。为了研究在SDBS 存在下硝酸银浓度对金纳米棒横纵比调控的情况,我们分别采用浓度为0.04(a),0.06(b),0.07(c)和0.08 mmol·L-1(d)硝酸银生长液制备出系列金纳米棒,它们的表面等离子共振吸收光谱列于图7。从图7 可以看出,随硝酸银浓度的增加金纳米棒在510 nm 处的横向表面等离子共振吸收峰的位置及强度几乎相同,但纵向等离子共振吸收的最大波长从675 nm 增加到823 nm,同时吸收强度也明显增大。这表明,SDBS 的引入生长液后仍可采用硝酸银调控金纳米棒的横纵比。

图7 不同硝酸银浓度下所制备的金纳米棒的表面等离子共振吸收光谱Fig.7 Surface plasmon resonance absorption spectra of gold nanorods obtained in different concentration of AgNO3
2.5 反应动力学特征
为了研究反应动力学,当金种子液加入到生长液后每隔5 min 在光度计上进行一次光度扫描测试,结果见图8。从图8 可以看出,金纳米棒的表面等离子共振吸收强度随反应时间的增加开始迅速增大,最大吸收波长也迅速减小。当反应时间超过30 min 后,金纳米棒“横向”和“纵向”的表面等离子共振吸收峰都趋于最大,这表明金晶体的生长接近完成。相对于传统方法,采用SDBS 作为添加剂的改进方法反应速度明显加快,反应时间由1 h 缩短至30 min。我们认为金晶体生长速率的加快主要是溴离子浓度的减少所致。一方面,一定量的Br-吸附在金纳米棒表面,控制金纳米棒不同晶面的生长速度。由于金纳米棒{110}面的生长速度远小于{100}面的生长速度,使金纳米棒两端的生长速率比侧面更快,而更倾向于沿着两端方向生长。
另一方面,CTAB 溶液浓度增大的同时Br-离子强度增加,金纳米棒表面吸附过多Br-,限制了金纳米棒的生长速度。为进一步验证Br-的作用,我们用KBr 补足因CTAB 用量减少而减小的Br-,结果表明反应速率明显减小,其动力学特征与传统方法非常相似。

图8 不同反应时间金纳米棒表面等离子共振吸收光谱(A)及最大吸收强度和波长与反应时间的关系(B)Fig.8 Surface plasmon resonance absorption spectra at different reaction time (A) as well as relation curves of maximum absorption intensity and wavelength with the reaction time (B)
2.6 SDBS 的作用机理

图9 不同混合溶液的表面张力Fig.9 Surface tension of different mixture sultion
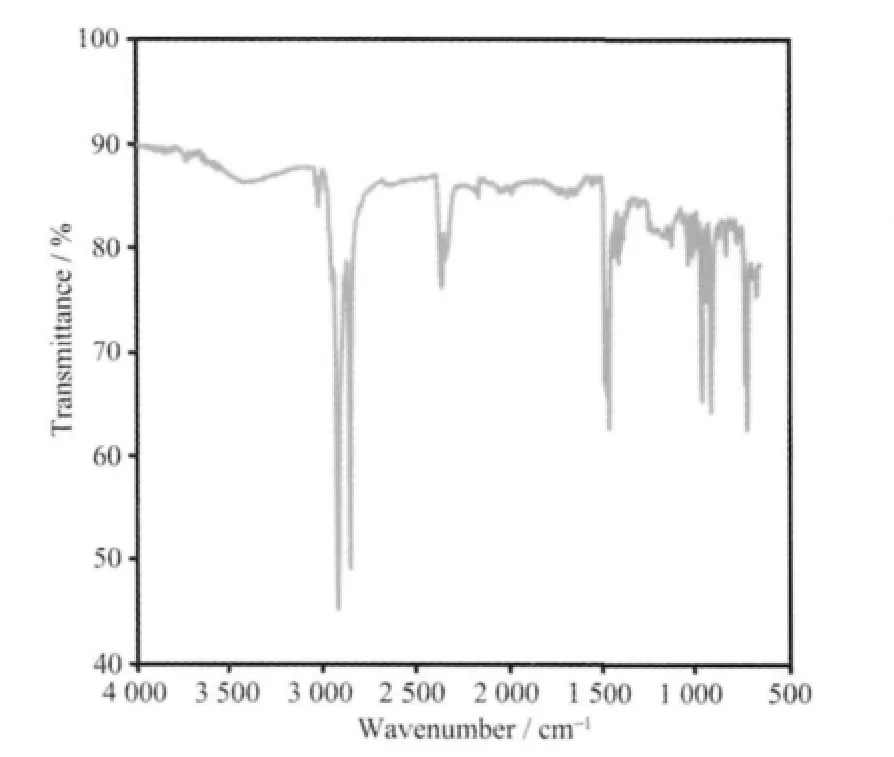
图10 金纳米棒的红外光谱Fig.10 IR spectrum of the gold Nanorods
SDBS 和SDS 有非常相似的分子结构,前者仅比后者多一个刚性结构的苯环。为了能理解SDBS和SDS 在金纳米棒制备中产生的不一样的作用,我们分别测定了CTAB 添加阴离子表面活性剂前后溶液的表面张力,结果列于图9。CTAB 本身是一种阳离子表面活性剂,具有较低的表面张力(a),在中性介质中加入带负电荷的SDBS 和SDS 阴离子。CTAB 与SDBS 或SDS 之间通过阴、 阳离子间存在的静电引力相互作用形成稳定的中性复合物,导致体系中CTAB 的有效浓度的降低,使溶液表面张力增加和表面活性下降(图9b 和c),这不利于为金种晶体表面生长提供相对稳定的胶束体系。当溶液中加入少量盐酸后,SDBS 和SDS 由阴离子迅速转变成中性分子,它们丧失了同CTAB 结合形成复合物的能力,不会使生长液中CTAB 的有效浓度降低。因此,酸性介质中SDBS 和SDS 是CTAB 体系的助表面活剂。图10 是经分离纯化除去游离CTAB 和SDBS 以后金纳米棒的红外光谱。从图10 可以看出,金纳米棒的红外光谱包含了CTAB(C-H 伸缩振动:2 918 cm-1和2 848 cm-1,N-H 面 外 弯 曲 振 动:908 cm-1和717 cm-1) 和SDBS (苯环骨架振动:1 650~1 450 cm-1, 磺酸基的特征峰: 1 068 cm-1)主要的特征红外吸收峰,说明在金棒的表面存在CTAB 和SDBS。结合表面张力及红外分析结果,SDBS 的作用机理可用图11 表示。由于SDBS 刚性的苯环结构将CTAB 的亲水头基彼此分开,大幅度地减弱了CTAB 的亲水头基间的排斥力,CTAB 疏水性长链更容易在界面上排列整齐,导致了CTAB溶液的表面张力明显下降(图9d),对形成更完美的胶束体系发挥了重要作用。不同于SDBS,SDS 分子中没有体积较大的刚性结构单元,SDS 进入到CTAB 胶束并不能将CTAB 亲水头基隔开,对削弱CTAB 亲水头基间的斥力没有任何帮助。相反,SDS分子在胶束中的无序活动还加剧了CTAB 胶束的不稳定,使体系表面活性略有下降(图9e)。

图11 SDBS 作用原理图Fig.11 Principle diagram of SDBS function
2.7 共振荧光光谱行为

图12 金纳米棒与花生过敏原DNA 反应前(a)后(b)的共振光散射光谱Fig.12 Resonance light scattering spectra of gold nanorods before (a) and after reacted with peanut allergen DNA
为了检验方法所制备的金纳米棒的实用性,我们先将专门设计的探针DNA 采用自组装方式固定于金纳米棒的表面,加入花生过敏原DNA 与之作用,然后在荧光光度计上在200 nm 至800 nm 波长范围内扫描测定溶液的同步荧光光谱变化情况。图12 是金纳米棒与花生过敏原DNA 反应前(a)后(b)的共振光散射光谱。修饰了探针的金纳米棒在200 nm至800 nm 之间有四个清晰的共振光散峰。当探针与花生过敏原杂交反应后,它的共振光散射明显增强。当花生过敏原DNA 的浓度在10-9~10-6mol·L-1,金纳米棒的共振光散射强度线性增加,方法的检出限达到6×10-10mol·L-1。此灵敏度明显优于目前所使用的GC-MS 和LC-MS 技术。
3 结 论
在种子生长制备金纳米棒的生长液中,引入阴离子表面活性剂SDBS,进一步提高CTAB 表面活性和胶束稳定性,这不仅减少了CTAB 的用量,降低了产品中CTAB 的生理毒性,加快金晶体的生长速率,而且大大改善了金纳米棒的形貌单一性、尺寸可调性和光学稳定性。改进方法制备的纳米金棒具有良好的光学性质,可广泛应用于生物医学及分析科学领域。
[1] JIANG Lu-Yun(蒋璐芸), YIN Xing(尹星), ZHAO Jian-Wei(赵 健 伟). Chinese J. Inorg. Chem.(Wuji Huaxue Xuebao),2009,1(25):176-179
[2] ZHANG Hao-Ran(张浩然), MAN Shi-Qing(满石清), XU Meng(徐 萌), et al. Chinese J. Inorg. Chem.(Wuji Huaxue Xuebao), 2010,10(26):1768-1775
[3] Atwater H A, Polman A. Nat. Mater., 2010,9:205-213
[4] Tao A, Kim F, Hess C, et al. Nano Lett., 2003,3:1299-1233
[5] Kabashin A V, Evans P, Pastkovsky S, et al. Nat. Mater.,2009,8:867-871
[6] Liu N, Tang M L, Hentschel M, et al. Nat. Mater., 2011,10:631-636
[7] Huang X H, El-Sayed I H, Qian W, et al. Chem. Soc., 2006,128:2115-2120
[8] Wijaya A, Schaffer S B, Pallares I G, et al. ACS Nano.,2009,3:80-86
[9] Fang N, Lee H, Sun C, et al. Science., 2005,308:534-537
[10]Noginov M A, Zhu G, Belgrave A M, et al. Nature.,2009,460:1110-1112
[11]Zijlstra P, Chon J W M, Gu M. Nature., 2009,459:410-413
[12]Sonnichsen C, Reinhard B M, Liphardt J, et al. Nat. Biotechnol., 2005,23:741-745
[13]Manoj K S, Arvind S A, Suresh K A. J. Nanopart. Res.,2012,14:1094-1104
[14]Julia K,Thomas H J.Phy.Chem.C.,2012,116:23671-23675
[15]Babak N, Mostafa A, El-Sayed. Chem. Mater., 2003,15:1957-1962
[16]Ken J Q, Kohei S, Rokuro N. Langmuir., 2009,25(14):7786-7790
[17]Bishnu P K, Eugene R Z. J. Am. Chem. Soc., 2008,130:12634-12635
[18]Hsiang Y W, Wan L H, Michael H H. Crystal. G. D., 2007,4(7):831-835
[19]Babak N, Mostafa A E. Chem. Master., 2003,15:1957-1962
[20]Jorge P J, Luis M, Liz M, et al. Funct. Mater., 2004,6(14):571-579
[21]Raja G R, Constantin U, Petra K, et al. Langmuir., 2010,26(7):5050-5055
[22]FAN Xin(范欣), YIN Gui(尹桂), XU Zheng(徐正). Chinese J. Inorg. Chem.(Wuji Huaxue Xuebao), 2005,6(21):822-825
[23]Ali M R K, Snyder B, El-Sayed M A. Langmuir., 2012,28:9807-9815
[24]Nikoobakht B, El-Sayed M A. Langmuir., 2001,17:6368-6374
[25]Jorge P, Luis M L, Steven C, et al. Adv. Funct. Mater.,2004,14(6):571-579
[26]Sau T K, Murphy C. J. Langmuir., 2004,20(15):6414-6420

