纳米银与纳米氧化锌混合物的抗菌活性
吕中,梁冬晖,荣凯峰,杨浩,陈嵘
(绿色化工过程教育部重点实验室(武汉工程大学),湖北 武汉430073)
0 引言
随着抗生素在过去80多年的广泛使用,多重药物耐受性菌株大量产生,抗生素的发展遇到了瓶颈,迫使人们寻找新的无耐药性的抗菌剂.近年来随着纳米技术的发展,人们发现纳米材料由于其较高的比表面积和增强的生物活性在抗菌方面显示出了明显优势[1-3].目前已报道的具有抗菌活性的无机纳米材料主要有银[2,4]、铜[5]、氧化锌[6]、二氧化钛[7]及氧化铈[8]等,其中纳米银由于抗菌活性显著、抗菌谱广、无细菌耐药性及对哺乳动物细胞毒性较低成为最有效的无机抗菌成分[9].Sondi于2004年首先报道了纳米银对大肠杆菌(E.coli)的抗菌活性,实验结果证明纳米银是一种合成简便、价格合理、适于开发的新型抗菌材料[10],从此有关纳米银的合成及抗菌活性成为研究与开发的热点[2,9,11].尽管纳米银的抗菌活性得到了广泛承认,但银是重金属,即使以纳米形式存在与人体过多接触会产生毒性[12].如何减少银的用量同时又能保持其较高的抗菌活性是开发纳米银抗菌剂所面临的重要课题.将纳米银固定在各种基质上形成纳米复合物是解决该问题的有效方法.氧化锌具有良好的热稳定性、持久性,特别是锌元素是人体所必需的微量元素,与人体相容性好,价格较低,且近年来人们发现纳米氧化锌也具有抗菌活性[13-14],使其成为良好的基质.为检验纳米银与纳米氧化锌形成复合物后是否仍保持高的抗菌活性,本研究初步将纳米银与纳米氧化锌充分混合,在降低银用量一半的条件下,测定混合物对大肠杆菌(E.coli)和金黄色葡萄球菌(S.aureus)抗菌活性,以期为进一步筛选具有较低银含量及较高抗菌活性的纳米银与纳米氧化锌复合物或负载物提供实验依据.
1 实验部分
1.1 材料与仪器 乙酰丙酮锌(Zn(acac)2)、硼氢化钠(NaBH4)购自上海晶纯,硝酸银、聚乙烯吡咯烷酮(PVP)、4-羟乙基哌嗪乙磺酸(HEPES)购自Sigma,蛋白胨、琼脂粉购自国药,酵母提取粉购自Oxoid.实验所用药品均为分析纯,实验用水为超纯水.
祥鹄XH-300A微波超声波组合合成仪,Bruker AXS D8Discover X线衍射仪(XRD),Hitachi S4800扫描电子显微镜(SEM),Philips Tecnai 20透射电子显微镜(TEM),Shimadzu UV-2550紫外分光光度计.
1.2 纳米银及纳米氧化锌的合成 采用常温还原法合成纳米银颗粒,具体制备方法如下:将0.5g PVP(mw=55 000)、7.8mL去离子水加入圆底烧瓶,搅拌至溶液澄清,加入1mL AgNO3(200mmol/L)溶液,搅拌均匀,慢慢滴加1.2mL NaBH4溶液(0.1mol/L),溶液颜色由无色变为棕黄色.
采用微波超声波组合法合成纳米氧化锌,具体制备方法如下:10mL Zn(acac)2、20mL HEPES(200mmol/L)加入圆底烧瓶.110℃、微波功率500W、超声波功率1 000W,反应前5min的超声波模式为1∶0,反应后15min的超声波模式为1∶2,反应产物用去离子水和无水乙醇洗涤,室温干燥.
1.3 纳米银及纳米氧化锌的表征 所合成样品采用XRD、UV-Vis、SEM及TEM进行表征.XRD扫描速率为0.5°/min,2θ范围为20°至80°,Cu-Kα=1.540 6;TEM 观察加速电压为200kV,SEM 在5eV条件下操作.
1.4 抗菌活性测定 实验所用大肠杆菌(E.coliCCTCC AB 90054)和金黄色葡萄球菌(S.aureusATCC 9118)由华中师范大学生命科学院惠赠,采用LB液体和固体培养基培养.采用菌落计数法测定所合成样品的抗菌活性.菌液适当稀释,加入所合成的不同浓度样品,37℃培养6h,取培养好的菌液10 μL,用均匀涂布于固体培养基上,37℃培养24h,计数各平皿中的菌落数.纳米氧化锌需置于紫外灯下照射2h.以不加样品的菌液为对照,按下式计算抑制率:

2 结果与讨论
2.1 纳米银的表征 所合成纳米银样品的紫外-可见光谱见图1.Sönnichsen等报道纳米银颗粒的最大吸收峰在420~450nm之间,当颗径较小时会发生蓝移,粒径较大时会发生红移[15-16].由图可见所合成样品的最大吸收峰位于399nm,表明所合成的纳米银粒径较小.图中虚线为样品贮存3个月后的光谱,光谱没有发生明显变化表明所制备的纳米银稳定性较高,其对纳米银作为抗菌剂使用奠定了基础.

图1 纳米银的紫外可见光谱
所合成样品的XRD及TEM图见图2.由图2A可知所合成样品与银的标准图谱JCPS no.04-0783相一致,4个衍射峰所对应的2θ值分别归属为(111)、(200)、(220)和(311)晶面.没有观察到其他衍射峰,表明所合成的样品为高纯度的银.图2B和2C为所合成样品的形貌及粒径分布图,可看出所合成的银为分散均匀的球形颗粒,大部分颗粒的粒径在3~8nm,平均粒径为5nm.所合成的纳米银粒径较小,这与样品的紫外光谱结果相一致.

图2 纳米银的XRD(A)、TEM(B)及粒径分布(C)图
2.2 纳米氧化锌的表征 图3为所合成的氧化锌样品的XRD和SEM图.由图3A可知样品图谱均可很好地与氧化锌晶体的标准衍射图JCPDS no.75-0576对应,其衍射峰分别可归属为(100),(002),(101),(102),(110),(103),(200),(112),(201)晶面.XRD图谱中无其他杂质峰出现,表明所合成样品均为高纯度的氧化锌.
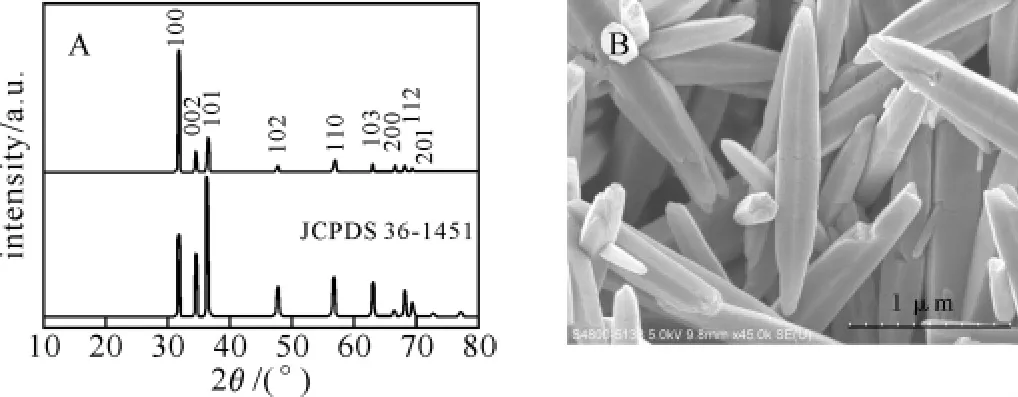
图3 纳米氧化锌的XRD(A)和SEM(B)图
采用SEM对所合成的氧化锌形貌进行观察,如图3B所示所合成样品为形貌均一的棱柱状纳米结构.
2.3 纳米银、纳米氧化锌混合物的抗菌活性 将纳米银与纳米氧化锌充分混合,使混合物中纳米银的浓度为3μg/mL、氧化锌浓度为0.5mg/mL.利用菌落计数法,取相同体积的纳米银溶液(6μg/mL)、纳米氧化锌溶液(0.5mg/mL)和混合物溶液(3μg/mL纳米银、0.5mg/mL纳米氧化锌),此时混合物中银含量为单独纳米银溶液的一半,测定其对E.coli和S.aureus的抑制作用,其结果见图4.从图可知,在样品体积相同条件下,纳米银、纳米氧化锌及二者混合物对E.coli的抑制率分别为76%、66%和87%,对S.aureus的抑制率分别为89%、79%和95%.由以上实验数据可看出,纳米银和纳米氧化锌二者混合时,虽然银的含量降低一半,但由于纳米氧化锌的加入,其抗菌活性高于单独的纳米银溶液.由此可见,将纳米银与纳米氧化锌混合,二者可能发挥了协同作用,提高了纳米银的抗菌活性.这与文献报道的将纳米银与纳米氧化锌复合可提高光催化活性[17]、纸基质中氧化锌晶丝中掺入纳米银可提高其抗菌活性[18]的结果相一致.
纳米银与纳米氧化锌混合后抗菌活性提高的可能原因如图5所示:当银颗粒与氧化锌距离足够近时,在氧化锌表面受光激发产生电子与空穴分离后,由于银表面能带较低,电子向银表面转移,从而减少氧化锌表面电子-空穴的复合机率,电子空穴的增加能使氧化锌与水反应,产生更多的·OH;在银表面,从氧化锌表面得到的电子与吸附在银表面的O2反应,产生·O2-.·O2-本身就会直接作用于细菌,同时还是所有氧自由基的前身,可以进一步转化为破坏性更强的·OH,·OH是已知的最强的氧化剂,反应性极强,它几乎可以和所有细胞成分发生反应,从而使细菌死亡[19].
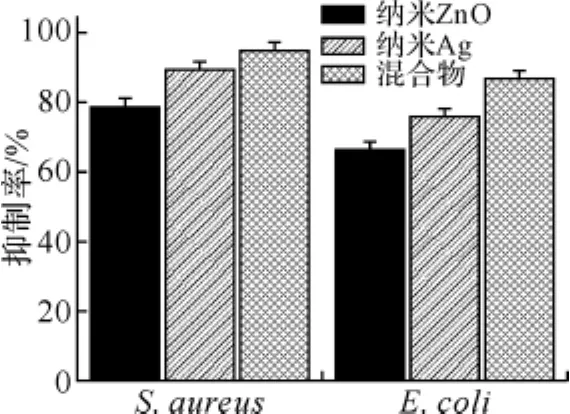
图4 纳米银、纳米氧化锌及混合物的抑菌活性

图5 纳米银与纳米氧化锌相互作用示意图
3 结论
采用常温还原法合成了5nm的银颗粒、微波超声波组合法合成了高纯度的棱柱状纳米氧化锌,将两者混合,混合物的银含量为单独纳米银的一半,而抗菌活性明显高于单独的纳米银或纳米氧化锌,表明二者发挥了协同抗菌作用,纳米银的存在使氧化锌表面产生更多的活性氧,从而提高抗菌作用.下一步工作尝试将纳米银直接负载在纳米氧化锌表面,以进一步提高抗菌活性.
[1]Fadeel B,Garcia-Bennett A E.Better safe than sorry:understanding the toxicological properties of inorganic nanoparticles manufactured for biomedical applications[J].Adv Drug Deliver Rev,2010,62(3):362-374.
[2]Rai M,Yadav A,Gade A.Silver nanoparticles as a new generation of antimicrobials[J].Biotechnol Adv,2009,27(1):76-83.
[3]马万顺,崔燕,赵玉云,等.纳米颗粒抗菌机理的研究进展[J].生物物理学报,2010,26:638-648.
[4]钟金栋,夏雪山,张若愚,等.纳米银材料抗菌效果研究及其安全性初步评价[J].昆明理工大学学报:理工版,2005,30:91-93.
[5]Yoon K Y,Hoon Byeon J,Park J H,et al.Susceptibility constants of escherichia coli and bacillus subtilis to silver and copper nanoparticles[J].Sci Total Environ,2007,373(2/3):572-575.
[6]Jones N,Ray B,Ranjit K T,et al.Antibacterial activity of ZnO nanoparticle suspensions on a broad spectrum of microorganisms[J].Fems Microbiol Lett,2008,279(1):71-76.
[7]Adams L,Lyon D,Mdntosh A,et al.Comparative toxicity of nano-scale TiO2,SiO2and ZnO water suspensions[J].Water Sci Technol,2006,54(11/12):327-334.
[8]Zeyons O,Thill A,Chauvat F,et al.Direct and indirect CeO2nanoparticles toxicity forEscherichiacoliand synechocystis[J].Nanotoxicology,2009,3(4):284-295.
[9]Chaloupka K,Malam Y,Seifalian A M.Nanosilver as a new generation of nanoproduct in biomedical applications[J].Trends Biotechnol,2010,28(11):580-588.
[10]Sondi I,Salopek-Sondi B.Silver nanoparticles as antimicrobial agent:a case study onE.colias a model for gramnegative bacteria[J].J Colloid Interface Sci,2004,275(1):177-182.
[11]Sharma V K,Yngard R A,Lin Y.Silver nanoparticles:green synthesis and their antimicrobial activities[J].Adv Colloid Interface Sci,2009,145(1-2):83-96.
[12]AshaRani P V,Low Kah M G,Hande M P,et al.Cytotoxicity and genotoxicity of silver nanoparticles in human cells[J].ACS nano,2008,3(2):279-290.
[13]He L,Liu Y,Mustapha A,et al.Antifungal activity of zinc oxide nanoparticles against botrytis cinerea and penicillium expansum[J].Microbiol.Res,2011,166(3):207-215.
[14]Liu Y,He L,Mustapha A,et al.Antibacterial activities of zinc oxide nanoparticles againstEscherichiacolio157:H7[J].J Appl Microbiol,2009,107(4):1193-1201.
[15]Sönnichsen C,Franzl T,Wilk T,et al.Plasmon resonances in large noble-metal clusters[J].New J Phys,2002,93(4):1-8.
[16]Martínez-Castañón G,Niño-Martínez N,Martínez-Gutierrez F,et al.Synthesis and antibacterial activity of silver nanoparticles with different sizes[J].J Nanopart Res,2008,10(8):1343-1348.
[17]Xie W,Li Y,Sun W,et al.Surface modification of ZnO with Ag improves its photocatalytic efficiency and photostability[J].J Photoch Photobio A,2010,216:149-155.
[18]Koga H,Kitaoka T,Wariishi H.In situ synthesis of silver nanoparticles on zinc oxide whiskers incorporated in a paper matrix for antibacterial applications[J].J Mater Chem,2009,19:2135-2140.
[19]Applerot G,Lipovsky A,Dror R,et al.Enhanced antibacterial activity of nanocrystalline ZnO due to increased ROS-mediated cell injury[J].Adv Funct Mater,2009,19(6):842-852.

