不对称希夫碱汞(II)配合物作为中性载体的碘离子电极
罗恩平, 袁 若
(1.贵阳护理职业学院,贵州 贵阳550081;2.西南大学化学化工学院,重庆市现代分析重点实验室,重庆400715)
0 引言
碘的测定在工业、临床及环境监测上具有重要意义,一般有质谱检测的气相色谱法、中子活化分析法,电感耦合等离子体原子发射质谱法、极谱法、脉冲溶出分析法、化学发光分析法和流动注射分析法等方法[1]。
近年来,离子选择性电极的研究被重新评估和设计,浓度检测限得以改进至亚纳摩尔浓度范围[2];膜组成中脂溶性离子添加剂的重要性逐渐为人们所理解[2];选择性系数的测定方法被重新评估[3]。阴离子传感与辨认仍是一个挑战,拥有对特定阴离子具有高选择性化学识别能力的活性载体仍然是反Hofmeister选择行为的阴离子选择性电极最重要的要求[4]。近年来,已有多种文献报道了碘离子的测定[5-9]。然而,这些传感器大多基于对称配合物。研究中我们发现,不对称金属配合物表现出良好的脂溶性,以此为载体的电极对阴离子呈现出良好的响应性能[10];双核金属配合物比单核金属配合物具有更好的脂溶性,相应的载体电极对阴离子具有更低的检测下限,可能成为对阴离子响应的新一类理想载体[11]。此外,汞(Ⅱ)配合物对碘离子呈现出良好的化学识别能力。为此,本文合成了不对称四配位双核金属配合物[M(II)2-BPPMDS](M=Cu(II),Hg(II)和 Co(II))(见图 1),以此为载体制备了阴离子选择性电极,研究其性能及影响因素,采用离子添加剂、交流阻抗技术和紫外可见光谱技术研究了该电极的响应机理。

图1 双核金属(Ⅱ)配合物[M(II)2-BPPMDS]的结构式
1 实验部分
1.1 仪器与试剂
MP230pH计(瑞士Mettler Toledo公司);pHS-3C型酸度计(上海大众分析仪器厂);NHC元素分析仪(西德Heraeus公司,D26450型);紫外可见分光光度计(美国PE公司,Lambda 17);IM6e型交流阻抗测试仪(德国Zahner Elektrik公司)。
载体 2,2'-双(吡咯-2-甲醛-邻苯二胺)-(4,4'-亚甲基-双水杨醛)合二汞(Ⅱ)配合物[Hg(II)2-BPPMDS]按文献[12-13]方法合成,合成产物经元素分析所证实[计算值(%):C 44.99,H 2.63,N 8.51;实测值(%):C 44.87,H 2.58,N 8.59]。铜(Ⅱ)配合物[Cu(II)2-BPPMDS]和钴(Ⅱ)配合物[Co(II)2-BPPMDS]按同样方法合成。增塑剂邻硝基苯基辛基醚(o-NPOE)按文献合成[14]。其他试剂均为市售分析纯,水为二次去离子水经KMnO4处理重蒸馏。
1.2 电极的制备及电极电位测量
以电极线性响应范围、斜率为优化目标函数,用正交试验法选择最佳电极膜组成质量百分数:载体5.9%,PVC29.3%,邻硝基苯基辛基醚 63.5%,TDMAC1.3%。按常规方法制备 PVC膜并装配电极[15]。电极电位由下列电池测定:Ag,AgCl|NaNO3(2 mol/L),pH 5.6缓冲溶液║ PVC膜 ║测试液,NaNO3(2 mol/L) │KCl(饱和),Hg2Cl2,Hg。所用缓冲溶液(pH 5.6)的柠檬酸钠和KCl浓度均为1.0 mol/L,电极使用前在0.1 mol/LKCl水溶液中浸泡1 d。
2 结果与讨论
2.1 电极的电位响应特性
在0.01 mol/L,pH=2.5 的磷酸盐缓冲介质中(2 mol/L NaNO3为离子强度调节剂)测试了各种组成的电极对I-的电位响应性能。如图2、表1所示,电极7具有最佳膜组成,在(1.0 ×10-1~3.7 ×10-7)mol/L范围内对I-呈近能斯特响应,检出限为2.1×10-7mol/L,斜率为( -58.2 ±1.1)mV/dec.,响应时间 t95%<10 s。电极对1.0×10-5mol/L的 KI溶液连续测试4 h,电位读数相对标准偏差为(1.2±0.5)mV(n=46);电极在(1.0×10-4~1.0 ×10-5)mol/L 的 KI溶液中多次交替测试,电位相对标准偏差为(1.1±0.6)mV(n=8),电极寿命2个月以上,其他两种载体对I-的响应相对较差。

图2 不同载体电极对I-的电位响应曲线(pH=2.5)
2.2 pH值对电位响应性能的影响
如图3所示,在pH=2.5时,电极响应性能最佳。此外,以稀HNO3和NaOH溶液调节0.1mmol/L KI溶液的pH值并进行电位测试(见图4),发现pH<2时,随着H+浓度的增加,I-与来自空气中O2的氧化作用增强,电位缓慢增加;当 pH=2.0~7.7时,I-与载体中心金属Hg(II)的配位受OH-参与竞争配位的影响较小,电位相对稳定;而pH>7.7时,OH-的竞争配位明显增强,干扰了配位中心对I-响应,线性范围变窄。

表1 膜组成及相应电极的电位响应特性(a括号里的值为离子添加剂与载体的摩尔比)
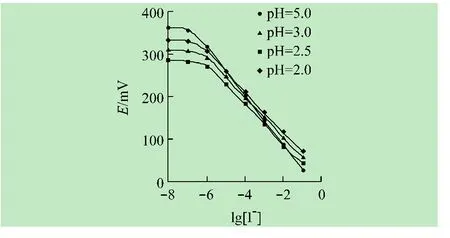
图3 不同pH值下电极7对I-的电位响应线性范围

图4 pH值对电极7电位响应性能的影响
2.3 电极的选择性
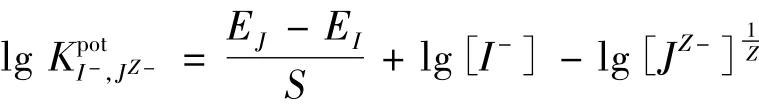
式中:EJ为干扰离子的电位;EI为主要离子I-的电位;S为斜率。
电位选择性系数采用最近被修正的分别溶液法测定,以允许Nicolskii-Eisenmen方程的正确应用。以2 mol/L NaNO3为离子强度调节剂,缓冲体系选择0.01 mol/L磷酸盐(pH=2.5),电极调整按新的程序进行,即在所有干扰离子的电位响应测量完成之前,电极膜不与主要离子I-接触。对各种阴离子电位响应值的测量按其受歧视程度递减的顺序进行,以利于相对优先响应的阴离子对膜中相对受歧视离子的完全置换[3],其结果见表2。表明所研究的电极对I-具有高的选择性,其选择性序列为:I->Sal->SCN->IO4->Cl>N>Br->N>Cl->S;其响应斜率、线性范围、响应时间、选择性等性能总体上优于对比电极的性能。
值得注意的是,Hg(II)分别与 I-、SCN-、Br-或Cl-所形成配合物的累计稳定常数(lgβ:Hg(29.8),[Hg(SCN)4]2-(20.9),Hg(20.0)和Hg15.1))与基于[Hg(II)2-BPPMDS]载体膜电极(No.7)的实验所获得的响应选择性次序是一致的。

表2 几种碘离子膜电极的分析性能
2.4 增塑剂及离子添加剂对电极性能的影响
如表1所示,增塑剂的性质与用量能改变膜相的介电常数及配体的流动性,从而影响电极的选择性、响应时间及灵敏度。相对于 DOS与 DOP,增塑剂o-NPOE的加入能获得更好地电位响应性能,其适度的极性有利于减少离子配合物与脂溶性抗衡离子之间离子对的形成,使电位响应斜率接近理论值;相对较高的流动性,为高脂溶性 I-进入膜相与载体中的金属Hg(Ⅱ)配位提供了更为适合的条件。
脂溶性离子添加剂直接加入溶剂聚合膜以改进电极对目标阴离子的选择性、响应斜率,并提供所选离子载体可能的响应机理信息,已成为阴离子选择性电极研究的普遍实践。中性载体膜要建立膜的渗透选择性并产生能斯特响应,膜中必须含有与主要离子的电荷相反的离子点位,其数量决定着可交换的带有相反电荷的离子数。此外,阳离子添加剂的加入能减少“样品对离子”的共萃,稳定膜相中待测离子的浓度并降低膜电阻,引导阴离子选择膜的选择性渗透,因此,优化离子添加剂与载体的摩尔比,对改进膜的响应性能具有重要作用。当摩尔比(TDMAC1/[Hg(II)2-BPPMDS])约为0.38时,明显改进了膜的灵敏度和选择性(电极7)。必须指出,阳离子添加剂也是离子交换剂,能诱导对阴离子的响应,尤其是高脂溶性阴离子ClO4-、SCN-、NO3-等。当TDMAC处于较高摩尔比时,液-膜界面处的离子配对作用影响增强,电极对I-的选择性降低,响应性能也降低(电极8)。此外,膜组成中的杂质使膜内存在极低浓度的离子点位,导致电极膜在未加入离子添加剂的情况下仍能观察到对I-的亚能斯特响应行为(电极1~3)。另一方面,四苯硼钠(NaTPB)的加入显著降低了电极的电位响应性能,当摩尔比(NaTPB/[Hg(II)2-BPPMDS])约为0.57时,电极已不再显示对阴离子的响应(电极9),这与中性载体的理论预期相一致[16]。
2.5 响应机理
电极活性物质对待测离子的响应行为及选择性模式,主要与载体中取代基的性质、待测离子的性质、载体结构的空间效应以及载体中心金属离子的特性等因素有关。载体分子[Hg(II)2-BPPMDS]中的Hg(II)在平面上已配位饱和,但在轴向上尚有空位,可以与I-离子发生配位形成五配位的Hg(II)配合物(见图5)。从该载体的氯仿溶液与0.01 mol/L KI溶液作用前后的紫外可见光谱(见图6)可知,载体与碘离子作用后,吸收波长发生了明显变化,吸收峰分别从242 nm及335 nm转移至262 nm及342 nm。这一变化可以证实碘离子与载体中Hg(II)发生了作用。
2.5 膜交流阻抗测试
载体[Hg(II)2-BPPMDS]电极在蒸馏水中浸泡数小时,在25℃,频率范围为106~102Hz,激励电压为25 mV条件下,以pH=2.5的0.01 mol/L磷酸盐溶液为缓冲体系,在浓度分别为 1.0 ×10-2和 1.0 ×10-4mol/L的KI溶液中对膜进行了交流阻抗测试。从图7可知,电极膜呈现良好的膜本体阻抗半圆,膜本体阻抗随溶液中I-浓度的增加而减小,其值分别为490 kΩ和880 kΩ,且在低频部分呈现Warburg阻抗直线,这表明I-参与了传输过程,在载体[Hg(II)2-BPPMDS]的作用下从水相传输进入了膜相,其传输过程受扩散控制。

图5 载体[Hg(II)2-BPPMDS]与I-作用示意图

图6 [Hg(II)2-BPPMDS]的氯仿溶液与0.1 mol/L KI溶液的紫外可见光谱图

图7 [Hg(II)2-BPPMDS]为载体的PVC膜在KI溶液中的交流阻抗谱图
2.6 电极的实际应用
取实验室废水或嘉陵江水样50 mL于100 mL烧杯中,过滤处理,以0.01 mol/LH3PO4-NaOH缓冲溶液(2 mol/L NaNO3为离子强度调节剂)调节pH值至2.5,以[Hg(II)2-BPPMDS]载体电极(No.7)作为指示电极,用标准加入法对水样中碘离子浓度进行测定(见表3),结果显示,该电极适用于实际水样中碘离子含量的快速准确测定。

表3 Hg(II)2-BPPMDS载体电极对水样中I-离子的分析结果
[1] Singh A K,Mehtab S.Polymeric membrane sensors based on Cd(Ⅱ)Schiff base complexes for selective iodide determination in environmental and medicinal samples[J].Talanta,2008,74:806-814.
[2] Malon A,Radu A,Qin W,etal.Improving the detection limitofanionselective electrodes:An iodide-selective membrane with a nanomolar detection limit[J].Anal Chem,2003,75(15):3865-3871.
[3] Bakker E.Determination of unbiased selectivity coefficients of neutral carrier-based cation-selective electrodes[J].Anal Chem,1997,69:1061-1069.
[4] Bühlmann P,Pretsch E,Bakker E.Carrier-based ion-selective electrodes and bulk optodes.2.Ionophores for potentiometric and optical sensors[J].Chem Rev,1998,98:1593-1687.
[5] Yuan R,Chai Y Q,Liu D,et al.Schiff base complexes of cobalt(II)as neutral carriers for highly selective iodide electrodes[J].Anal Chem,1993,65(19):2572-2575.
[6] Hamid R P,Mohammad H K.Copper(I)-bathocuproine complex as carrier in iodide-selective electrode[J].Talanta,2004,62:223-227.
[7] Shamsipur M,Sadeghi S,NaeimiH,etal.Iodide ion-selective PVC membrane electrode based on a recently synthesized salen-Mn(II)complex[J].Polish JChem,2000,74(2):231-238.
[8] Jeong D C,Lee H K,Jeon S,Polymeric Iodide-ion Selective Electrodes Based on Urea deri-vative as ionophore[J].Bull Korean Chem Soc,2006,27(12):1985-1988.
[9] Masoud G M,Mohammad A T,Kyoumars A,et al.Iodide selective membrane electrodes based on a molybdenum-salen as a neutral carrier[J].Materials Science and Engineering C,2011,31:1625-1631.
[10] Luo E P,Chai Y Q,Yuan R.Thiocyanate-selective electrode based on copper(II)complex of unsymmetrical tetradentate Schiff base as neutral carrier[J].Anal Lett,2007,40:369-386.
[11] Luo E P,Chai Y Q,Yuan R,et al.Highly salicylate-selective membrane electrode based on a new thiomacrocyclic Schiff base complex of binuclear copper(II) as neutral carrier[J].Desalination,2009,249:615-620.
[12] 张玉玲,阮文娟,胡国航,等.新型双核希夫碱配合物的合成及光谱性质[J].无机化学学报,2002,18(9):902-906.
[13] Akins R,Brewer G,Kokot E,et al.Copper(II)and nickel(II)complexes of unsymmetrical tetradentate Schiff base ligands[J].Inorg Chem,1985,24:127-134.
[14] Horning E C.Org Synth Collect.Vol.III[M].New York:John Wiley,1955:140-141.
[15] Moody G L,Oke R B,Thomas J D R.As calcium-sensitive electrode based on a liquid ion exchanger in a poly(vinyl chloride)matrix[J].Analyst,1970,95:910-913.
[16] Bakker E,Malinowska E,Schiller R D,Meyerhoff M E.Anionselective membrane electrodes based on metalloporphyrins:The influence of lipophilic anionic and cationic sites on potentiometric selectivity[J].Talanta,1994,41(6):881-890.

