PI3K-Akt信号通路对人大肠癌hct-8/FU耐药细胞P-GP表达和耐药性的影响
张劲远,张银旭,张俊华
(辽宁医学院附属第一医院普通外科,辽宁锦州 121001)
近年来一些细胞信号分子的抑制剂已经用于肿瘤的临床治疗,针对PI3K-Akt信号通路中多个分子抑制剂(如Wortmannin和LY294002)在体外和体内实验中都有抗肿瘤活性,并且可增加肿瘤细胞对其他靶点治疗、化疗和放疗的敏感性[1]。近年研究发现,肿瘤多药耐药(multidrug resistance,MDR)是导致肿瘤化疗失败的重要原因[2]。P-糖蛋白(P-glycoprotein,P-GP)是引起MDR的主要分子,但因其调控机制不明,至今仍无法克服其介导的耐药。研究表明,P-GP的功能受多种信号蛋白的调节[3-5],磷脂酰肌醇3-激酶-(phosphatidylinositol 3-kinase,PI3K)和其下游分子蛋白激酶B(protein kinase B,PKB或Akt)所组成的PI3K-Akt信号通路是调控细胞生存的重要信号转导通路之一。最新研究证实,激活前列腺癌细胞PI3K-Akt通路,可上调P-GP的表达[6],所以阻滞PI3K-Akt信号传导路径可能影响P-GP的活性表达,并对肿瘤细胞耐药性产生影响。我们以结肠癌耐药细胞株为模型,探讨抑制PI3K-Akt通路对结肠癌hct-8/FU P-GP蛋白表达的影响及对耐药细胞耐药性的逆转作用。
1 材料和方法
1.1 材料
人结肠癌细胞株hct-8及人结肠癌MDR细胞株hct-8/FU(南京凯基生物科技公司),5-FU(天津金耀氨基酸有限公司),PI3K抑制剂LY294002(Sigma公司),PI3K、Akt、P-Akt、P-GP 抗体(Cell Signaling 公司),鼠抗人β-actin多克隆抗体(博士德生物技术公司),蛋白质印迹法检测仪Bioshine(上海欧翔科学仪器有限公司)。
1.2 方法
1.2.1 细胞株培养及分组 在含100 ml·L-1小牛血清的 RPMI 1640 培养液中,37 ℃,50 ml·L-1CO2饱和湿度条件下连续培养。hct-8采用药物持续接触浓度递增诱导法,直到能在含5-FU浓度为40 mmol·L-1的培养基中稳定生长,并命名为hct-8/FU。实验设hct-8、hct-8/FU及hct-8/FU加药(加LY294002)组3组,培养箱中培养。
1.2.2 药物敏感性测定 将对数生长期hct-8、hct-8/FU和hct-8/FU加药组细胞接种于96孔培养板,采用MTT法连续检测7 d,绘制细胞生长曲线。
不同浓度梯度组的5-FU分别作用于hct-8和hct-8/FU细胞,每组设6个复孔,MTT法计算IC50值,用酶标仪(波长490 nm)测吸光度(A)值,计算细胞抑制率。细胞抑制率=(对照组A值-实验组A值)/对照组A值×100%。用LY294002预处理上述各实验组细胞,观察其耐药性的变化。hct-8及hct-8/FU组加入 LY294002 的终浓度为 20 μmol·L-1。
1.2.3 免疫印迹法检测 PI3K、Akt、P-Akt、P-GP 蛋白表达 于对数生长期分别收获各组细胞进行SDSPAGE 凝胶电泳、半干法转印[7],以 PI3K、P-GP、PAkt、Akt单抗(1∶400稀释)作为一抗,二抗为辣根过氧化物酶标记的羊抗兔IgG(1∶800),孵育后ECL显色(按试剂盒说明书操作)。
1.3 统计学处理
各实验重复3次,实验数据用SPSS 13.0软件包进行统计学处理,采用独立样本t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 hct-8、hct-8/FU和hct-8/FU加药组的生长曲线
细胞以贴壁方式生长,hct-8细胞的倍增时间为33.50 h,hct-8/FU细胞为48.79 h,hct-8/FU加药组为41.70 h。以生长时间为横坐标、细胞数量为纵坐标绘制细胞生长曲线如图1。
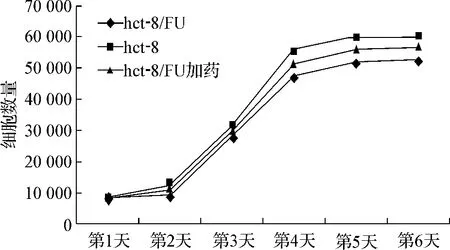
图1 3组细胞生长曲线
2.2 不同浓度5-FU下各组细胞的生长抑制率及IC50
各组细胞生长抑制率详见图2。hct-8细胞对5-FU的 IC50值为(43.2±1.4)mg·L-1;hct-8/FU 细胞IC50值为(516.00 ± 20.03)mg·L-1,耐药倍数为11.9;HCT-8/FU加药组IC50值为(58.2±4.3)mg·L-1,耐药倍数为 1.37,逆转指数为 8.86。LY294002对hct-8和hct-8/FU细胞增殖有显著抑制作用,LY294002 40 μmol·L-1联合 5-FU 作用时,各浓度组抑制率与单用5-FU相比差异均有统计学意义,可以看出,LY294002联合5-FU给药比单用5-FU对hct-8和hct-8/FU细胞生长的抑制作用要强。

图2 不同浓度5-FU下hct-8、hct-8加药、hct-8/FU和hct-8/FU加药组细胞的生长抑制率
2.3 免疫印迹法检测5-FU、LY294002对Hct-8和Hct-8/FU细胞 PI3K、Akt、P-Akt和 P-GP表达的影响
利用蛋白质印迹法半定量分析进一步验证PI3K、Akt、P-Akt和P-GP在hct-8和hct-8/FU细胞中的表达情况,结果显示:在hct-8和hct-8/FU细胞中,hct-8细胞对照组PI3K、Akt、P-Akt及P-GP蛋白相对浓度值均低于hct-8/FU细胞对照组,差异均有统计学意义(t值分别为 26.005和 23.477,均 P<0.05),加用LY294002 后 PI3K、Akt、P-Akt及 P-GP 表达均低于未加药组。该结果提示,抑制PI3K-Akt通路后可能影响下游蛋白P-GP表达进而与hct-8、hct-8/FU细胞间的耐药性差异有关,见图3。

图3 蛋白质印迹法检测hct-8、hct-8/FU、hct-8/FU加药组3组细胞 P-Akt、PI3K、Akt、P-GP 的表达
3 讨 论
PI3K-Akt信号通路在肿瘤的发生、发展、治疗及转归中发挥重要作用。近年研究显示,PI3K-Akt通路抑制剂Wortmannin能促进胃癌细胞BGC-823凋亡,增强抗肿瘤化疗药物足叶乙甙和多柔比星的疗效,提示PI3K-Akt通路失活与胃癌化疗敏感性有关[7];同时研究[8-9]表明,PI3K-Akt信号途径还与肿瘤MDR密切关联,PI3K-Akt的激活可以导致进展期前列腺癌细胞MDR蛋白1(MRP1)的表达和继发MDR的发生;在耐药的结肠腺癌细胞HT29RDB中,PI3K-Akt信号途径的阻滞剂LY294002与阿霉素联合使用能够在MRP1介导的耐药机制中发挥治疗作用,可使细胞内阿霉素药物浓度增加3倍以上。
PI3K-Akt通路已经成为肿瘤治疗的新靶点,P-GP在肿瘤治疗过程中对肿瘤细胞耐药性的产生发挥重要作用,肿瘤细胞中P-GP利用ATP水解释放的能量降低细胞内药物的浓度,从而产生耐药性。关于结肠癌细胞P-GP的表达调控是否依赖于PI3K信号通路的研究目前报道很少,进一步弄清这一信号通路不仅对更清楚地阐明大肠癌化疗耐药的分子机制具有重要的理论意义,而且对防治结肠癌的耐药性产生和提高耐药病人化疗效果具有重要的实用价值。结肠癌细胞的耐药机制目前还不完全清楚,研究表明,Akt能够通过磷酸化其下游的多种作用底物促进肿瘤细胞的生长、增殖,抑制细胞凋亡,提高细胞的缺氧耐受,促进血管生成,肿瘤细胞侵袭、转移以及对化疗和放疗的抵抗[10]。Zhang 等[11]发现下调 Akt表达可抗肿瘤治疗。
本研究显示,hct-8/FU 细胞中 PI3K、Akt、P-Akt、P-GP蛋白表达水平高于hct-8细胞,应用LY294002抑制PI3K-Akt蛋白表达可增强hct-8细胞对5-FU的药物敏感性,特别是在hct-8/FU细胞,应用LY294002抑制PI3K-Akt蛋白表达后细胞对5-FU药物敏感性接近其亲本(hct-8细胞)水平,提示PI3K-Akt信号通路异常与结肠癌对5-FU耐药有关,抑制PI3K-Akt信号通路能逆转结肠癌对5-FU耐药表型。此外,我们应用LY294002抑制PI3K-Akt信号通路后,蛋白质印迹法检测hct-8和hct-8/FU细胞中耐药蛋白P-GP表达降低,提示LY294002可能通过抑制PI3K-Akt通路激活进而抑制下游蛋白分子P-GP表达从而逆转结肠癌细胞耐药。
[1]石松长,黄昌明.PI3K[MSl]/Akt信号通路与消化道肿瘤的研究进展[J].医学综述,2007,13(14):1070-1072.
[2]MARCHETTI S,MAZZANTI R,BEIJNEN J H,et al.Concise review:clinical relevance of drug-drug and herb-drug interactions mediated by the ABC transporter ABCB1(MDR1,P-glycoprotein)[J].Oncologist,2007,12(8):927-941.
[3]FUJITA T,WASHIO K,TAKABATAKE D,et al.Proteasome inhibitors canalter the signaling pathways and attenuate the P-glycoprotein-mediated multidrug resistance[J].Int J Cancer,2005,117(4):670-682.
[4]SHINODA C,MARUYAMA M,FUJISHITA T,et al.Doxorubicininduces expression of multidrug resistance-associated protein 1 inhuman small cell lung cancer cell lines by the c-jun N-terminal kinase pathway[J].Int J Cancer,2005,117(1):21-31.
[5]石小燕,蔡晓军,类建翔,等.PI3K/Akt抑制剂LY294002对卵巢癌细胞A2780/Taxol多药耐药性的逆转作用[J].癌症,2008,27(4):343-347.
[6]CHOI B H,KIM C G,LIM Y,et al.Curcumin down-regulates the multidrug-resistance mdr1b gene by inhibiting the PI3K/Akt/NF kappa B pathway[J].Cancer Lett,2008,259(1):111-118.
[7]LI H,YU J P,CAO J,et al.Effect of PI3K/Akt inhibitor on the expression of caspase-9 in human gastric cancer cells[J].Med J Wuhan Univ,2008,29(1):38-40.
[8]LEE J T,STEELMAN L S,MCCUBREY J A.Phosphatidylinositol 3'-kinase activation leads to multidrug resistance protein-1 expression and subsequent chemo-resistance in advanced prostate cancer cells[J].Cancer Res,2004,64(22):8397-8404.
[9]ABDUL-GHANI R,SERRA V,GYORFFY B,et al.The PI3K inhibitor LY294002 blocks drug export from resistant colon carcinoma cells overexpressing MRP1[J].Oncogene,2006,25(12):1743-1752.
[10]PAGE C,LIN H J,JIN Y,et al.Overexpression of Akt/Akt can modulate chemotherapy-induced apoptosis[J].Anticancer Res,2000,20(1A):407-416.
[11]ZHANG H Y,ZHANG P N,SUN H.Aberration of the PI3K/AKT/mTOR signaling in epithelial ovarian cancer and its implication in cisplatin-based chemotherapy[J].Eur J Obstet Gynecol Reprod Biol,2009,146(1):81-86.

