肠道病毒71型和柯萨奇病毒A16型分离株的VP1基因特征分析
张建华,江炳福,程险峰,游贤惠,孟继鸿
(1.东南大学 医学院,江苏 南京 210009;2.绍兴文理学院 医学院,浙江 绍兴 312000;3.南京市儿童医院,江苏 南京 210008)
手足口病(hand foot and mouth disease,HFMD)是一种以发热和手、足、口腔等部位的皮疹、疱疹或疱疹性咽峡炎为主要特征的小儿急性传染病。多种肠道病毒可引起HFMD,其中以肠道病毒71型(enterovirus 71,EV71)和柯萨奇病毒A组16型(Coxsackie A16,CA16)最多见[1]。通常情况下,EV71感染引起的神经系统并发症较CA16等多见,故备受人们的关注[2]。近年来,在东南亚地区HFMD流行有上升趋势[3-6]。在我国,HFMD自1981年在上海出现以来,相继在北京、天津、福建等地均有报道[7]。2008年3月,我国安徽省阜阳市发生了较大规模的HFMD疫情,引起了社会的广泛关注[8]。目前,HFMD尚无疫苗和特异性抗病毒药物,故加强EV71和CA16的分子流行病学监测,及时了解掌握病毒变异状况和进化动态,对于控制HFMD流行、疫苗候选株的挑选等具有十分重要的意义。
本研究小组2009至2010年从南京市和马鞍山市HFMD患儿临床标本中分离出多株EV71和CA16病毒,通过扩增和测定VP1基因序列,并与标准毒株及国内外常见的参考毒株进行比较分析,研究其遗传学背景和种系进化关系,为EV71-CA16联合疫苗研发提供科学依据。
1 材料与方法
1.1 标本采集与病毒分离
临床诊断为手足口病的患儿咽拭子和(或)肛拭子标本由南京市儿童医院和马鞍山市疾病预防与控制中心提供,-80℃保存备用。按照《手足口病预防控制指南(2009版)》关于样品采集及检测技术方案进行预处理,接种单层非洲绿猴肾细胞(Vero),置于36℃、体积分数5%的CO2培养箱连续培养7 d,盲传2代,若出现人肠道病毒特征性的细胞病变效应(CPE),则于-80℃保存备用。
1.2 病毒RNA提取及RT-PCR鉴定
取病毒分离物上清140 μl,用QIAamp病毒RNA抽提试剂盒(QIAGEN)提取病毒RNA。采用一步法RT-PCR试剂盒(QIAGEN)进行扩增,引物分别为肠道病毒通用引物、EV71和CA16特异性引物[9]。一步法RT-PCR 的反应体系为 20 μl,包括:RNA 5 μl,5 × RTPCR 缓冲液 4 μl,dNTP Mix(10 mmol·L-1)0.8 μl,Enzyme Mix 0.8 μl,上下游引物(10 pmol·μl-1)各0.5 μl,用水(RNase-free)补足至 20 μl。一步法 RTPCR的扩增条件为:42℃逆转录45 min;95℃变性3 min;95 ℃变性20 s,45 ℃退火25 s,72 ℃延伸30 s,32个循环;72℃末次延伸10 min。实验设阴性对照,PCR产物用1.5%的琼脂糖凝胶进行电泳分析。
1.3 全长VP1基因扩增
以病毒RNA为模板逆转录合成cDNA,采用高保真PCR试剂盒(Roche)扩增VP1全长基因,EV71-VP1基因扩增采用引物EV71-VP1-F/R,CA16-VP1基因扩增采用引物CA16-VP1-F/R,引物序列见表1。PCR的反应体系为25 μl,扩增条件为:94℃ 预变性3 min;94℃变性1 min,50℃退火1 min,72℃延伸1.5 min,共35个循环;72℃末次延伸10 min。PCR产物经1%琼脂糖凝胶电泳分析,切胶回收DNA后送Invitrogen公司测序。

表1 RT-PCR扩增用引物序列
1.4 基因序列分析和构建系统进化树
利用生物信息学软件DNAStar Lasergene 7.0对正反向核苷酸序列进行整理和拼接。从GenBank下载EV71和CA16原型株以及各基因型参考毒株VP1基因序列,利用MEGA 5.0进行多序列比对以及构建系统进化树。
2 结 果
2.1 EV71和CA16病毒株的分离与RT-PCR鉴定
从HFMD患者临床标本中共分离到13株病毒。用肠道病毒通用引物行RT-PCR鉴定,发现13株病毒均属于肠道病毒。在此基础上,同时用EV71和CA16特异性引物行RT-PCR,结果显示,13株病毒中9株为EV71,4 株为 CA16。
2.2 EV71和CA16分离株 VP1基因扩增和序列测定
用EV71和CA16的VP1基因区外侧引物进行PCR扩增,PCR产物大小分别为1 015 bp(EV71-VP1)和1 370 bp(CA16-VP1),经1%琼脂糖凝胶电泳检测后回收纯化,送Invitrogen公司测序。
2.3 EV71结构蛋白VP1基因的序列同源性和系统进化分析
将9株新分离的EV71毒株VP1基因进行同源性分析显示,其核苷酸和氨基酸同源性分别为96.5%~99.8%和99%~100%。与EV71各基因型毒株VP1序列进行核苷酸与氨基酸同源性比对及系统进化分析,结果见表2和图1。同源性分析结果显示,9株新分离的EV71毒株与A、B基因型的毒株差异较大,但与C基因型比较接近,尤其是C4a基因亚型,其核苷酸同源性高达94.4%~100%,氨基酸同源性高达98.7%~100%。系统进化树分析显示,9株EV71毒株与C4a基因亚型处于同一分支。以上结果说明这9株EV71分离株为C4a基因亚型。
2.4 CA16结构蛋白VP1基因的序列同源性和系统进化分析
4株新分离的CA16毒株VP1基因进行同源性分析显示,其核苷酸和氨基酸同源性分别为96.2%~98.5%和99.3%~100%。与29株不同基因型的CA16参考毒株比对及系统进化分析,结果见表3和图2。同源性比对结果显示,4株CA16的VP1核苷酸序列与A基因型差异最大,B2基因亚型次之,与B1基因亚型最接近,尤其是B1b基因亚型。氨基酸序列除了A基因型外,与其他基因亚型差异不大。系统进化分析显示,4株CA16毒株与B1b基因亚型处于同一分支。这些结果说明,4株CA16毒株均属于B1b基因亚型。

表2 9株EV71与不同基因型(亚型)代表株VP1核苷酸与氨基酸同源性比较

表3 4株CA16与不同基因型(亚型)代表株VP1核苷酸与氨基酸同源性比较
3 讨 论
HFMD是一种婴幼儿常见的发热和出疹性疾病。自2008年以来,该病在中国大陆一直呈高流行态势。HFMD可由多种肠道病毒引起,其中以EV71和CA16最为多见。早期发现的HFMD主要由CA16引起,EV71于1969年在美国首次分离确认[10],20世纪70年代以后,EV71和CA16感染交替出现。近年来,HFMD在东南亚地区疫情严重,流行过程中大多同时检测到EV71和CA16两种病原体。2008年安徽阜阳暴发的HFMD中,EV71是最主要的病原体,也有一定数量的CA16感染[11]。同年宁夏地区暴发的HFMD则以CA16感染为主[12]。最近嵇红等人报道了2008至2010年江苏省HFMD流行病学和病原学研究结果,认为轻症病例以EV71和CA16共同主导流行,而重症病例和死亡病例则以EV71感染为主[13]。

图1 基于EV71全长VP1基因核苷酸序列构建的系统进化树 “▲”为本研究新分离EV71毒株
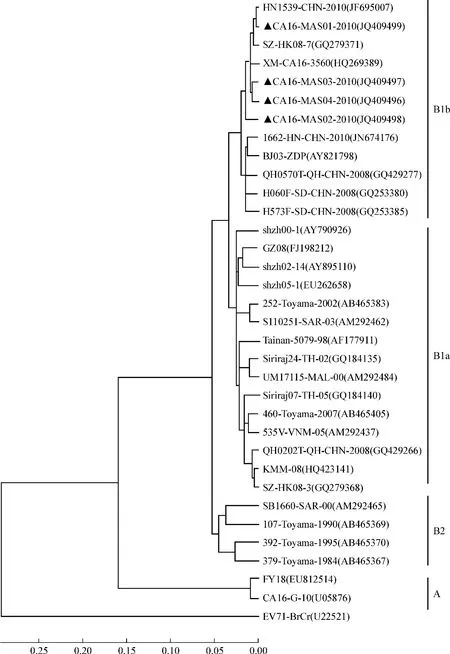
图2 基于CA16全长VP1基因核苷酸序列构建的系统进化树 “▲”为本研究新分离CA16毒株
EV71和CA16均属于小RNA病毒科、肠道病毒属A组,基因组为单股正链RNA,约含7 400个核苷酸,仅含有1个开放读码框,包括P1、P2和P3基因区,其中P1基因编码结构蛋白VP1、VP2、VP3和VP4。通常认为,VP1蛋白直接决定病毒的抗原性,具有与病毒血清型基本对应的遗传多样性。我们利用大肠杆菌表达了EV71全长VP1蛋白,利用间接ELISA和免疫印迹法检测显示,VP1蛋白具有良好的抗原性,可与EV71感染患者血清以及动物免疫血清良好反应[14]。故VP1区的核苷酸序列可作为肠道病毒血清型鉴定和基因分型的依据。
本次研究中共分离到9株EV71和4株CA16毒株,在测定这些毒株VP1全长基因序列的基础上进行同源性比对和系统进化树分析。这些分离毒株的VP1基因序列高度一致,9株EV71的核苷酸同源性为96.5%~99.8%,4株CA16的核苷酸同源性为96.2%~98.5%。这些数据表明,这些毒株均分别来自EV71和CA16的一个基因亚型。与EV71各基因型代表株进行比较显示,9株EV71与C4a基因亚型最接近,其核苷酸和氨基酸序列同源性分别为94.4%~100%和98.7%~100%。董晓楠等分析了1970至2004年全球532株EV71分离株的VP1核苷酸序列,认为同源性高于85%的毒株为同一基因型,高于91%为同一基因亚型[15]。目前,根据 VP1核苷酸序列的差异,可将EV71分为A、B和C基因型;B和C基因型又可进一步分为B1~B5和C1~C5基因亚型。目前,我国大陆地区流行的EV71绝大多数属于C4亚型,从系统进化树可以看出,C4亚型又可以分成C4a和C4b两个分支,2004年以前多为C4b亚型,而近年来中国大陆流行的EV71毒株几乎都是C4a亚型[16]。从图1可以看出,我们分离获得的9株 EV71也属于C4a基因亚型。
与EV71相比,CA16相对保守,VP1区基因序列变异也较小。目前,CA16的基因分型存在两种观点:一种观点认为可将CA16分为A、B、C 3个基因型,C型可进一步分为C1、C2和C3基因亚型,B和C基因型之间的差异在5.8%~11%之间,C1~C3基因亚型之间的差异在0~4.6%[17-19];另一种观点认为不同基因型之间的差异应大于15%,这样可将CA16分为A、B两个基因型,其中B基因型又可分为B1和B2两个分支[20]。若参照EV71基因型划分标准,即不同基因型VP1的核苷酸差异应该大于15%,同一基因型不同亚型之间的差异应该在6%~11%之间,则选择上述第2种观点的分型标准较为合适。如图2所示,CA16的原型株G-10和2008年安徽阜阳株FY-18属于A基因型,其余为B基因型。B基因型又有两个分支:1支为早期CA16分离株,主要在1981至2000年间流行,划分为B2基因亚型;另1支以2000年后CA16分离株为主,划分为B1基因亚型。B1亚型又可明显地分为两大簇,分属于B1a和B1b两条进化分支。近年来国内有关CA16分子进化方面研究发现,我国目前流行的CA16毒株主要是B1亚型,而且B1a和B1b两个进化分支在同一流行地区出现共循环现象[21-23]。我们分离到的4株CA16毒株处在B1b进化分支上,故属于B1b基因亚型,与河南分离株HN1539、深圳分离株SZ/HK08-7、厦门分离株XM-3560具有最高的核苷酸同源性。目前,针对CA16的分子进化研究相对较少,尚无国际公认的基因分型标准,但随着CA16分离株的增多,GenBank收录的相关基因序列逐渐丰富,CA16的基因分型标准将会得到进一步的完善和确立。
加强对EV71和CA16的分子流行病学监测,及时了解病毒的变异趋势以及进化关系,对HFMD的预防控制、疫苗株的选择以及肠道病毒基础研究等具有重要意义。本次研究分析了苏皖地区流行的EV71和CA16毒株的VP1基因特征以及系统进化研究,为EV71和CA16疫苗株的选择提供了依据。
[1]SOLOMON T,LEWTHWAITE P,PERERA D,et al.Virology,epidemiology,pathogenesis,and control of enterovirus 71[J].Lancet Infect Dis,2010,10(11):778-790.
[2]LEE T C,GUO H R,SU H J,et al.Diseases caused by enterovirus 71 infection [J].Pediatr Infect Dis J,2009,28(10):904-910.
[3]ABUBAKAR S,CHEE H Y,AL-KOBAISI M F,et al.Identification of enterovirus 71 isolates from an outbreak of hand,foot and mouth disease(HFMD)with fatal cases of encephalomyelitis in Malaysia[J].Virus Res,1999,61(1):1-9.
[4]AHMAD K.Hand,foot,and mouth disease outbreak reported in Singapore[J].Lancet,2000,356(9238):1338.
[5]CHAN L G,PARASHAR U D,LYE M S,et al.Deaths of children during an outbreak of hand,foot,and mouth disease in sarawak,malaysia:clinical and pathological characteristics of the disease.For the Outbreak Study Group[J].Clin Infect Dis,2000,31(3):678-683.
[6]LIU C C,TSENG H W,WANG S M,et al.An outbreak of enterovirus 71 infection in Taiwan,1998:epidemiologic and clinical manifestations[J].J Clin Virol,2000,17(1):23-30.
[7]何家鑫,沈晓娜.手足口病流行特点及其防治[J].海峡预防医学杂志,2001,7(3):22-24.
[8]DING N Z,WANG X M,SUN S W,et al.Appearance of mosaic enterovirus 71 in the 2008 outbreak of China[J].Virus Res,2009,145:157-161.
[9]LIU M Y,LIU W,LUO J,et al.Characterization of an outbreak of hand,foot,and mouth disease in Nanchang,China in 2010[J].PLoS One,2011,6(9):e25287.
[10]SCHMIDT N J,LENNETTE E H,HO H H.An apparently new enterovirus isolated from patients with disease of the central nervous system[J].J Infect Dis,1974,129(3):304-309.
[11]ZHANG J,SUN J L,CHANG W D,et al.Characterization of hand,foot,and mouth disease in China between 2008 and 2009[J].Biomed Environ Sci,2011,24(3):214-221.
[12]王东艳,陈慧,严冬梅,等.宁夏地区2008年柯萨奇病毒A组16型VP1区基因特征分析[J].中华流行病学杂志,2010,31(8):904-908.
[13]嵇红,李亮,吴斌,等.江苏省2008至2010年手足口病流行病学及病原学特征分析[J].中华儿科杂志,2012,50(4):261-266.
[14]ZHANG J,DONG M,JIANG B,et al.Antigenic characteristics of the complete and truncated capsid protein VP1 of enterovirus 71[J].Virus Res,2012,167(2):337-342.
[15]董晓楠,应剑,陈应华.1970~2004年全球肠道病毒71型分离株的分子流行病学分析[J].科学通报,2007,52(9):1021-1027.
[16]江丽凤,叶鹏凌,高风华,等.中国大陆EV71病毒分离株的分子流行病学研究[J].热带医学杂志,2011,11(12):1341-1345.
[17]LI L,HE Y,YANG H,et al.Genetic characteristics of human enterovirus 71 and coxsackievirus A16 circulating from 1999 to 2004 in Shenzhen,People's Republic of China[J].J Clin Microbiol,2005,43(8):3835-3839.
[18]IWAI M,MASAKI A,HASEGAWA S,et al.Genetic changes of coxsackievirus A16 and enterovirus 71 isolated from hand,foot,and mouth disease patients in Toyama,Japan between 1981 and 2007[J].Jpn J Infect Dis,2009,62(4):254-259.
[19]HOSOYA M,KAWASAKI Y,SATO M,et al.Genetic diversity of coxsackievirus A16 associated with hand,foot,and mouth disease epidemics in Japan from 1983 to 2003[J].J Clin Microbiol,2007,45(1):112-120.
[20]PERERA D,YUSOF M A,PODIN Y,et al.Molecular phylogeny of modern coxsackievirus A16[J].Arch Virol,2007,152(6):1201-1208.
[21]崔爱利,许文波,李秀珠,等.上海市2002年柯萨奇病毒A组16型基因特征分析[J].中国疫苗和免疫,2009,15(2):135-140.
[22]王娟,罗珍,范东瀛,等.2007-2008年北京地区CA16 VP1区系统进化分析[J].第三军医大学学报,2009,31(23):2342-2346.
[23]许玉玲,卫海燕,穆玉姣,等.河南省2010年柯萨奇病毒A组16型 VP1区基因特征分析[J].中国病毒病杂志,2011,1(3):200-203.

