罗非鱼下脚料蛋白水解液制备锌蛋白盐的研究
孔美兰,吉宏武,章超桦
(1.韩山师范学院生物系,广东潮州 521041;2.广东海洋大学食品科技学院,广东湛江524088)
众所周知,锌是已知的人体14种必需微量元素之一,由于其在人体内广泛的生理生化作用而被称为“生命元素”[1]。人类锌绝对缺乏比较少见,但边缘性锌缺乏常见。这些人群容易缺锌的主要原因在于他们由于生理需要对锌的需求量较大而日常膳食中的锌摄入不足以及生物利用率较低,这就造成机体处于锌缺乏状态。因此,研究出高生物利用率的锌蛋白盐具有很现实的意义[2]。锌蛋白盐具有高生物利用率、无毒、无刺激作用,适口性好等优点[3-4],成为近几年来锌补剂的研究热点。氨基酸微量元素络合物作为饲料添加剂研究较多,但作为食品营养强化剂研究较少[5-6]。罗非鱼(Tilapia)被视为传统白肉鱼种的替代品种,正日渐受到欧美市场青睐。国际市场对罗非鱼的巨大需求推动了国内罗非鱼产业化进程。其中罗非鱼片出肉率不到40%,在其加工过程中产生大量的加工废弃物,如何综合利用这些废弃物,增加附加值,减少环境污染是今后要解决的难题[7]。本文在前期研究的基础上,以锌的螯合率为指标,采用经过超滤处理的罗非鱼下脚料蛋白水解液与无机锌离子进行螯合反应,以制备高生物利用率的锌蛋白盐。
1 材料与方法
1.1 材料与设备
罗非鱼下脚料(包括鱼头、鱼骨刺、鱼内脏)广东湛江国溢水产品有限公司;罗非鱼下脚料超滤液自制;无水乙醇、EDTA、茚三酮、ZnSO4·5H2O、醋酸锌、ZnCl2等试剂 均为分析纯。
HJ-4型多头磁力加热搅拌器 上海浦东荣丰科学仪器有限公司;pHS-25型酸度计 上海伟业公司;FA2104S分析天平 上海天平仪器厂;TIANFANGTP-10-20型超滤装置 天津膜天膜工程技术有限公司;10DX-FTIR型红外光谱仪 美国Nicolet。
1.2 实验方法
利用罗非鱼下脚料水解蛋白超滤液为复合氨基酸和小肽来源,与Zn2+在水溶液中进行反应以合成锌蛋白盐。
1.2.1 复合氨基酸液的制备[8]将下脚料洗净,绞成肉糜,500g分装作为待测样品,于-18℃冻藏备用。酶解时,将原料取出用自来水解冻,按以下条件进行自溶水解。水解条件为:pH7.5,50℃,料液质量比1∶3,时间6.5h。水解完成后沸水浴15min灭酶,离心所得的酶解液即为复合氨基酸液。
1.2.2 超滤液的制备 对复合氨基酸液进行超滤处理,超滤采用TO10-20蠕动泵,超滤膜的孔径为2.5nm,工作压力为0.05MPa,流量为10~12L/h,超滤后蛋白水解液的分子量在6000u以下。
1.2.3 锌蛋白盐的螯合工艺[3]罗非鱼下脚料水解蛋白超滤液→加入无机锌盐→调节pH→水浴加热→4000r/min,离心5min→取上清液减压浓缩→浓缩液加入5倍体积无水乙醇→4000r/min,离心5min→取沉淀,冷冻干燥后得到锌蛋白盐。
1.2.4 锌的螯合率的测定方法 锌含量的测定[4]:采用EDTA络合滴定法。

式中:C—标准EDTA溶液的浓度,mol/L;V1—滴定螯合态锌元素所消耗的EDTA溶液体积,mL;V0—滴定锌元素总量所消耗的EDTA溶液体积,mL。
1.2.5 螯合方式
1.2.5.1 单因素实验 配位比对螯合率的影响[10]:在螯合条件为:90℃、1h、pH6.0,研究配位比对锌螯合率的影响。
pH对螯合反应的影响:在螯合条件为:90℃、1h、配位比为2∶1,研究pH对锌螯合率的影响。
螯合时间的影响:在螯合条件为:90℃、pH6.0、配位比为2∶1,考查时间对螯合率的影响。
反应温度对螯合反应的影响:由于螯合反应为吸热反应,温度对螯合物的生成具有一定的影响。实验选择反应温度为40~90℃,温度间隔为10℃,在螯合条件为:10min、pH6.0、配位比为2∶1,考查温度对锌螯合率的影响。
不同锌盐对螯合率的影响:实验选用醋酸锌、氯化锌、硫酸锌为实验锌源,确定不同锌源对螯合率的影响。在螯合条件为:10min、pH6.0、配位比为2∶1、70℃,考查锌源对锌螯合率的影响。
1.2.5.2 正交实验 通过单因素实验和数据分析,目的进一步考虑各因素的综合影响,对影响螯合反应的四个主要因素:反应温度、反应时间、反应pH、配位比设计了四因素三水平正交实验,其因素和水平如表1所示。
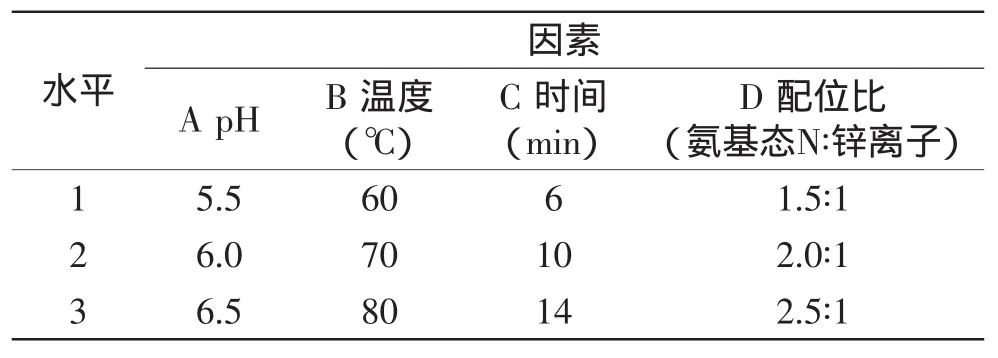
表1 螯合正交实验因素与水平Table 1 Levels and factors of chelation orthogonal test
1.2.6 锌蛋白盐的分离与定性分析[11]
1.2.6.1 螯合物的分离 本实验采用有机溶剂无水乙醇来分离提纯水溶性的锌蛋白盐,V无水乙醇∶V锌蛋白浓缩液=5∶1。这是由于锌蛋白盐在乙醇、丙醇、丙酮等有机溶剂中的溶解度极小,而游离金属离子、氨基酸和小肽均能溶于乙醇等有机溶剂中,利用这一特性,不仅可以制得高纯度的锌蛋白盐,而且有利于对螯合物的进一步研究,同时有机溶剂的回收利用可有效地降低成本。
1.2.6.2 定性分析 称取经冷冻干燥的锌蛋白盐结晶少量,加KBr研磨,烘干后再研磨均匀压片,同时称取经冷冻干燥的蛋白水解超滤液按前述方法压片,用10DX-FTIR型红外光谱仪测定,光谱扫描范围4000~400cm-1,分辨率8cm-1。
1.2.7 数据统计分析 采用正交设计助手II v 3.1软件对正交实验结果进行方差分析。
2 结果与分析
2.1 配位比对螯合反应的影响

图1 配位比对螯合率的影响Fig.1 Effect of the AA/Zn2+ratio on ability of chelation
由图1可知,当原料配位比小于2∶1时,螯合反应进行不完全,螯合率偏低;当原料配比处于2∶1和2.5∶1之间时,锌螯合率已基本达到最大;当原料配比大于2.5∶1时,螯合率有所下降,说明过高增加氨基酸和小肽的浓度不利于锌蛋白盐的形成。而且当配位比太大时生成的分子量过大,由于其稳定性过强难以为生物体所吸收利用。因此,选择2∶1的原料配比作最佳实验条件合成锌蛋白盐。既能保证获得足够稳定的螯合物,又能充分利用氨基酸和小肽,降低成本。
2.2 pH对螯合反应的影响
由图2可知,随着pH的增大,锌的螯合率缓慢增大,当pH达到6时,螯合率最高,继续增加pH,螯合率急剧下降。由此可见,pH为6.0时锌的螯合率最大。

图2 pH对螯合率的影响Fig.2 Effect of pH on ability of chelation
2.3 螯合时间的影响
由图3可知,螯合反应在10min时就结束了。之后随着时间的延长,螯合率呈下降趋势。这是由于螯合反应是快速反应,但是在70℃这样的温度下,新形成的螯合物也会部分分解还原为复合氨基酸、小肽和锌无机盐。因此,螯合时间确定为10min。
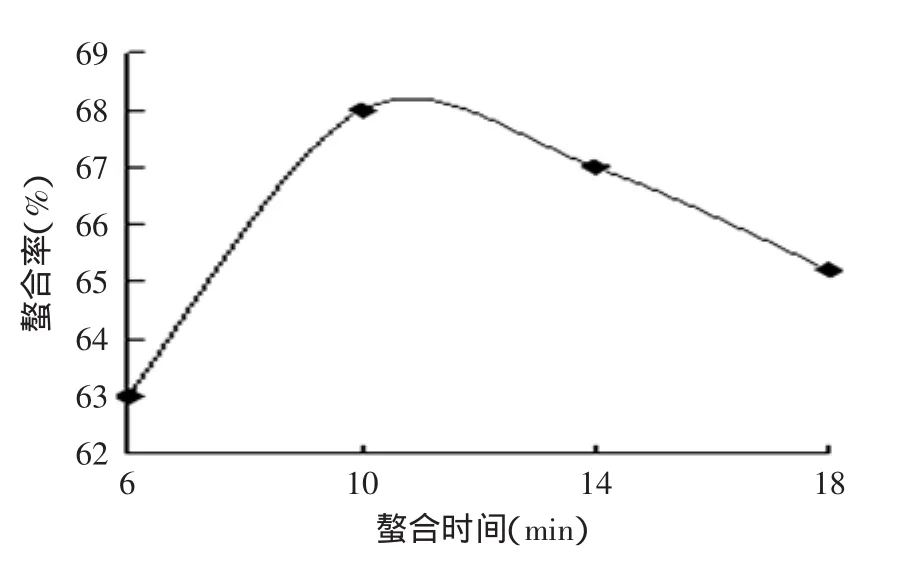
图3 时间对螯合率的影响Fig.3 Effect of time on ability of chelation
2.4 反应温度对螯合反应的影响
由图4可知,随着螯合温度的升高,螯合率呈上升的趋势,当温度超过70℃时,螯合率开始下降。这是由于螯合反应为吸热反应,因而反应温度越高对反应越有利,但若反应温度过高,则容易破坏肽及其螯合物的结构;若反应温度太低,则螯合反应速度较慢且收率较低,所以选择反应温度为70℃,此时锌的螯合率最高。
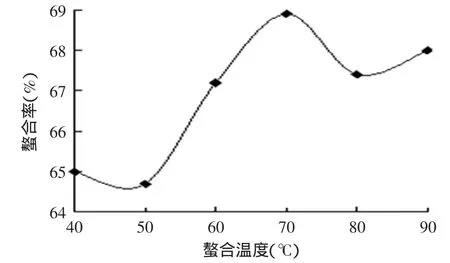
图4 温度对螯合率的影响Fig.4 Effect of temperature on ability of chelation
2.5 不同锌盐对螯合率的影响
由图5可知,硫酸锌作为锌源更有利于锌蛋白盐的合成,氯化锌次之,乙酸锌最差。
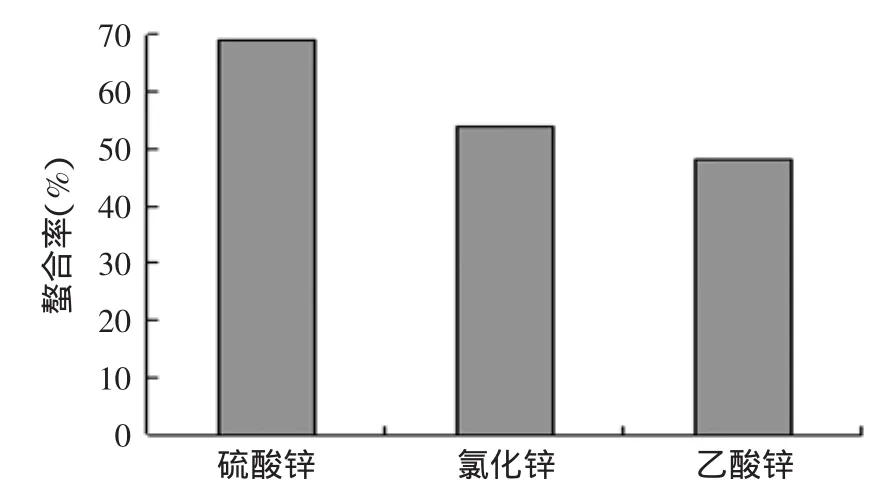
图5 不同锌源对螯合率的影响Fig.5 Effect of zinc sources on ability of chelation
2.6 锌蛋白盐螯合条件的正交实验结果
由表2可知,螯合影响因素由主到次依次是:A、D、C、B;螯合的最优方案是:A2B3C3D1;即最佳螯合条件是:pH6.0,80℃,14min,配位比为1.5∶1。

表2 螯合实验正交实验结果Table 2 Design and result of chelation trial condition
采用正交设计助手II v3.1软件对正交实验结果进行方差分析,结果见表3。pH对应的F比比F临界值大。表明pH对锌蛋白盐螯合效果影响显著(p<0.05)。再根据实验要求对最优方案进行验证,锌蛋白盐螯合率为68.12%,高于正交实验表2中最高抑制率。因此,确定锌蛋白盐螯合的最佳工艺条件是:pH6.0,80℃,14min,配位比为1.5∶1。
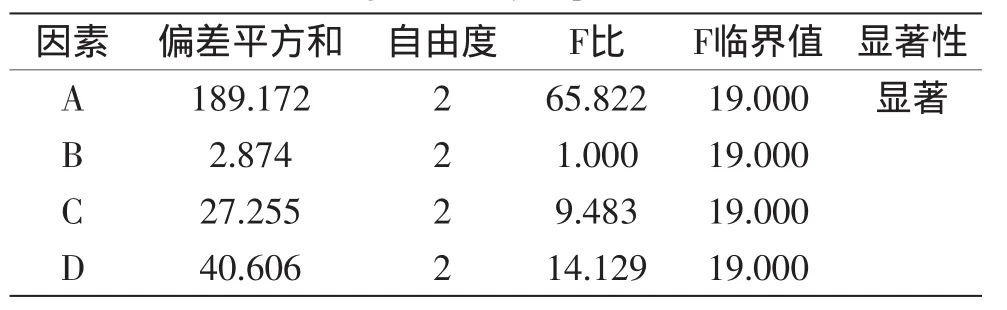
表3 正交实验结果方差分析表Table 3 Analysis of variance for the results of orthogonal array experiment
2.7 锌蛋白盐的性质鉴定
2.7.1 螯合物的初步鉴定 锌蛋白盐是一种白色粉末状固体,无异味,易溶于水,不溶于乙醇等有机溶剂,室温下稳定存在。
将精制的锌蛋白盐粉末溶于水,得淡黄色溶液,加入茚三酮,溶液颜色由淡黄色变为酒红色。同时做空白对比实验:罗非鱼下脚料蛋白水解液遇茚三酮变成蓝紫色,符合α-氨基酸与茚三酮的典型显色反应。这一显著的颜色变化初步说明锌蛋白盐水溶液中的氨基酸和小肽不是以游离形式存在的,制备的螯合物溶液不是ZnSO4与复合氨基酸、小肽的简单物理组合,且用有机溶剂沉淀出的固态螯合物沉淀溶于水,也有别于水不溶性的锌蛋白盐。由此可初步推断产物为锌与氨基酸和小肽的螯合物。
2.7.2 螯合物的红外光谱分析 罗非鱼下脚料水解蛋白和锌蛋白盐的红外光谱分别如图6和图7所示。由图6~图7可知,罗非鱼下脚料水解蛋白中由氨基(-NH2)的不对称伸缩振动引起的3072.84cm-1和2964.95cm-1的特征吸收。在水解蛋白与锌螯合后,螯合物的红外光谱显示,氨基的特征吸收峰仍然存在,但红移至3347.94cm-1处,说明水解蛋白中的氨基参与了配位反应。另外,水解蛋白在2124.2cm-1的吸收峰,经络合之后该峰在锌蛋白盐的红外谱图中消失了,这与文献报道的α-氨基酸在2100cm-1处有一特征吸收峰,络合之后该峰就消失的结论相符,进一步说明了锌蛋白盐的形成[12]。

图6 罗非鱼下脚料蛋白自溶水解产物红外光谱图Fig.6 Infrared spectrum of auto-hydrolyzate of byproduct of Tilapia

图7 锌蛋白盐的红外光谱图Fig.7 Infrared spectrum of zinc proteinate
3 结论
经过超滤处理的罗非鱼下脚料蛋白水解液与无机锌离子螯合成锌蛋白盐。实验采用单因素和正交实验,考察了螯合pH、温度、时间、锌源、配位比对锌的螯合率的影响,最终确定了最佳螯合条件是:pH6.0,80℃,14min,配位比为1.5∶1,螯合率为68.12%。
锌蛋白盐粉末溶于水,加入茚三酮,溶液颜色由淡黄色变为酒红色。同时做空白对比实验:罗非鱼下脚料蛋白水解液遇茚三酮变成蓝紫色,符合α-氨基酸与茚三酮的典型显色反应。这一显著的颜色变化初步说明锌蛋白盐水溶液中的氨基酸和小肽与锌离子是以螯合态存在的。采用红外光谱法对锌蛋白盐进一步定性分析。氨基的特征吸收峰发生了红移,说明水解蛋白中的氨基参与了配位反应。另外,水解蛋白在2124.2cm-1的吸收峰,经络合之后该峰在锌蛋白盐的红外光谱图中消失了,从而进一步说明了锌蛋白盐的形成。
[1]刘颖,于守洋.人体锌代谢与需要量[J].中国公共卫生学报,1999(1):34-36.
[2]Geneva Kim.Report of a joint FAO/WHO/UNU expert consultration[J].WHO Technical Report Series,1985,43(2):724.
[3]吴春,黄梅桂.响应曲面法优化槲皮素锌络合反应条件的研究[J].化学世界,2008(10):37-40.
[4]曾仁权,钟国情.复合氨基酸微量元素螯合物制备新工艺的研究[J].化学研究与应用,1998,10(10):99-102.
[5]李永富,施用晖,潘茹芳.小肽络合铁对新生仔猪补铁效果的研究[J].饲料研究,2000(2):11-13.
[6]吴信,印遇龙,舒绪刚.微量元素氨基酸螫合物的作用机理及应用现状[J].营养与饲料,2008,7(3):68-71.
[7]胡振珠,杨贤庆,马海霞,等.罗非鱼骨粉制备氨基酸螯合钙及其抗氧化性研究[J].食品科学,2010,31(20):141-145.
[8]孔美兰,吉宏武,章超桦.罗非鱼下脚料自溶条件的初步探讨[J].湛江海洋大学学报,2009,25(4):27-30.
[9]吴茹怡,曾里,曾凡骏.复合氨基酸螯合物鉴定方法的研究[J].食品科技,2006(3):104-107.
[10]高素蕴,潘思轶,郭康权.大豆分离蛋白水解物螯合锌(Ⅱ)的合成与制备[J].食品科学,2003,24(10):117-120.
[11]张红漫,陈国松,冯改霞,等.单项氨基酸微量元素螯合物的研究[J].氨基酸和生物资源,2002,24(4):46-50.
[12]汪建伟,王德才,王永洪,等.鸡羽毛制备复合氨基酸铁铵的研究[J].氨基酸和生物资源,1997,19(1):7-9.

