响应面法优化提取银杏雄株叶片聚戊烯醇的工艺研究
吴秋月, 陈 鹏, 仲月明, 周长远, 沈丹红, 蒋 菲
(扬州大学园艺与植物保护学院,江苏扬州225009)
银杏聚戊烯醇是银杏Ginkgo bilobaL.叶中重要药用和保健有效成分,是人体合成具广泛重要生理作用的多萜醇及其衍生物的中间体,经代谢形成多萜醇后可补充体内多萜醇的不足,不仅可提高免疫功能、抑制癌细胞转移、促进肝细胞再生[1-2],而且还可改善膜的流动性、稳定性和渗透性,从而增强膜的融合[3-4]。这些药用价值使银杏聚戊烯醇更加凸显成为具重要开发利用价值的生物活性成分。
目前银杏雌株主要用于结实生产种核,银杏雄株由于其生殖特性成为主要的叶用资源[5]。银杏叶聚戊烯醇相对黄酮类和萜内酯类化合物的量较高[6],但由于其提取工艺复杂、成本高等,使其开发利用进展不及黄酮类和萜内酯类化合物。银杏聚戊烯醇是由一系列异戊烯基单元和终端异戊烯醇单元组成的一类线形类脂化合物[7],极性很弱,因此可使用非极性或弱极性溶剂来提取。而提取中溶剂类型、料液比、提取时间等显著影响聚戊烯醇得率。各个重要影响因子的不同水平处理的提取体系已见有采取正交设计法进行优化选择的报道[8]。为了进一步开发利用银杏雄株资源,本研究采用响应面 (Response Surface Methodology,RSM)法优化超声提取银杏雄株叶片聚戊烯醇,以期为银杏叶片聚戊烯醇的提取利用提供理论依据与应用技术。
1 材料与方法
1.1 叶片采集与处理
取自扬州大学银杏园内25株13年生雄株,栽培管理一致,生长发育良好。分别于2011年6月~10月平均采集供试雄株树冠内、中、外以及雄株上、中、下的叶片,每株采集200片叶。银杏叶片采摘后洗净、沥干,放入烘箱内105℃杀青30 min,80℃烘至水分在10%以下,粉碎过80目筛,置于塑料袋内密封后于-40℃冰箱储存备用。
1.2 实验仪器与试剂
实验仪器:KQ—500B超声波清洗器,昆山市超声仪器有限公司;旋转蒸发仪 (RE—5299),上海亚荣生化仪器有限公司;Shimadzu LC-10A高效液相色谱仪,日本岛津公司;紫外检测器 (SPD—10A),日本岛津公司;电热恒温鼓风干燥箱(DGG—9240A型),上海森信实验仪器有限公司;高速冷冻离心机 (GL—21M),长沙平凡仪器仪表有限公司。
实验试剂:聚戊烯醇C85对照品、C90对照品、C95对照品,购自瑞典Larodan公司。石油醚、正己烷、乙酸乙酯等试剂均为分析纯,200~300目硅胶,HPLC用甲醇、异丙醇、正己烷为色谱纯,HPLC用水为超纯水,其他用水为双蒸水。
1.3 银杏叶聚戊烯醇的提取
准确称取银杏雄株叶粉末3 g,加入提取溶液用超声波法提取,提取一段时间后过滤,然后进行皂化反应 (5%氢氧化钠甲醇溶液,料液比1∶3,超声2.5 h,温度45℃),取上层黄色澄清液体,旋转蒸发浓缩,硅胶柱层析 [5 g硅胶干法装柱,石油醚-乙酸乙酯 (9∶1)洗脱,收集20 mL],旋转蒸发浓缩,溶解于2 mL的正己烷中,得聚戊烯醇的提取物以供HPLC检测。
1.4 HPLC检测
1.4.1 高效液相色谱条件 十八烷基硅烷键合硅胶柱色谱柱 (150 mm×6.0 mm,5 μm);柱温为30℃;流动相为异丙醇 -甲醇 -正己烷 -水(50∶25∶10∶2);体积流量为1 mL/min;检测波长为215 nm;进样量为10 μL。HPLC图谱见图1。
1.4.2 聚戊烯醇标准曲线的制作 王成章曾采用四种聚戊烯醇标准品测试样品,发现不同链长的聚戊烯醇标准品,对样品测试结果的相对标准误差小于3%,因此,在HPLC定量分析时,可以认为不同链长的聚戊烯醇对应的各色谱峰具有相同的响应因子[17],所以本实验选择其中一种聚戊烯醇C90-Prenol作为外标物,以建立聚戊烯醇的HPLC的定量方法,从而对样品进行定量分析。
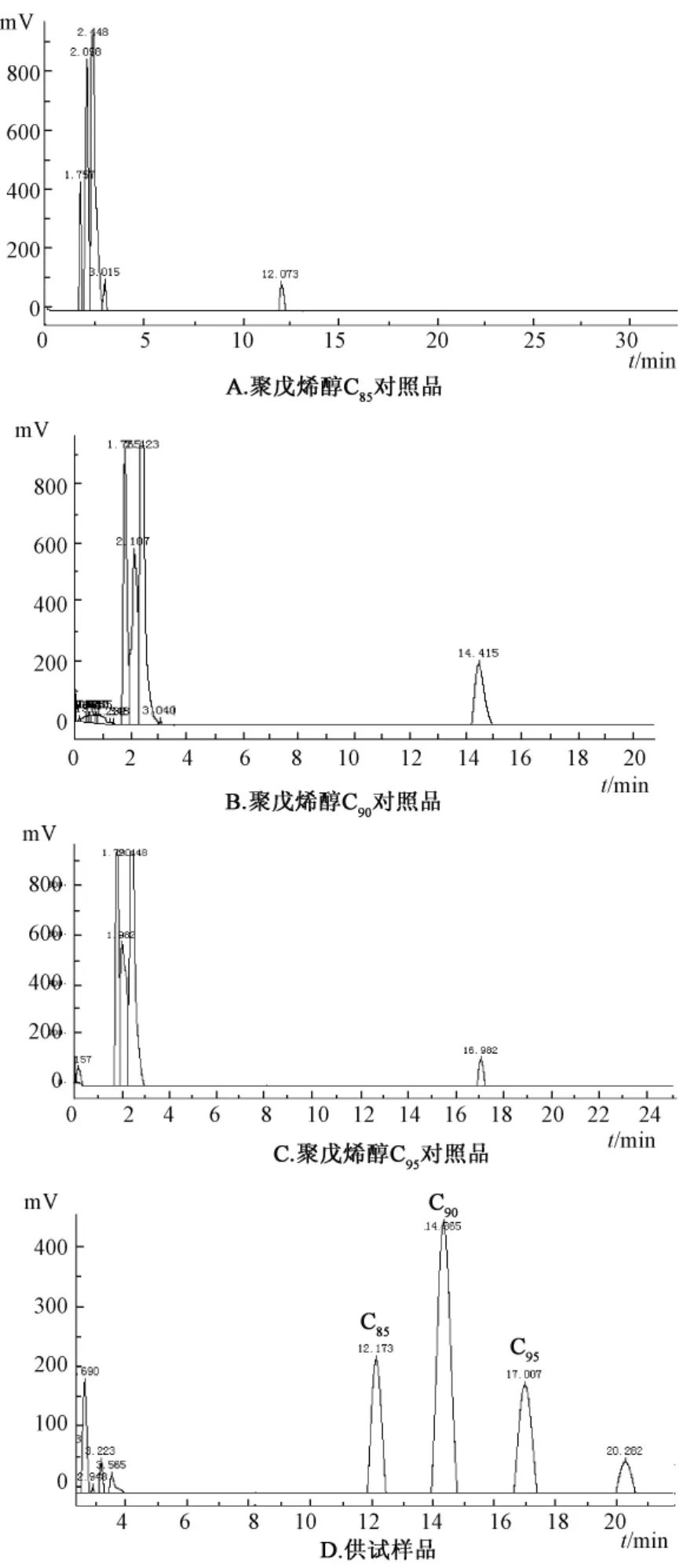
图1 不同聚戊烯醇对照品和供试样品色谱图Fig.1 HPLC chromatograms of reference substances and the samples
取对照品C90-Prenol 0.02 g,精密称定,用正己烷溶解,置于100 mL量瓶中,定容至刻度,得C90-Prenol标准贮备液 (0.20 mg/mL)。用移液管分别取C90-Prenol标准贮备液 5、10、20、40 mL,用正己烷定容至 50 mL量瓶,得 0.02、0.04、0.08、0.16 mg/mL的标准溶液,分别取各标准溶液和贮备液进样10 μL,测定其峰面积。以对照品浓度为横坐标,峰面积为纵坐标,绘制标准曲线并得到聚戊烯醇线性回归方程及相关系数为:Y=5×10-7X-2.950 6,R2=0.998 7。
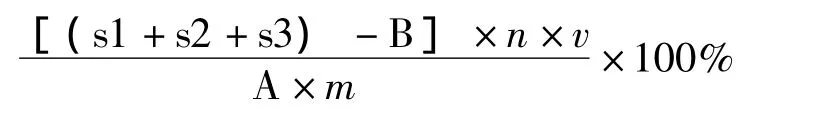
式中:s1、s2、s3分别为 HPLC中 C85、C90、C95聚戊烯醇的峰面积;
A为标准曲线回归方程的斜率;B为标准曲线回归方程的截距;n为稀释倍数;v为样品体积;m为银杏雄株叶片质量。
1.5 银杏雄株叶片聚戊烯醇超声提取的主要影响因子及其处理水平的确定
影响银杏雄株叶片聚戊烯醇提取的因子有很多,综合国内外文献资料比较得出,银杏雄株叶片聚戊烯醇提取的主要影响因子有提取溶剂的类型、超声提取的料液比、温度和时间,因此先设计确定提取溶剂类型的实验并在此基础上设计以料液比、时间、温度为因子的单因素试验,考察各因素对银杏雄株叶片聚戊烯醇得率的影响。
1.5.1 提取溶剂的确定 精密称取预处理好的银杏雄株叶片粉末3 g共9份,分为3组,每组3个平行样,分别用正己烷、石油醚、乙酸乙酯进行超声提取,料液比1∶10 g/mL,超声时间30 min,温度40℃。比较得率,以确定最佳提取溶剂。
1.5.2 料液比对银杏雄株叶片聚戊烯醇得率的影响在本实验中,料液比是银杏雄株叶片质量与提取所用的溶剂的体积的比值。精密称取3 g银杏雄株叶片粉末5份,在40℃条件下,分别采用1∶10、1∶12、1∶14、1∶16、1∶18的料液比,重复3次,超声30 min以比较不同料液比对提取银杏叶聚戊烯醇的影响。
1.5.3 超声波时间对银杏雄株叶片聚戊烯醇得率的影响 精密称取3 g银杏雄株叶片粉末5份,在料液比1∶10,温度40℃的条件下分别用15、30、45、60、75 min超声波时间进行超声波浸提聚戊烯醇,重复3次,考察不同超声波时间对银杏雄株叶片聚戊烯醇得率的影响。
1.5.4 温度对银杏雄株叶片聚戊烯醇得率的影响精密称取3 g银杏雄株叶片粉末5份,在料液比1∶10,超声时间为30 min的条件下下分别用20、30、40、50、60℃的超声温度进行超声波浸提聚戊烯醇,重复3次,考察不同超声提取温度对银杏雄株叶片聚戊烯醇得率的影响。
1.6 Box-Behnken试验设计
在以上单因素实验的基础上,根据Box-Behnken的中心组合试验设计原理[9-10]。选取影响银杏雄株叶片聚戊烯醇得率的三个主要因素料液比、时间、超声温度进行优化组合。试验因素水平安排见表1。

表1 Box-Behnken试验设计因素水平Tab.1 Experimental levels of factors in Box-Behnken design
2 结果与分析
2.1 银杏雄株叶片聚戊烯醇超声提取的主要影响因子及其处理水平的确定
2.1.1 提取溶剂的确定 提取溶剂的种类是影响聚戊烯醇提取的重要因素之一,按照1.5.1项的方法考察了石油醚、正己烷和乙酸乙酯3种不同的溶剂对银杏雄株叶片聚戊烯醇得率的影响,实验数据用SPSS软件处理后结果如表2所示:石油醚、正己烷、乙酸乙酯均可用于聚戊烯醇的提取,其中正己烷的提取率显著高于石油醚和乙酸乙酯,而石油醚和乙酸乙酯之间没有显著差异,因此综合考虑得率及各种溶液的成本,本实验以正己烷作为提取溶剂。

表2 不同溶剂对聚戊烯醇得率的影响 (n=3)Tab.2 Effect of different solvents on yield of polyprenols(n=3)
2.1.2 料液比对银杏雄株叶片聚戊烯醇提取率的影响 按照1.5.2项的方法考察不同料液比对银杏雄株叶片聚戊烯醇得率的影响,重复3次 (n=3),不同处理下聚戊烯醇的得率见图2。由图可知,随着料液比的增大,银杏叶聚戊烯醇的得率逐渐增大,当料液比超过1∶14 g/mL时,聚戊烯醇得率不再上升,反而有所下降。这说明料液比对聚戊烯醇的提取影响较显著,并非简单的正相关关系,因此,超声波提取银杏叶聚戊烯醇的料液比初步确定为1∶14 g/mL。
2.1.3 超声波时间对银杏雄株叶片提取率的影响按照1.5.3项的方法考察不同超声波时间对银杏雄株叶片聚戊烯醇得率的影响,重复3次 (n=3),结果如图3所示。由图可知,银杏雄株叶片聚戊烯醇的得率随着时间的增加呈现先上升再下降的总体趋势,当提取时间为45 min时,得率达到最大。这说明,提取时间对聚戊烯醇的得率有比较显著的影响,时间过短,提取不充分,时间过长,可能引起很多其他杂质也逐渐溶出,导致得率降低。因此,超声时间初步确定为45 min。
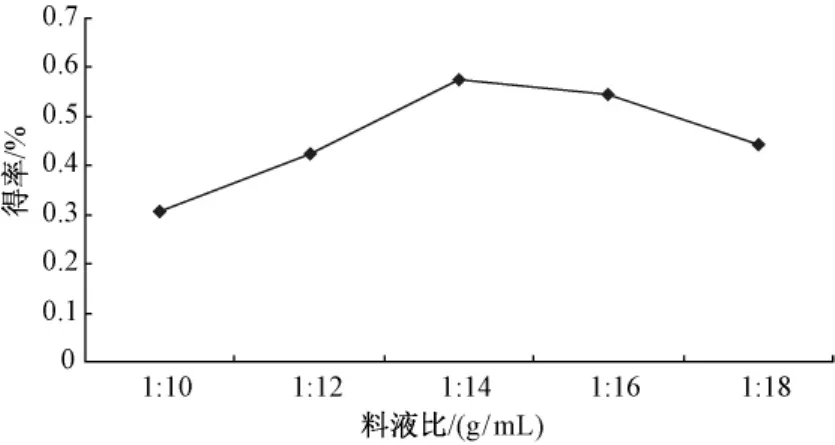
图2 料液比对聚戊烯醇得率的影响Fig.2 Effect of liquid to material ratio on yield of polyprenols
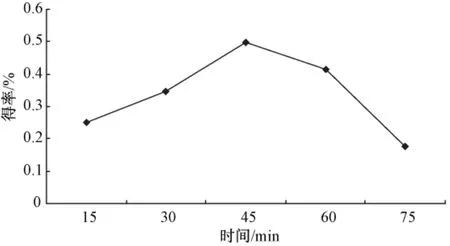
图3 超声提取时间对聚戊烯醇得率的影响Fig.3 Effect of ultrasonic extraction time onyield of polyprenols
2.1.4 温度对银杏雄株叶片聚戊烯醇得率的影响按照1.5.3项的方法考察不同超声提取温度对银杏雄株叶片聚戊烯醇得率的影响,重复3次 (n=3),结果如图4所示。由图可知,随着温度的上升,聚戊烯醇得率逐渐增大,在40℃时,聚戊烯醇得率达到最大,超过40℃聚戊烯醇得率就逐渐下降,这可能是由于温度越高,越有利于聚戊烯醇溶出,但是温度过高可能就会破坏聚戊烯醇的结构。因此,超声提取中控制温度初步确定为40℃。
2.2 银杏雄株叶片聚戊烯醇响应面法提取优化设计
以料液比、超声时间和提取温度3个因素为自变量,以聚戊烯醇得率为响应值,设计3因素3水平的实验。Box-Behnken试验设计结果见表3。
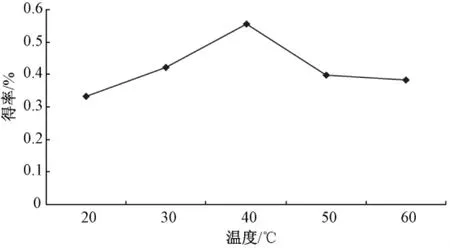
图4 超声提取温度对聚戊烯醇提取率的影响 (n=3)Fig.4 Effect of ultrasonic extraction temperature on yield of polyprenols(n=3)
2.2.1 回归分析建模 采用Design-Expert程序对所得数据进行回归分析,3个因子经过拟合得到的回归方程为:Y=1.28-0.088X1+0.29X2-0.15X3-0.37X1X2+0.12X1X3+0.056X2X3-0.31X12+0.011X22-0.4X32模型的R2=0.916 9,这说明这种实验方法是可靠的,使用该方程模拟真实的3因子3水平的分析是可行的[11-13]。
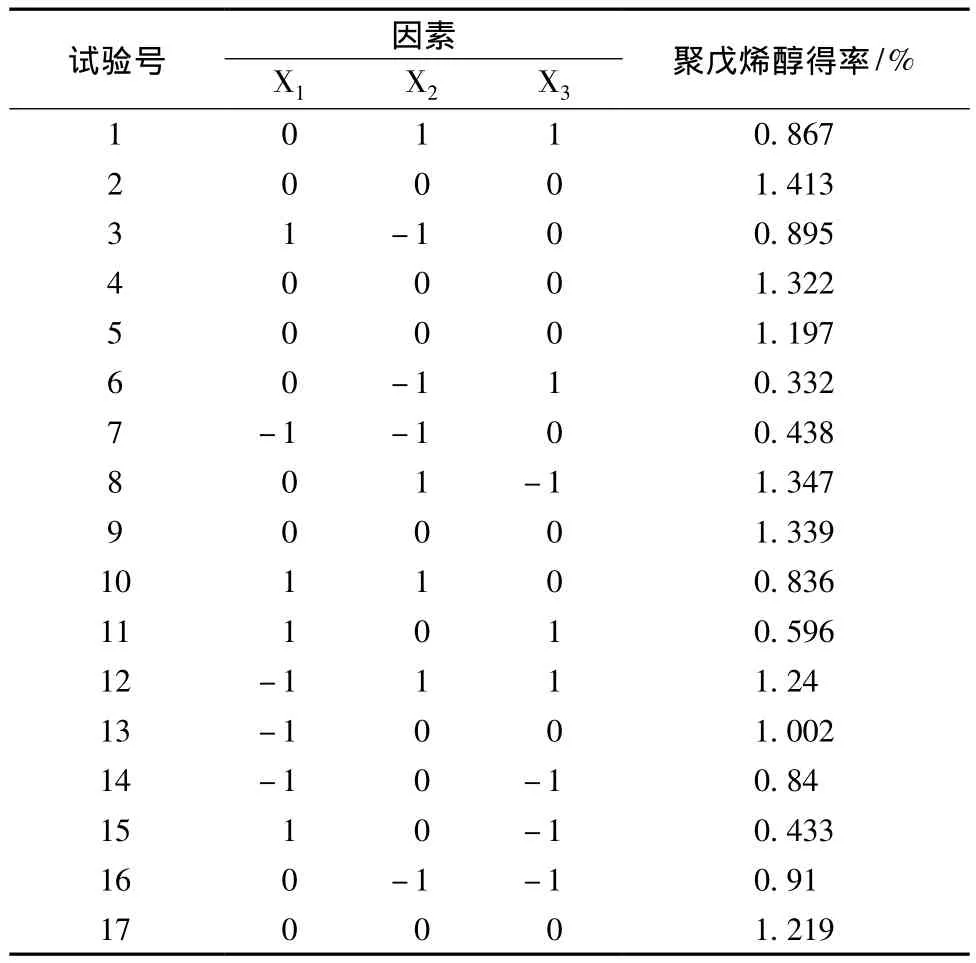
表3 Box-Behnken实验设计Tab.3 Box-Behnken experiment design
2.2.2 方差分析 对回归模型进行方差分析,试验结果见表4:模型的F值8.58表示模型是显著的,在这个模型中,X2、X3、X1X2、X12、X32对Y的影响是显著的 (P<0.05),因此,各个试验因素对响应值的影响不是简单的线性关系。
2.2.3 响应面和等值线分析 为了考察各个因子间的交互作用,对试验结果进行了3D响应面和等值线分析。发现料液比和超声温度的交互作用最大,对聚戊烯醇得率的影响极为显著;超声时间和超声温度的交互作用次之;超声时间和料液比的交互作用较小。其中反应料液比和超声温度交互作用的响应面见图5。

表4 二次回归模型方差分析Tab.4 Analysis of variance of quadratic regression model
用design-expert软件进行提取方案优化,得到最佳条件为:料液比1∶11.28、超声时间60 min、回流萃取温度37.28℃,理论最佳得率为1.772%。
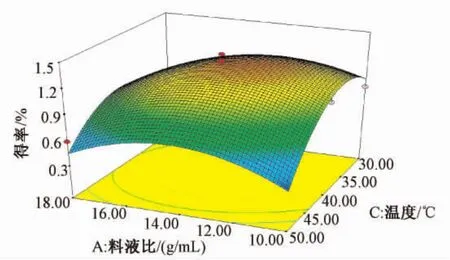
图5 响应面和等值线分析Fig.5 Analyses of Response surface and contour
2.3 最优工艺参数组合验证
为了进一步验证RSM的可靠性,综合单因素和响应面优化实验结果,考虑到实验误差,按上述最优工艺参数进行3次平行实验,同时考虑到实际操作,以液料比1∶12,超声温度38℃、超声时间60 min的条件,重复实验3次,试验结果,3组聚戊烯醇得率分别为1.653%,1.627%,1.481%,求得平均值为1.587%,与理论预测值比较误差为0.185%,因此,响应面法对银杏叶聚戊烯醇提取条件的优化是可行的,是具有实际应用价值[14,15]。
3 讨论
3.1 影响银杏雄株叶片聚戊烯醇提取的因子
影响银杏雄株叶片聚戊烯醇提取的因子有叶片处理过程中的叶片粉碎的颗粒大小,有提取过程中的超声波功率,时间,温度,有提取溶液的种类,纯度等,本研究首先对提取溶剂种类进行选择,然后根据前人的研究经验[8],选择了料液比、时间和温度三个主要影响的因子,并设计响应面实验对其进行优化,得到了在提取银杏叶聚戊烯醇过程中这三个影响因子的最佳组合。而对于其他影响因子如粉碎颗粒大小、超声波功率等还有待进一步研究。
3.2 银杏雄株叶片聚戊烯醇最佳提取工艺的关键技术
响应面设计法可以从整体的角度上确定各个影响因素的最佳组合,以达到最优的响应值。该方法已广泛应用于各种生物技术领域[11,13]。本实验采用响应面设计法对提取过程中的各因素进行了优化,得出最佳提取条件:以正己烷作为提取剂,料液比1∶12、超声时间60 min、回流萃取温度38℃,在此工艺条件下,银杏聚戊烯醇的得率为1.587%。
3.3 银杏叶不同链长聚戊烯醇的相对含有量对测定结果的影响
以往的研究结果表明,银杏叶中含有C60-C120聚戊烯醇,其中主要为 C85、C90、C95聚戊烯醇,约占82%[16]。而C85和C90就可以占到银杏叶聚戊烯醇总量的60%左右,老树叶甚至可以达到70%[17]。Bamba等也曾以其中一种聚戊烯醇为内标物,定量分析银杏叶中C85、C90、C95这3种聚戊烯醇[18-19],因此本实验以C90作为外标物,定量分析C85、C90、C95这3种聚戊烯醇的量作为银杏雄株叶片聚戊烯醇含量的指标。
[1]Kuznecovs S,Jegina K,Kuznecova G.Hepatocellular carcinoma:effect of polyprenols on P-glycoprotein accumulation in multidrug resistance[J].Gastroenterol Hepatol,2006,21(2):A211-A212.
[2]Safatov A S,Boldyrev A,Bulychev L E,et al.A prototype prophylactic anti-influenza preparation in aerosol form on the basis ofAbies sibiricapolyprenols[J].J Aerosol Med,2005,18(1):55-62.
[3]Tomas C,Karolina S,Jozefina H.Single polyprenol and dolichol isolation by semipreparative high-performance liquid chromatography technique[J].J Lipid Res,2000,41(7):1177-1180.
[4]Teresa J,Krystyna W,Tadeusz C.Modulation of properties of phospholipid membranes by the long-chain polypernol(C160)[J].Chem Phys Lipids,2000,106(1):31-40.
[5]蔡 汝,陶 俊,陈 鹏,等.银杏雌雄株叶片光和特性、蒸腾特性及产量的比较研究[J].江苏农业研究,1999,20(4):78-79.
[6]周春华,陈 鹏,陶 俊,等.银杏叶聚戊烯醇研究进展[J]. 中成药,2009,31(9):1417-1419.
[7]Tomas R,Jaroslav V.Chromatography of long chain alcohols(polyprenols)from animal and plant source[J].J Chromatogra A,2001,936(1-2):95-110.
[8]孙 磊,李春斌,白 静,等.正交设计法在银杏叶聚戊烯醇提取工艺中的应用[J].中国现代应用药学杂志,2006,23(5):361-363.
[9]Box G E P and Hunter W G.Statistics for experimerits:an introduction to design[C]//Data analysis odel building.New York:Wiley,1990.
[10]费荣昌.试验设计与数据处理 [M].无锡:江南大学出版社,2001:59-63.
[11]董 媛,朱靖宇,王虎义,等.响应面法优化蛹虫草菌丝体多糖超声波提取工艺的研究[J].时珍国医国药,2009,20(4):880-883.
[12]Kasankala L M,Xue Y,Yao W L.Optimization of gelatine extraction from grass crap(Catenopharyngodon idella)fish skin by response surface methodology[J].Bioresour Technol,2007,98(17):3338-3343.
[13]王桃云.大豆荚壳中异黄酮类化合物的提取分离、结构鉴定及其生物活性研究[D].扬州:扬州大学,2011.
[14]王振宇,李宏菊,郭庆启.响应面法对红松油提取工艺参数的优化[J].中国粮油报,2009,24(4):78-81.
[15]杨 磊,唐晓溪,赵春建,等.响应面法优选桃儿七中的鬼臼毒素的超声提取工艺[J].化工进展,2009,28(2):297-303.
[16]杨克迪,陈 钧,欧阳臻,等.高效液相色谱/大气压化学电离质谱分析银杏叶中聚戊烯醇化合物[J].分析化学,2003,31(8):937-940.
[17]王成章.银杏叶聚戊烯醇GP的分离和衍生物合成机理及生物活性研究[D].北京:中国林业科学研究院,2007.
[18]Bamba T,Fukusaki E,Nakazawa Y,et al.Analysis of longchain polyprenols using supemriticsl fluid chromatography and matrix-assisted laser desorption ionization time-of-fright mass spectrometry[J].Chromagraphy A,2003,995(1-2):203-207.
[19]Bamba T,Fukusaki E,Kajiyama S,et al.High-resolution analysis of polyprenols by supercritical fluid chromatography[J].Chromatography A,2001,911(1):l13-117.

