磁性壳聚糖微球固定化米糠内源酶的研究
张媛媛 张 晖 王 立 钱海峰 齐希光
(江南大学食品学院,江苏 无锡 214122)
谷氨酸脱羧酶(GAD)作为米糠内源酶,可以专一的催化谷氨酸或其钠盐脱羧转化为γ-氨基丁酸(GABA)。而γ-氨基丁酸作为一种重要的中枢神经系统抑制剂,具有多种重要的生理功能[1],如降血压、治癫痫、抗衰老、调节激素等。鉴于游离酶不便于重复利用,而与游离酶相比,固定化酶便于回收以重复利用,且相对容易分离,故越来越多的研究转向固定化酶。如今,固定化酶的技术迅速发展,在多个领域都得到了较为广泛的应用,如食品、医药、化工等[2,3]。磁性壳聚糖微球作为固定化酶的一种载体,现已被用于果胶酶、谷氨酰胺酶、漆酶、褐藻酸酶、乳糖酶、辣根过氧化物酶、脂肪酶等的固定化[4,5]。
关于谷氨酸脱羧酶的固定化,已有的报道[6,7]多是以海藻酸钠、壳聚糖作为载体,使得制备的GABA溶液中盐含量较高,且需离心操作,分离较繁琐,后期的纯化工作复杂,故寻找更好的固定化酶载体成为人们研究的热点。用磁性壳聚糖微球作为载体,可以利用外界磁场的作用,简单分离,重复利用,以有效的避免上述问题。然而目前还没有用磁性壳聚糖固定化谷氨酸脱羧酶的报道。
本试验以Fe3O4作为磁性内核,壳聚糖作为外壳,采用乳化交联法来制备磁性壳聚糖微球,以此为载体来固定化谷氨酸脱羧酶,并研究固定化谷氨酸脱羧酶的酶学性质,旨在寻求一种能方便有效、且成本低廉或适中的固定化谷氨酸脱羧酶的方法,为更好的利用GAD的酶活力提供相关的理论分析和数据参考。
1 材料与方法
1.1 材料与仪器
1.1.1 主要材料与试剂
新鲜米糠:无锡市苏惠米业有限公司;
Fe3O4:北京德科岛金科技有限公司;
PLP、PMSF、GABA:美国Sigma公司;
2-巯基乙醇、壳聚糖:中国医药(集团)上海化学试剂公司;
磁铁:友磁实业有限公司。
1.1.2 主要仪器设备
超低温冰箱:FORMA 702型,美国 Thermo life Sciences公司;
冷冻干燥机:LGJ-10型,北京四环科学仪器厂;
高速冷冻离心机:CR21GⅢ型,日本Hitachi Koki公司;
定时恒温磁力搅拌器:90-2型,上海沪西分析仪器厂;
傅里 叶 变 换 红 外 光 谱 仪 (Nicolet Nexus FT-IR spectrometer):470FT-IR型,美国 Thermo Electron公司;
高速台式离心机:TGL-IGC型,上海安亭科学仪器厂;
超级恒温水浴:MP-501A型,上海市实验仪器厂;
高效液相色谱仪(配有可变波长紫外检测器):Agilent 1100型,美国Agilent公司。
1.2 试验方法
1.2.1 米糠谷氨酸脱羧酶的制备 参照文献[8],以料液比1∶4(m∶V)用缓冲液在4℃下提取米糠谷氨酸脱羧酶1h。其中,缓冲液为含有2mmol/L EDTA-二钠、2mmol/L 2-巯基乙醇、1mmol/L PLP、1mmol/L PMSF 和 10% 甘 油 的0.05mol/L(pH=5.6)Na2HPO4-NaH2PO4缓冲液。采用硫酸铵沉淀法从提取液中得到谷氨酸脱羧酶,之后在标准缓冲液中透析至无NH+4,冷冻干燥后冻藏备用。
1.2.2 米糠谷氨酸脱羧酶活性的测定 用0.05mol/L(pH=5.6)PBS缓冲液对谷氨酸脱羧酶进行复溶,制备蛋白含量约为1mg/mL的酶液,加入0.05mol/L谷氨酸钠作为底物,40℃下反应2h,在90℃下灭酶5min,离心取上清液测定产物GABA的含量。其中GABA含量用高效液相色谱法[9]测定。以每30min生成1μmol的GABA作为一个酶活力单位。
1.2.3 米糠谷氨酸脱羧酶活力回收率的计算

1.2.4 磁性壳聚糖的制备及表征 参考文献[10],取0.5g Fe3O4微粒与20mL 2.5%壳聚糖乙酸溶液混合,超声使其充分混匀,然后在搅拌下缓慢加入到80mL液体石蜡和4mL Span-80混合溶液中,常温搅拌30min后,加入10mL 8%戊二醛,40℃恒温水浴中搅拌1h,用1mol/L氢氧化钠溶液将pH调至9~10,70℃恒温水浴中继续搅拌2h,用磁铁吸出微球,并先后用石油醚、丙酮、蒸馏水反复洗涤,冷冻干燥得到磁性壳聚糖微球。采用激光粒度分析仪来测定磁性微球的粒径,而采用KBr粉末压片,用红外光谱仪测定其官能团的特征吸收。
1.2.5 磁性微球固定化米糠谷氨酸脱羧酶的基本方法 取0.05g制备的磁性壳聚糖微球,加入到25mL锥形瓶中,用不同pH的磷酸盐缓冲液溶胀过夜,加入一定浓度的戊二醛溶液进行交联,用磁铁吸出磁性壳聚糖微球,用磷酸盐缓冲液清洗至检测不出戊二醛。加入一定浓度的谷氨酸脱羧酶液,在4℃下固定一定时间,用磁铁吸出磁性壳聚糖微球后,再用磷酸盐缓冲液将微球充分洗涤。得到的固定化谷氨酸脱羧酶于4℃下保存备用。
1.2.6 磁性微球固定化米糠谷氨酸脱羧酶的条件优化研究
(1)缓冲液pH:控制戊二醛浓度为2%,交联时间为4h,固定时间为3h,考察pH 为4.8,5.2,5.6,6.0,6.4时的酶活力回收率。
(2)戊二醛浓度:控制缓冲液pH为5.6,交联时间为4h,固定时间为3h,考察戊二醛浓度为 1.0%,1.5%,2.0%,2.5%,3.0%时的酶活力回收率。
(3)交联时间:控制缓冲液pH为5.6,戊二醛浓度为2%,固定时间为3h,考察交联时间为2,3,4,5,6h时的酶活力回收率。
(4)固定时间:控制缓冲液pH为5.6,戊二醛浓度为2%,交联时间为4h,考察固定时间为1,2,3,4,5h时的酶活力回收率。
(5)正交试验:以单因素试验的研究结果为基础,设计L9(34)正交试验。
1.2.7 固定化米糠谷氨酸脱羧酶的酶学性质研究
(1)最适温度:取等量的游离和固定化谷氨酸脱羧酶,加入含有底物的PBS缓冲液中,于30,35,40,45,50℃下100r/min水浴振荡制备GABA。
(2)热稳定性:取等量的游离和固定化谷氨酸脱羧酶,浸泡在PBS缓冲液中,在30,35,40,45,50,55,60,65,70 ℃精确保温30min后,取出后迅速冷却至室温,换入新的含底物的PBS缓冲液,游离酶于40℃、固定化酶于45℃下100r/min水浴振荡制备GABA。
(3)最适pH:取等量的游离和固定化谷氨酸脱羧酶,加入含有底物的pH 为4.8,5.2,5.6,6.0,6.4的 PBS缓冲液中,于最适温度下100r/min水浴振荡制备GABA。
(4)pH稳定性:取等量的固定化谷氨酸脱羧酶,分别加入pH 为4.8,5.2,5.6,6.0,6.4的 PBS缓冲液中于4℃冰箱里放置24h,取出后对微球进行清洗,换入新的含有底物的PBS缓冲液,于45℃下100r/min水浴振荡制备GABA。
(5)操作稳定性:取固定化谷氨酸脱羧酶,加入含有底物的PBS缓冲液中,于45℃下100r/min水浴振荡制备GABA。15h后取出微球,换入新的含有底物的PBS缓冲液,继续反应直至酶活力为零。
(6)贮藏稳定性:每天取等量的固定化谷氨酸脱羧酶,加入含有底物的PBS缓冲液中,于45℃下100r/min水浴振荡制备GABA。
2 结果与讨论
2.1 磁性壳聚糖的表征
图1是壳聚糖和磁性壳聚糖微球的红外光谱图。壳聚糖图谱在3 430cm-1处有红外吸收峰,这是-NH2和-OH的伸缩振动,在2 870cm-1和2 930cm-1处有脂肪族C-H的伸缩振动吸收,在1 090cm-1处有C-O的伸缩振动吸收。与壳聚糖图谱相比,磁性壳聚糖微球图谱虽响应值有所变化,但壳聚糖的特征吸收峰都得到了保留,而且在3 430cm-1处的吸收峰较宽,这表明在磁性壳聚糖微球中存在着增强的氢键作用,而在573cm-1出的红外吸收峰应是磁性内核的Fe-O特征吸收峰,从而表明Fe3O4和壳聚糖之间存在着分子间的相互作用,因此认为壳聚糖和磁性微球的乳化交联是成功的。

图1 壳聚糖和磁性壳聚糖微球的红外光谱图Figure 1 Infrared Spectroscopy result of chitosan and magnetic chitosan microspheres
2.2 固定化米糠谷氨酸脱羧酶的条件优化
考察了缓冲液pH、戊二醛浓度、交联时间和固定时间4个因素对谷氨酸脱羧酶的固定化影响,根据单因素试验结果,得到的正交试验因素水平取值见表1,试验设计及结果见表2。由表2可知,各因素对于酶活力回收率的影响顺序为A>C>D>B,谷氨酸脱羧酶固定化的最优条件为A2B2C1D3,即pH为5.2,戊二醛浓度为1.5%,交联时间为4h,固定时间为5h。以此条件进行验证实验,得到酶活力回收率为39.41%。

表1 谷氨酸脱羧酶的固定化条件正交试验因素水平表Table 1 Factors-levels of the orthogonal test for immobilization of GAD
2.3 固定化米糠谷氨酸脱羧酶的酶学性质
2.3.1 固定化米糠谷氨酸脱羧酶的最适温度 由图2可知,固定化谷氨酸脱羧酶的最适温度由游离时的40℃向右偏移到45℃,这是因为谷氨酸脱羧酶在固定化后,载体存在着一定的传质阻力,而底物需要更多的能量来与谷氨酸脱羧酶结合,从而增强了酶的耐热性。而后继续升高反应温度时,谷氨酸脱羧酶会发生部分变性失活,从而使酶活力下降。

表2 谷氨酸脱羧固定化条件正交试验结果Table 2 Results of the orthogonal test for immobilization of glutamate decarboxylase

图2 温度对游离及固定化的谷氨酸脱羧酶活力的影响Figure 2 Effect of temperature on the activities of free and immobilized glutamate decarboxylase
2.3.2 固定化米糠谷氨酸脱羧酶的热稳定性研究 由图3可知,当处理温度低于45℃时,随着处理温度的升高,游离酶和固定化酶的酶活力回收率都增大。这与前人的研究结果[11]——当植物受到外界的刺激,比如温度升高时,体内谷氨酸脱羧酶活力会有所提升相一致。而随着温度继续升高,由于谷氨酸脱羧酶发生部分热变性,即便之后在相同的温度下制备GABA,其酶活力都相应的逐渐降低。
2.3.3 固定化米糠谷氨酸脱羧酶的最适pH 由图4可知,游离酶的最适pH为5.6,而固定化后,酶的最适pH向左移动至5.2,这可能是因为磁性壳聚糖微球表面的带电基团与谷氨酸脱羧酶的结合,导致其微环境遭到改变,从而影响了固定化谷氨酸脱羧酶的最适pH,使其更适合酸性环境,这样可以相对减少在制备GABA的过程中微生物对反应的影响。
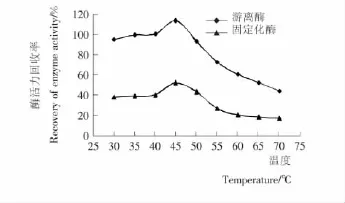
图3 不同温度处理对游离及固定化的谷氨酸脱羧酶活力的影响Figure 3 Effect of different temperature treatment on the activities of free and immobilized glutamate decarboxylase
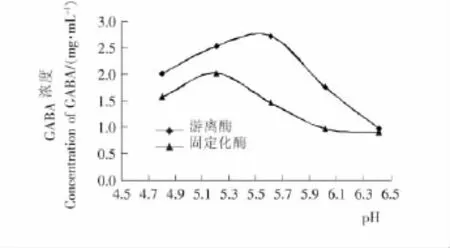
图4 pH对游离及固定化的谷氨酸脱羧酶活力的影响Figure 4 Effect of pH on the activities of free and immobilized glutamate decarboxylase
2.3.4 固定化米糠谷氨酸脱羧酶的pH稳定性研究 由图5可知,游离谷氨酸脱羧酶随着处理pH值的增大,其酶活力回收率有先增大后降低的趋势,而固定化后其酶活力回收率一直降低,这说明固定化后谷氨酸脱羧酶的耐酸能力变强。这可能是因为磁性壳聚糖微球作为固定化的载体,能为谷氨酸脱羧酶营造一个较为稳定的微观环境,且壳聚糖带有大量的氨基和羧基等基团,对酸和碱有一定的缓冲作用,两方面的共同作用使固定化谷氨酸脱羧酶的耐酸能力增强。

图5 不同pH处理对固定化谷氨酸脱羧酶活力影响Figure 5 Effect of different pH treatment on the activities of immobilized glutamate decarboxylase
2.3.5 固定化米糠谷氨酸脱羧酶的操作稳定性研究 由图6可知,固定化谷氨酸脱羧酶活力的衰减速度较快,其半衰期约为50h,与王筱婧等[12]用海藻酸钠固定化米糠中谷氨酸脱羧酶的半衰期结果相一致。这可能是因为在每次反应结束后的清洗过程中,容易造成酶活力的损失。因此可适当增加每次反应的时间,或者进行连续反应,以最大程度的利用固定化谷氨酸脱羧酶。

图6 固定化谷氨酸脱羧酶的操作稳定性Figure 6 Operation stability of immobilized glutamate decarboxylase
2.3.6 固定化米糠谷氨酸脱羧酶的贮藏稳定性研究 对固定化谷氨酸脱羧酶的贮藏稳定性进行了研究,由图7可知,固定化谷氨酸脱羧酶在经过30d的贮藏后,其酶活力回收率依旧能保持在原来的70%左右。这说明经过固定化后,谷氨酸脱羧酶在低温(4℃)贮藏的状态下,其酶活力稳定性能保持较高水平。
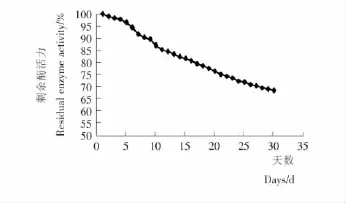
图7 固定化谷氨酸脱羧酶的贮藏稳定性Figure 7 Storage stability of immobilized glutamate decarboxylase
3 结论
本试验考察了磁性壳聚糖微球固定谷氨酸脱羧酶时缓冲液pH、戊二醛浓度、交联时间和固定时间等因素对固定化效果的影响。研究得到固定谷氨酸脱羧酶的最优条件:在pH为5.2的缓冲液中充分溶胀后,加入1.5%的戊二醛溶液交联3h后,加入酶液固定4h,得到固定化酶活力回收率为39.41%。通过对固定化酶的酶学性质的研究,得到固定化后,谷氨酸脱羧酶的耐酸性和耐热性得到了提高,贮藏稳定性也能在一定时间内保持较高水平。
本法较之前的固定方法,制备工艺简单,具备工业化应用的前景;且固定化酶在制备GABA时能简单分离,方便重复利用,后期的纯化工艺也相对简单。但要连续反应需进一步研究其再生方法,从而进一步提高酶的催化反应效率。
1 管娜娜.利用米糠内源酶生物转化生产γ-氨基丁酸及纯化研究[D].无锡:江南大学,2010.
2 张黎黎,隆泉,付仁春,等.微胶囊固定化酶的制备及应用[J].云南大学学报(自然科学版),2003(S1):246~250.
3 毛跟年,李丽维,齐凤.固定化酶应用研究进展[J].中国酿造,2009(8):17~20.
4 刘颖,王鑫,岳文静,等.磁性壳聚糖固定化转谷氨酰胺酶的研究[J].现代食品科技,2011(9):1 081~1 083.
5 纵伟,刘艳芳,赵光远.磁性壳聚糖微球固定化脂肪酶的研究[J].食品与机械,2008(1):13~15.
6 乔春楠,刘萍,孙君社.海藻酸钠法固定化谷氨酸脱羧酶的研究[J].中国生化药物杂志,2008(1):16~18.
7 姜启兴,何莎,张可,等.影响壳聚糖固定化谷氨酸脱羧酶的因素[J].食品与机械,2010(5):15~18.
8 张晖.米胚谷氨酸脱羧酶性质及其富集γ-氨基丁酸研究[D].无锡:江南大学,2004.
9 马晓博.利用米糠谷氨酸脱羧酶富集γ-氨基丁酸及其分离与纯化[D].无锡:江南大学,2008.
10 龙胜亚.磁性壳聚糖微球的制备及其在漆酶固定化中的应用[D].武汉:武汉理工大学,2005.
11 Scott-Taggart C P,Van Cauwenberghe O R,Mclean M D,et al.Regulation ofγ-aminobutyric acid synthesis in situ by glutamate availability[J].Physiologia Plantarum,1999,106(4):363~369.
12 王筱婧,王立,马晓博,等.利用海藻酸钠固定化米糠制备γ-氨基丁酸的研究[J].食品工业科技,2009(4):222~224.

