琼脂糖凝胶电泳、毛细管电泳及高分辨熔解曲线技术在α-地中海贫血新生儿筛查中的应用
唐海深 满婷婷 江陵 张金云 李东至
(1.中山市博爱医院 产前诊断中心,广东 中山 528400;2.清远市人民医院 产前诊断中心,广东 清远 511518;3.广州市妇女儿童医疗中心 产前诊断中心,广东 广州 510623)
α-地中海贫血(简称α-地贫)是由于α-珠蛋白基因缺失或突变使α-珠蛋白链的合成受到部分或完全抑制而引起的遗传性溶血性贫血。临床上分为静止型、标准型、Hb H病和血红蛋白Bart′s胎儿水肿综合征4种类型,其分子机制分别为1、2、3、4个α基因缺陷(缺失或突变)。血红蛋白Bart′s胎儿水肿综合征(主要由—SEA纯合子引起),胎儿一般在妊娠23~38周或出生后数小时死亡。因此在α-地贫高危地区进行人群筛查,是识别高危人群、预防重型地贫患儿出生的重要手段。正常胎儿和新生儿的血红蛋白成分主要是 HbF(α2γ2),若α-珠蛋白链减少或缺乏会导致γ-珠蛋白链的相对增多,聚合成Hb Bart′s(γ4),因此,脐血中 Hb Bart′s与α-地贫直接相关。目前应用较多的Hb Bart′s检测方法有:琼脂糖凝胶电泳、高效液相色谱法和毛细管电泳。本文同时应用毛细管电泳与琼脂糖凝胶电泳筛查新生儿α-地贫,比较2种方法的价值。此外,本研究通过采用HRM技术筛查3种常见非缺失型α-地贫以探讨该技术的实用价值。
1 资料和方法
1.1 研究对象 2010年6~12月在清远市人民医院产科分娩的1442例新生儿。
1.2 标本采集 新生儿分娩断脐后,从胎盘端脐带抽吸2ml脐带血,放入EDTA.K2抗凝管,用于血红蛋白电泳及地贫基因检测。
1.3 琼脂糖凝胶电泳Hb Bart′s定量 采用美国Helena Laboratories公司的电泳仪进行脐带血琼脂凝胶Hb电泳分析,经染色后在Optiscan光密度扫描仪上进行区带扫描定量。
1.4 毛细管电泳Hb Bart′s定量 脐血样品先3000转离心3分钟,取18μl血细胞溶于90μl的溶血素中充分混匀后上机检测。采用法国Sebia公司Capillarys 2全自动毛细管电泳仪及配套试剂,在9.8 k V电压、p H 9.4的碱性缓冲液条件下,在石英毛细管内进行血红蛋白电泳,用415 nm波长检测各种血红蛋白的百分比,从而定量Hb Bart′s。电泳图谱分成15个区:不同的血红蛋白峰出现在特定的区域内:Hb A2=Z3,Hb F=Z7,Hb A=Z9,Hb Bart's=Z12,Hb H=Z15[1,2]。
1.5 基因分型
1.5.1 DNA提取 收集任意一种电泳方法筛查Hb Bart′s阳性的样本,用富士quick genemini80DNA提取仪,按DNA提取试剂盒使用说明,提取新生儿脐血中白细胞的全基因组DNA。
1.5.2 gap-PCR技术检测3种常见缺失型α-地贫基因 采用gap-PCR技术检测所有Hb Bart′s阳性样本的3种常见缺失型α-地贫基因(—SEA、-α3.7、-α4.2)[3]。
1.5.3 HRM技术筛查α-基因的第三外显子 从UCSC基因组数据库(http://genome.ucsc.edu)获得α-珠蛋白基因的DNA序列。用LightScanner Primer Design Software设计一对引物(正向引物:5′-CCGCACTGACCCTCTTCTCT-3′,反 向 引 物:5′-GCAACCGAGGCTCCAGC-3′)。挑出 gap-PCR技术未检测出异常的Hb Bart′s阳性样本DNA,同时选取2例基因型分别为αCSα/αα和αQSα/αα的阳性对照样本及16例基因测序验证为第三外显子无突变的阴性对照样本DNA,利用96孔板,加入1×LC Greens Plus,扩增α-基因(包含α1-和α2-基因)的第三外显子,PCR扩增片段长度为172 bp。PCR扩增完成后,将96孔板移至LightScanner(Idaho Technology)进行熔解曲线分析[4]。
1.5.4 用反向点杂交(RDB)技术检测3种常见非缺失型α-地贫基因 对gap-PCR未检出异常的样本,用HRM技术筛查后,应用反向点杂交 (RDB)技术检测3种常见非缺失型α-地贫基因(Hb CS、Hb QS和 Hb WS)[5]。
1.5.5 直接测序法检测检测α1-和α2-基因全长从 UCSC数据库(http://genome.ucsc.edu)中获取α-珠蛋白基因(α1-和α2-基因)的 DNA 序列,应用LightScanner Primer Design软件设计2对引物,分别扩增α1-和α2-珠蛋白基因(包含3个外显子及部分上游和下游序列),引物序列详见表1。对于未知基因型的Hb Bart′s阳性样品,用PCR产物直接测序法检测α1-和α2-基因的全长。
1.5.6 统计 采用SPSS 16.0软件进行统计学处理,计量数据以“均数±标准差”表示,均数的比较采用t检验,P<0.05认为差异有统计学意义。

表1 α-珠蛋白基因全长测序所用的引物
2 结 果
2.1 α-地贫基因的携带率 本研究共筛查1442例新生儿,经基因分析,167例明确了α-地贫基因型(包括165例杂合子、2例双重杂合子),即本研究中共检出α-地贫等位基因169个,人群基因携带率为11.72%(169/1442)。
2.2 α-地贫等位基因的组成 169个α-地贫等位基因中东南亚缺失型(—SEA)112例,占总体的66.3%(112/169);3种常见的缺失型(—SEA、-α3.7、-α4.2)占94.1%(159/169);东南亚缺失型(—SEA)占3种常见缺失型的70.4%(112/159);非缺失型α-地贫基因也有相当的比重(αCSα、αQSα和 αWSα占5.9%),以αCSα、αQSα为主。
2.3 Hb Bart′s含量与α-地贫基因型的关系1442例新生儿脐血样本中,2种电泳方法Hb Bart′s均为阳性的样本151例(琼脂糖凝胶电泳Hb Bart′s含量为0.5%~18.6%,毛细管电泳Hb Bart′s含量为0.1%~21.6%),基因确诊150例。4例琼脂糖凝胶电泳检测 Hb Bart′s阳性(Hb Bart′s含量0.8%~2.57%),而毛细管电泳检测Hb Bart′s阴性的样本,基因检测未见异常。7例琼脂糖凝胶电泳检测Hb Bart′s阴性而毛细管电泳检测Hb Bart′s阳性的样本(毛细管电泳Hb Bart′s含量0.1%~0.9%),基因检测均为静止型α-地贫。剩余1280例2种电泳Hb Bart′s均为阴性的样本进行2种常见静止型α地贫基因(-α3.7、-α4.2)的分子筛查,查出8例-α3.7/αα,2例-α4.2/αα。2种电泳方法筛查,脐血Hb Bart′s的含量均随着α-基因缺陷(缺失或突变)的个数的增加而升高,Hb H病(3个α-基因缺陷)高于α0-地贫(2个α-基因缺陷)及α+-地贫(1个α-基因缺陷),α0-地贫高于α+-地贫。α+-地贫中,不同基因型的 Hb Bart′s水平亦存在差异,αCSα/αα高于其它基因型。详见表2。

表2 151例2种电泳方法Hb Bart′s均为阳性的样本基因诊断结果
2.4 2种电泳方法的筛查特异性比较 151例2种电泳方法Hb Bart′s均为阳性的样本,基因确诊150例。4例琼脂糖凝胶电泳检测Hb Bart′s阳性而毛细管电泳检测Hb Bart′s阴性的样本,基因检测未见异常;7例琼脂糖凝胶电泳检测Hb Bart′s阴性而毛细管电泳检测Hb Bart′s阳性的样本,基因检测均为静止型α-地贫,见表3。剩余1280例2种电泳Hb Bart′s均为阴性的样本进行2种常见静止型α地贫基因(-α3.7、-α4.2)的分子筛查,查出8例-α3.7/αα,2例-α4.2/αα,见表4。

表3 11例仅一种电泳方法Hb Bart′s阳性的样本基因诊断结果

表4 1280例2种电泳方法Hb Bart′s均为阴性的样本基因诊断结果
2.5 HRM技术的敏感性及特异性 Hb Bart′s阳性,gap-PCR技术未检出异常的样本共15例,2例基因型分别为αCSα/αα和αQSα/αα的阳性对照及12例基因测序验证为第三外显子无突变的阴性对照样本,总共29例,全部扩增成功,并获得HRM熔解曲线(图1)。29例样本共形成4簇明曲线:7例与已知基因型为αCSα/αα样本曲线集成一簇的待测样本基因确诊为αCSα/αα;3例与已知基因型为αQSα/αα样本曲线集成一簇的待测样本基因确诊为αQSα/αα;单独成一簇曲线与正常样本分开的1例待测样本基因确诊为αWSα/αα;5例与正常样本集成一簇的待测样本,DNA测序第三外显子未见突变。
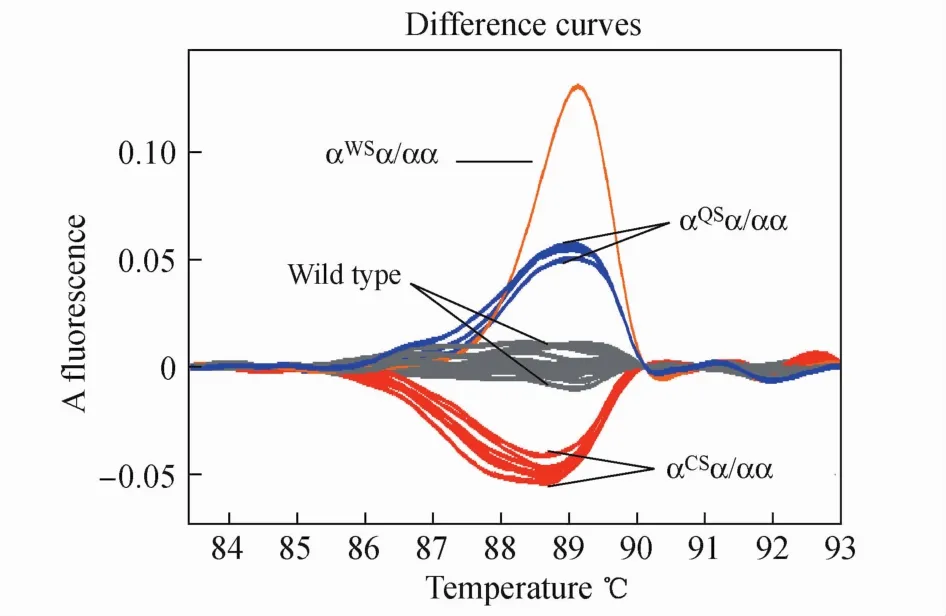
图1 HRM技术筛查α-基因第三外显子的结果图
3 讨 论
人在不同发育时期血红蛋白组成不同,正常胎儿和新生儿的血红蛋白成分主要是 Hb F(α2γ2);成人期血红蛋白组成为:Hb A(α2β2):96.5%~97.5%,Hb A2(α2δ2):2.5% ~3.5%,Hb F(α2γ2):0~1.0%。若α-珠蛋白链减少或缺乏会导致γ-珠蛋白链的相对增多,未与α-链结合的γ-链聚合成 Hb Bart′s(γ4)。因此,脐血中 Hb Bart′s与α-地贫直接相关。由于Hb Bart′s于出生3~6个月后即消失,理论上α-地贫的筛查最适合于新生儿期进行,以降低漏检率。本研究显示,清远市户籍人群总基因携带率达11.72%,高于广东省的平均水平8.53%[6]。其中以缺失型α-地贫1基因(—SEA)为主(66.3%),突变型α-地贫基因也有相当的比重(αCSα、αQSα和αWSα占5.9%)。
近年来,随着全自动毛细管电泳技术的发展,克服了传统电泳技术的缺点。毛细管电泳在操作方便性、操作时间、少试剂耗材、解析能力、检测重复性及检测成果清晰度均大大优于琼脂糖凝胶电泳,分离、定量 Hb Bart′s更加简单、准确[2]。本研究1442例样本中,151例2种电泳方法Hb Bart′s均为阳性的样本,基因确诊150例。对于4例琼脂糖凝胶电泳检测Hb Bart′s阳性而毛细管电泳检测Hb Bart′s阴性的样本,基因检测未见异常。7例琼脂糖凝胶电泳检测Hb Bart′s阴性而毛细管电泳检测Hb Bart′s阳性的样本,基因检测均为静止型α-地贫。1280例两种电泳Hb Bart′s均为阴性的样本进行2种常见静止型α地贫基因(-α3.7、-α4.2)的分子筛查,查出8例-α3.7/αα,2例-α4.2/αα。可见,毛细管电泳分离定量Hb Bart′s的灵敏度及特异度均大于琼脂糖凝胶电泳。因此,全自动毛细管电泳技术分离定量 Hb Bart′s具有简便、高效、准确的特点,在α-地贫高发地区,该技术应常规应用于新生儿α-地贫筛查,以减少出生缺陷,提高人口素质。
脐血Hb Bart′s的含量与α-基因缺陷(缺失或突变)的个数呈正相关。本研究显示,毛细管电泳Hb Bart′s定量,α0-地贫的 Hb Bart′s的含量均大于1%,Hb H 病的 Hb Bart′s含量更高。而α+-地贫中,除基因型为αCSα/αα的样本 Hb Bart′s含量均大于1%以外,其他类型的α+-地贫携带者Hb Bart′s含量均小于1%,其中-α3.7/αα携带者的 Hb Bart′s含量最低为0.1%。1280例2种电泳Hb Bart′s均为阴性的样本检出8例-α3.7/αα,2例-α4.2/αα。因此以脐血Hb Bart′s阳性为指标,对新生儿进行α-地贫筛查,能较准确地筛查出Hb H病、α0地贫及αCSα/αα,但是,Hb Bart′s水平不宜作为αCSα以外的α+-地贫的筛查指标。然而随着电泳技术的不断发展,静止型α-地贫的检出率逐步提高。
本研究中,尚有1例毛细管电泳Hb Bart′s阳性的样本未知基因型(Hb Bart′s含量为0.30%),可能的原因有:已有研究发现,中国人群中存在-α2..7缺失,累及α1-基因,本研究只检测了-α3.7和-α4.2两种缺失型α+-地贫,有可能存在罕见的缺失型α+-地贫未检测到[7];存在直接测序法检测α1-和α2-基因全长无法检测到的,影响α基因表达的上游突变;该峰为Z12区段非Hb Bart′s的异常血红蛋白。
Munkongdee T等[1]对587例泰国新生儿脐血进行毛细管电泳电泳Hb Bart′s定量筛查α-地贫,研究显示:缺失1、2、3个α-基因的α-地贫携带者,其脐血Hb Bart′s含量分别为0.5%±0.2%、4.6%±0.5%、20.1%;该研究还显示,正常人与α+n-地贫携带者之间的Hb Bart′s含量相互重叠、不能区分,以Hb Bart′s含量0.2%为界,区分正常人与α+-地贫携带者的效率最高。何晓玲等[8],亦用毛细管电泳电泳技术定量Hb Bart′s的方法筛查中山市新生儿的α-地贫。本研究结果中Hb Bart′s的含量与基因缺陷个数的关系与Munkongdee T及何晓玲的研究相符,但是,本研究以Hb Bart′s含量0.1%为界,区分正常人与α-地贫携带者,Hb Bart′s阳性样本151例,缺失型α+-地贫只检测了-α3.7和-α4.2两种基因型,即有150例经基因分析确诊为α-地贫,另外1例Hb Bart′s阳性的样品仍然可能存在未检测到的α-基因缺陷。因此,我们认为将新生儿脐血毛细管电泳Hb Bart′s含量0.1%作为区分正常人与α-地贫携带者的指标更为理想。
与缺失型Hb H病相比,非缺失型Hb H病临床表现更为严重,更有αQSα/αQSα及—SEA/αQSα能引起水肿胎的报道[9,10]。因此筛查Hb CS和Hb QS有利遗传咨询指导婚姻,对优生优育具有十分重要的意义。本研究显示,HRM技术筛查非缺失型α-地贫的敏感性和特异性亦均达100%,结果与陆林苑等[4]的研究相符。由于PCR扩增和HRM分析整个过程用时不超过2小时,HRM分析法与普通PCR相比,只需在PCR反应体系中多加1种DNA饱和荧光染料,每个样本的试剂费用不超过2元。因此,HRM技术可作为非缺失型α-地贫(尤其是αCSα和αQSα)的一种筛查方法,且具有准确、高效、低成本的优点。
[1]Munkongdee T,Pichanun D,Butthep P,et al.Quantitative analysis of Hb Bart's in cord blood by capillary electrophoresis system[J].Ann Hematol,2011,90(7):741-746.
[2]Keren DF,Hedstrom D,Gulbranson R,et al.Comparison of Sebia Capillarys capillary electrophoresis with the Primus high-pressure liquid chromatography in the evaluation of hemoglobinopathies[J].Am J Clin Pathol,2008,130(5):824-831.
[3]李志玖,郑芳,燕平,等.跨越断裂位点PCR检测α-地中海贫血基因缺失[J].郧阳医学院学报,2009,28(5):451-452,456.
[4]陆林苑,唐海深,李东至.高分辨率熔解曲线分析技术在非缺失型α-地中海贫血新生儿筛查中的前瞻性应用[J].中国妇幼保健,2013,28(1):156-159.
[5]郭广洲,陈延娥,廖生赟,等.应用反向点杂交法检测α-地中海贫血点突变[J].热带医学杂志,2008(8):785-787.
[6]Xu XM,Zhou YQ,Luo GX,et al.The prevalence and spectrum of alpha and beta thalassaemia in Guangdong Province:implications for the future health burden and population screening[J].J Clin Pathol,2004,57(5):517-522.
[7]张俊武,龙桂芳.血红蛋白与血红蛋白病[M].南宁:广西科学技术出版社,2003:212-215.
[8]何晓玲,张翠梅,冯华俊.中山市α-地中海贫血的新生儿筛查[J].右江民族医学院学报,2010,32(4):488-490.
[9]Liao C,Li J,Li DZ.Fetal anemia and hydrops associated with homozygosity for hemoglobin Quong Sze[J].Prenat Diagn,2008,28(9):862-864.
[10]Li DZ,Liao C,Li J,et al.Hemoglobin H hydrops fetalis syndrome resulting from the association of the—SEAdeletion and the alpha Quong Szealpha mutation in a Chinese woman[J].Eur J Haematol,2005,75(3):259-261.

