可视化微孔板芯片检测结核分枝杆菌利福平及异烟肼耐药性研究
李永进,欧青叶,刘春晓,史 蕾,赵纯中,古莉冰,徐云庆,顾大勇
(1.长江大学生命科学学院,湖北 荆州 434025;2.深圳出入境检验检疫局,广东 深圳 518045)
结核分枝杆菌耐药性测定对有效指导临床用药、提高疗效、控制耐药结核病的传播具有重要意义[1]。目前,虽然有很多方法用于耐药性测定,但大都耗时较长,如耐药表型鉴定方法需要4~6周,因此开发快速、简便、准确的检测方法尤为必要。基因芯片是一种高通量的分析平台,将其应用于结核分枝杆菌耐药性检测已有很多相关的文献报道[2-4]。然而目前的基因芯片技术主要以荧光检测为主,单张芯片的样本通量低[5-7]。本研究采用微孔板芯片,根据利福平和异烟肼耐药与基因突变有关的分子机制,制备检测突变位点的基因芯片。该芯片检测的阳性结果在芯片表面直接以色点呈现,结果既可直接以裸眼观察,也可配套灰度扫描仪扫描分析。
材料和方法
一、材料
1.测试菌株及样本 所有测试耐药性菌株均由深圳口岸医院提供,耐药性菌株均经过绝对浓度法药物敏感性试验证实。
2.芯片制作、检测设备及配套试剂 微孔板芯片(N3 CHIP)、探针制备仪、灰度扫描仪均为台湾晶宇生物科技实业股份有限公司产品。探针、引物均由Invitrogen(广州)公司合成。其他试剂均为分析纯。
二、方法
1.引物、探针设计合成 针对利福平及异烟肼耐药相关的主要基因(rpoB、katG、inhA、ahpC)及结核分枝杆菌复合菌群设计5对引物,引物5'端以生物素标记,同时针对不同基因的高频率突变位点设计探针。本研究中所用的探针及其在芯片的位置、引物分别见表1、表2。
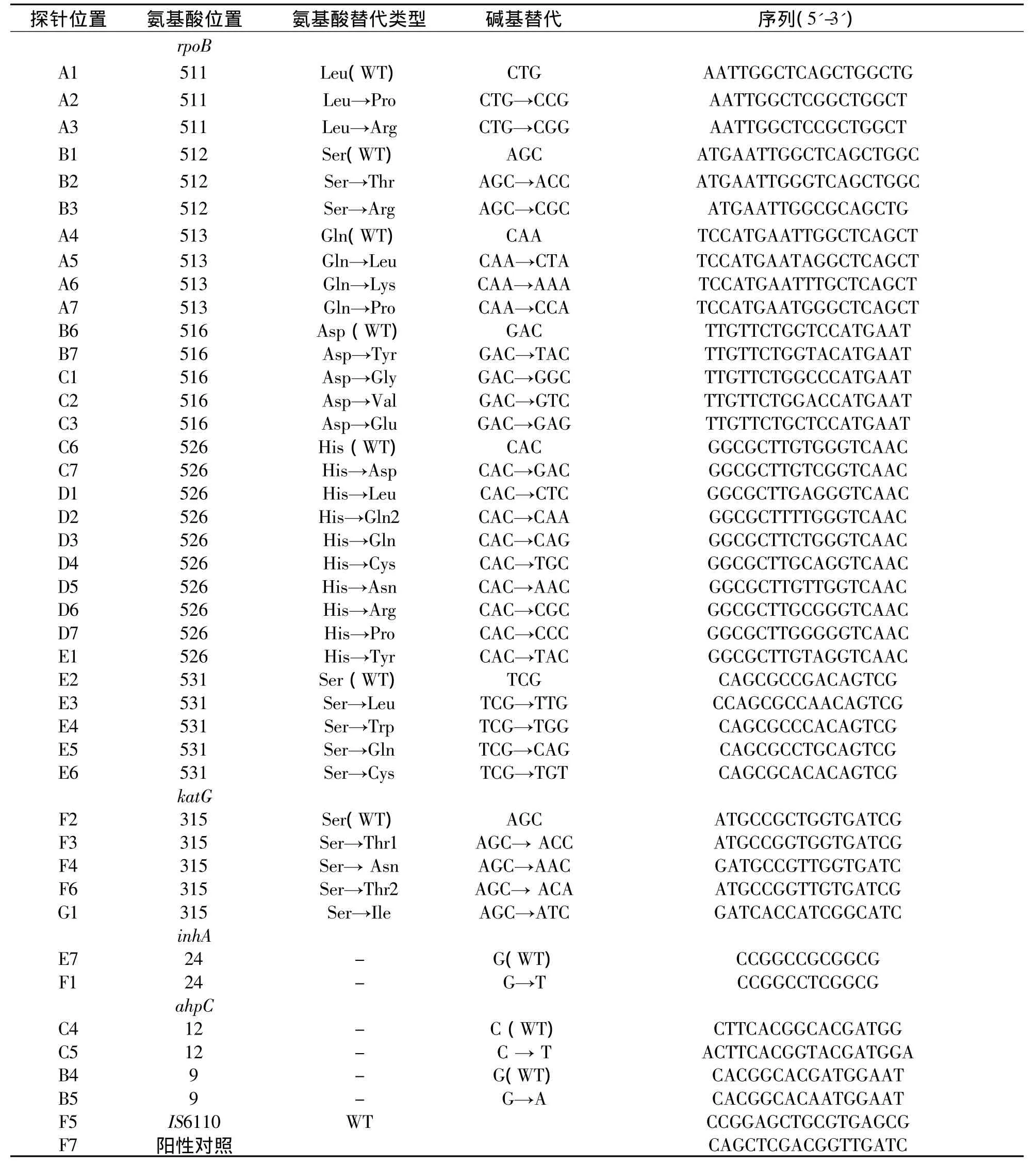
表1 本研究所使用的探针序列及其在芯片上的位置分布
2.DNA制备 耐药菌株的DNA制备过程如下:挑取结核分枝杆菌菌落1~2个于0.5 mL三羟甲基氨基甲烷-乙二胺四乙酸(Tris-elhylene diamine tetraacetic acid,TE)缓冲液 (10 mmol/L Tris-HCl,1 mmol/L 乙二胺四乙酸,pH 值 8.0)中重悬,12000×g 4℃离心10 min。沉淀于含有Triton X-100(1%v/v)的30 μL TE缓冲液中重悬,并于95℃孵育30 min。提取物冰上冷却,12000×g离心10 min。上清液2 μL分装用于后续的聚合酶链反应(polymerase chain reaction,PCR)扩增。

表2 本研究所使用的引物序列信息
3.芯片制备 N3微孔板空白芯片采用超声波法清洗,再用超纯水反复冲洗3次后,吹干备用。利用探针制备仪将合成的探针按预设模式点置于芯片盘内,杂交阳性探针为15 μmol/L,PCR阳性质控探针为15 μmol/L,其他探针浓度为20 μmol/L。点好探针的芯片置于紫外交联仪中照射3 min,光距为1.5 cm。紫外交联后用磷酸盐缓冲液(phosphate buffered,PBS)-0.05%Tween20漂洗3次,再用超纯水漂洗3次后晾干,密闭真空包装,4℃保存待用。
4.PCR扩增 合成引物以TE缓冲液稀释为50 μmol/L贮存液,将不同引物等体积混合。PCR扩增体系为50 μL,具体组成为10×PCR缓冲液(500 mmol/L KCl;100 mmol/L Tris-HCl(pH值9.0);1%Triton X-100;20 mmol/L MgCl2)5 μL,引物混合物溶液(50 pmol/L)10 μL,dNTP(10 mmol/L)混合物4 μL,TaqDNA聚合酶(5 U/μL)0.3 μL,模板DNA 5 μL,补充 ddH2O至50 μL。PCR反应在德国Eppendorf公司 Mastercycler gradient型梯度PCR热循环仪上进行,扩增条件为:95℃ 2 min;95℃ 30 s,60℃ 30 s,72℃ 30 s,30个循环;72℃ 2 min;4℃ 10 min。
5.微孔板芯片检测 取20 μL PCR扩增产物,在PCR仪中95℃变性5 min后立即放置冰盒3 min,与180 μL杂交缓冲液(其中加有生物素标记的与杂交质控探针序列互补的寡核苷酸DNA分子)混匀,加入微孔板芯片微孔内,盖上芯片盖后置于芯片杂交仪内,45℃振动杂交反应1 h。杂交完成后弃去杂交液,用200 μL洗涤液[2×SSPC-1%十二烷基磺酸钠]清洗3次,再于微孔内加入200 μL 1∶1000稀释的链霉亲和素-碱性磷酸酶孵育15 min,再用洗涤液清洗3次,加入稀释50倍的底物四唑硝基蓝/5-溴-4-氯-3-吲哚-磷酸避光显色5 min,弃去显色液并用超纯水洗2次,置室温干燥。裸眼观察杂交结果或置于芯片扫描仪进行图像扫描。
结 果
一、芯片检测结核分枝杆菌标准菌株
为了验证芯片检测结核分枝杆菌耐药性的性能,首先使用野生型结核分枝杆菌标准菌株基因组进行了测试,结果见图1。

图1 野生型结核分枝杆菌芯片杂交图
由图1可见,F5(IS6110)具有很强的信号响应,与我们使用的标准结核分枝杆菌相符。此外,在与耐药性突变相关的探针组中,野生型探针位点与PCR产物形成完全互补的复合物,均有较强的信号响应(A1、A4、B1、B4、B6、C4、C6、E2、E7、F2、F7),而其他携带了突变位点的探针则与PCR产物形成不完全匹配的复合物,仅有微弱甚至无信号响应,G2~G7阴性对照探针点则无信号。
二、芯片检测结核分枝杆菌耐药性
为了进一步检验芯片区分耐药突变类型的能力,分别取经药物敏感性试验测定阳性的耐药性菌株(抗利福平菌株和抗异烟肼菌株)进行测试,结果见图2。F5位点具有很强的信号响应,表明测定菌株为结核分枝杆菌菌株。E4位点及F4位点均产生了明显强于E2及F2位点的信号响应,根据探针位置分布表明:2种菌株分别为rpoB基因531位点有Ser→Trp的突变,katG 315位点有Ser→Asn的突变,而rpoB及katG基因则分别与利福平及异烟肼的耐药性紧密相关,这与应用的抗利福平菌株和抗异烟肼菌株结论一致。

图2 耐药性菌株芯片测试
三、芯片检测耐药性突变类型分析
为了进一步检验芯片检测耐药性突变类型的性能,对50株异烟肼耐药菌株及20株利福平耐药菌株进行了测定,结果见图3。在50株异烟肼耐药突变株中,有43个耐药突变菌株与katG基因315位的突变有关,占86%,其中本项目检出40株(80%),其他3株为katG其他突变类型,本项目中未涉及相应探针,经测序验证主要为328位和335位突变。其他14%的异烟肼耐药突变发生在katG基因以外,本项目中未检出。20株利福平耐药突变株中,有15株(75%)突变与rpoB基因有关,其中以531、526位突变居多,分别有7株(占rpoB基因突变的47%)、3株(占rpoB基因突变的20%),另有25%的利福平耐药突变发生在rpoB基因以外,本项目中未涉及。

图3 芯片检测耐药菌株基因突变类型分析
讨 论
基因突变是导致结核分枝杆菌产生耐药性的主要原因,而后者又常常导致诊断滞后、不充分治疗及更高的致死性。因而,必须采取有效的确诊手段以确保所有患者接受有效的诊断,并进而接受有效的治疗。传统的药物敏感性试验往往需要增菌培养,使得结核分枝杆菌耐药性的鉴定严重滞后。基于此,快速的结核分枝杆菌耐药性的分子鉴定在结核的临床治疗过程中显得尤为重要。在现有的关于结核分枝杆菌耐药性检测方面,研究最多的是关于利福平及异烟肼耐药的研究。现有研究结果表明,结核分枝杆菌对利福平的耐药性与rpoB基因上一段81 bp区域的多态性有关,有超过95%的利福平耐药性与此区段的基因突变有关。异烟肼的耐药性较利福平而言相对复杂,除主要与katG基因有关外,还与ahpC、inhA等有关。
现有文献的调研表明,应用基因芯片进行结核分枝杆菌检测及耐药性突变基因分型鉴定已有相关报道,但耐药性的鉴定主要是进行异烟肼的耐药性鉴定,应用芯片技术同时进行结核分枝杆菌检测并对耐药性进行鉴定的报道则相对少见。此外,现有基因芯片检测耐药性突变的报道主要以荧光检测为手段,同时单张芯片的检测通量有限。
本研究建立的可视化微孔板芯片检测方法使用了台湾晶宇生物科技实业股份有限公司的微孔板芯片,该检测方法较其他芯片技术具有以下优点:(1)每个微孔即为一张芯片,提高了单张芯片的检测通量[微孔板芯片常见类型:96孔板芯片,N3 CHIP(三孔板芯片)];(2)检测结果直观可视(裸眼直接观察即可),同时可配套灰度扫描仪定量分析。此外,该检测方法大大缩短了检测时间,整个检测过程可在4 h内完成。
为了确保检测的准确性,本研究首先选择了IS6110作为鉴定结核分枝杆菌群的靶标,同时也可作为耐药性突变的杂交阳性质控。此外,选择主要的耐药性相关基因rpoB、katG及inhA和ahpC为靶标,针对高发突变位点设计探针,构建了可同时检测结核分枝杆菌并对其耐药性突变进行鉴定的基因芯片。本研究中检测的样本,凡芯片涉及的突变类型,在芯片上均取得了较好的检测效果,芯片确定的突变类型经与测序比对结论一致,未检出的耐药突变经测序表明,其突变类型在本研究中未涉及。
综上所述,本研究建立了一种新的针对结核分枝杆菌及其耐药性检测的可视化微孔板芯片检测方法,该方法可快速、准确、方便的检测结核分枝杆菌并同时鉴定其耐药性。该技术在通关口岸、疾病控制及卫生检疫部门检测中将具有一定的应用价值。
[1]Parsons LM,Somoskövi A,Urbanczik R,et al.Laboratory diagnostic aspects of drug resistant tuberculosis[J].Front Biosci,2004,9:2086-2105.
[2]姚春艳,张立群,府伟灵.应用基因芯片技术检测结核分枝杆菌耐药基因[J].中华医院感染学杂志,2010,20(11):1501-1504.
[3]李 锋,李凫坚,陈园园,等.应用基因芯片快速检测结核分枝杆菌利福平耐药基因的研究[J].中国防痨杂志,2011,33(3):188-189.
[4]刘 申,刘智勇,黄 庆,等.基因芯片检测系统在分枝杆菌属鉴定及耐药性分析的临床应用[J].中华医院感染学杂志,2011,21(10):1959-1962.
[5]Gryadunov D,Mikhailovich V,Lapa S,et al.Evaluation of hybridisation on oligonucleotide microarrays for analysis of drug-resistant Mycobacterium tuberculosis[J].Clin Microbiol Infect,2005,11(7):531-539.
[6]Caoili JC,Mayorova A,Sikes D,et al.Evaluation of the TB-Biochip oligonucleotide microarray system for rapid detection of rifampin resistance in Mycobacterium tuberculosis[J].J Clin Microbiol,2006,44(7):2378-2381.
[7]Yao C,Zhu T,Li Y,et al.Detection of rpoB,katG and inhA gene mutations in Mycobacterium tuberculosis clinical isolates from Chongqing as determined by microarray[J].Clin Microbiol Infect,2010,16(11):1639-1643.