红斑丹毒丝菌C43065株spaA基因的克隆和表达*
刘丹丹,杨振龙,吾鲁木汗·那孜尔别克
(吉首大学生物资源与环境科学学院,湖南吉首 416000)
红斑丹毒丝菌C43065株spaA基因的克隆和表达*
刘丹丹,杨振龙,吾鲁木汗·那孜尔别克
(吉首大学生物资源与环境科学学院,湖南吉首 416000)
通过PCR从红斑丹毒丝菌C43065株基因组DNA中扩增出编码信号肽除外的成熟SpaA蛋白基因spaA,将其克隆到表达载体pET32a的BamHⅠ和HindⅢ位点上,构建重组表达质粒pET-spaA,转化大肠杆菌BL21,在IPTG诱导下表达N端带有Trx标签的融合蛋白rSpaA,SDS-PAGE检测表达蛋白.DNA测序结果表明,spaA基因大小为1794bp,编码由597个氨基酸残基组成的成熟SpaA蛋白,SDS-PAGE结果显示在大肠杆菌BL21中成功表达了分子量约为86kDa的重组rSpaA,为进一步开展SpaA保护区域的研究奠定基础.
红斑丹毒丝菌;spaA基因;克隆;原核表达
猪丹毒是一种由猪的血清型1和2红斑丹毒丝菌(Erysipelothrix rhusiopathiae)引起的接触性传染病,对养猪业造成严重的经济损失[1].目前,预防猪丹毒的灭活疫苗和弱毒疫苗只能预防特急性、急性和风疹性疾病,而无法预防本菌引起的慢性疾病,且在疫苗应用中仍有疫情再次爆发,至今世界各地尚未彻底消灭本病[2-3].因此,研究红斑丹毒丝菌菌体表面蛋白的免疫功能,为猪丹毒的免疫预防可提供理论依据.
Kitajima等[4]用血清型2红斑丹毒丝菌菌体表面蛋白研制疫苗,保护试验结果显示,该蛋白疫苗能保护SPF猪受同源菌株和异源菌株的致死性感染,并推测64~67ku的菌体表面蛋白可能具有保护作用.Makino等[5]用单抗从血清型2红斑丹毒丝菌基因组文库中克隆出编码64ku表面保护性抗原A(surface protective antigen A,SpaA)的基因,用大肠杆菌表达系统分别表达重组rSpaA和缺失C端160个氨基酸残基的ΔSpaA,并检测它们对小鼠的保护作用,结果表明,rSpaA的保护作用与其C端的160个氨基酸序列有关.但Imada等[6]的研究表明,SpaA的保护作用与其N端342个氨基酸序列(SpaA-N)有关.吾鲁木汗等[7]用PCR从血清型2红斑丹毒丝菌基因组中克隆出spaA-N基因序列并进行原核表达,保护试验结果显示,rSpaA-N免疫组小鼠对强毒株C43065攻毒的保护率为100%.
上述研究结果表明,SpaA是红斑丹毒丝菌的保护性抗原,但是其C端重复序列的保护作用尚未清楚.笔者采用PCR从强毒株C43065基因组中克隆出编码信号肽除外的成熟SpaA的基因,并对spaA基因进行原核表达.
1 材料和方法
1.1 材料
红斑丹毒丝菌C43065株购自中国兽医菌种保藏管理中心;大肠杆菌DH5α和BL21购自大连宝生物工程有限公司;原核表达载体pET32a由本实验室保存;Ex TaqDNA聚合酶、dNTPs、限制性核酸内切酶、DNA连接试剂盒、质粒DNA提取试剂盒、胶回收试剂盒、DL2000DNA marker、λ-HindⅢdigest DNAmarker、protein marker均为大连宝生物工程有限公司产品;IPTG为Promega公司产品;BHI(Brain Heart Infusion)液体培养基和BHI(Brain Heart Infusion Agar)固体培养基均为Difco公司产品.
1.2 方法
1.2.1 红斑丹毒丝菌C43065株基因组DNA的提取 BHI固体培养上划线接种C43065菌株,将单菌落接种于含有质量分数为0.1%Tween-80的BHI(BHI-T)液体培养基中,37℃静置培养18h,采用CTAB法制备基因组DNA.
1.2.2 spaA基因的PCR扩增和重组表达载体的构建 根据C43065株spaA基因的核苷酸序列(登录号为:EF688017)设计引物P1(5′-CGCGGATCCGATTCGACAGATATTTC-3′)和P2(5′-CGCAAGCTTCTATTTTAAACTTCCATC-3′),分别插入BamHⅠ和HindⅢ酶切位点(下划线部分),引物由大连宝生物工程有限责任公司合成.PCR反应体系为50μL,反应条件(温度/时间)为:94℃/5min;94℃/30s,55℃/1min,72℃/1.8min;35个循环;最后72℃延伸10min.采用质量分数为1%琼脂糖凝胶电泳检测PCR产物,采用BamHⅠ和HindⅢ双酶切PCR产物和载体pET32a并分别进行切胶回收,用DNA连接试剂盒将回收得到的DNA片段和构建重组表达质粒pET-spaA,转化大肠杆菌DH5α感受态细胞,经含氨苄青霉素的LB固体培养基筛选阳性克隆,用菌液PCR、BamHⅠ和HindⅢ酶切鉴定重组子,通过DNA测序验证阅读框是否正确及有无突变.
1.2.3 重组蛋白rSpaA的表达及检测 经DNA测序证明无误后,将重组质粒pET-spaA转化大肠杆菌BL21,挑取单菌落接种于5mL的LB培养基(含质量浓度为100μg/mL的氨苄青霉素)中,37℃摇床培养6h.分别取0.5mL菌液,接种到2份20mL新鲜的LB培养基(含质量浓度为100μg/mL的氨苄青霉素)中,37℃摇床培养,待菌液的OD600值到达0.6时,在其中一份菌液加入IPTG(浓度为0.2mmol/L),30℃继续培养4h.取1mL菌液,8000r/min离心2min弃上清收集菌体,菌体用PBS溶液洗涤2次,取50 μL菌液后加等体积2×SDS-PAGE上样缓冲液100℃煮沸10min.采用4%浓缩胶和12.5%分离胶的SDS-PAGE检测表达蛋白.为了检测表达蛋白的表达形式,将诱导后的菌体悬浮于20mL的PBS溶液中,反复冻融3次后,用超声波破碎仪破碎菌体(超声条件:超声5s间隔6s,共15min),离心收集上清和沉淀,通过SDS-PAGE检测目的蛋白在大肠杆菌BL21中的表达情况.
2 实验结果
2.1 红斑丹毒丝菌C43065株基因组DNA的制备
采用CTAB法提取C43065株基因组DNA后,用质量分数为0.6%的琼脂糖凝胶电泳检测基因组DNA.结果显示C43065株基因组DNA大小约为23kb左右(见图1),与已报道的红斑毒丝菌基因组大小一致.
2.2 红斑丹毒丝菌C43065株spaA基因的PCR扩增
用spaA基因的特异性引物经PCR从红斑丹毒丝菌C43065株基因组DNA中扩增出大小约为1.7kb的片段(见图2),与预期值相符.

1 红斑丹毒丝菌C43065株基因组DNA的琼脂糖电泳检测

图2 红斑丹毒丝菌C43065株spaA基因的PCR扩增
2.3 重组表达质粒pET-spaA的构建和鉴定
将上述扩增的PCR产物和pET32a载体分别用BamHⅠ和HindⅢ双酶切,纯化后用DNA连接试剂盒进行连接并构建重组表达质粒pET-spaA.通过PCR检测在重组质粒pET-spaA中的插入DNA片段大小,琼脂糖电泳检测结果显示PCR产物大小为1.7kb(见图3-a),重组质粒pET-spaA经BamHⅠ和HindⅢ酶切后获得1条1.8kb的插入片段(见图3-b),而DNA测序结果表明重组质粒含有1794bp的插入片段,其编码信号肽除外的597个氨基酸的成熟SpaA蛋白.
2.4 表达蛋白的SDS-PAGE检测
SDS-PAGE检测结果表明,与对照即空载体pET32a转化的大肠杆菌BL21相比,pET-spaA转化的大肠杆菌BL21在86ku位置出现表达量较高的蛋白条带(见图4泳道3),与预期的融合蛋白Trx-SpaA分子量相符.表达后的菌体经反复冻融和超声波破碎后,分别取上清液和沉淀进行SDS-PAGE分析,结果表明重组rSpaA蛋白以可溶蛋白的形式存在于上清中(见图4泳道4).
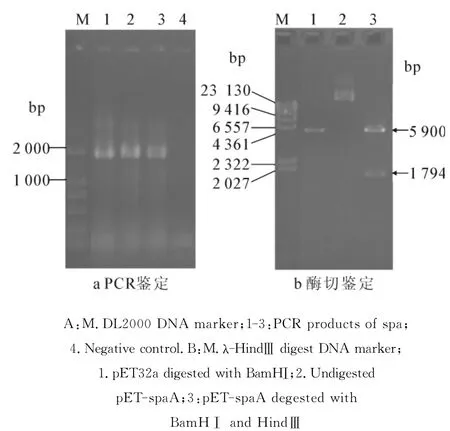
图3 重组质粒pET-spaA的PCR(a)和酶切(b)鉴定

图4 重组蛋白rSpaA的表达及其可溶性分析
3 讨论
(1)采用PCR从血清型2红斑丹毒丝菌C43311基因组中克隆编码SpaA-N的基因片段,用原核表达系统表达rSpaA-N并检测其保护作用,实验结果表明,重组rSpaA-N完全保护小鼠受强毒株C43065的致死性感染[7].Makino等[8]的研究表明,SpaA的结构及其C端重复序列和肺炎链球菌胆碱结合蛋白之间有很高的同源性,而SpaA通过其C端重复序列能够与枯草芽孢杆菌和肺炎链球菌等革兰氏阳性菌细胞壁的脂磷壁酸(LTA)结合,提示LTA-SpaA复合物可能在红斑丹毒丝菌致病过程中发挥一定的作用.文献[7-8]研究结果可知:SpaA是红斑丹毒丝菌的主要保护性抗原,可作为猪丹毒亚单位疫苗的候选抗原,但是SpaA蛋白C端重复序列的保护作用和致病作用尚未清楚.
(2)经PCR从红斑丹毒丝菌C43065基因组中克隆出编码SpaA蛋白的spaA基因,将其克隆至表达载体pET32a的多克隆位点上,转化大肠杆菌DH5α感受态,通过PCR筛选重组菌后提取其质粒DNA,DNA测序结果表明,spaA基因大小为1794bp,编码597个氨基酸残基的成熟SpaA蛋白,与已报道的C43065株和C43311株的spaA基因序列完全相同.[9-10]将重组质粒pET-spaA导入大肠杆菌BL21感受态后,通过IPTG诱导表达目的蛋白,SDS-PAGE结果显示在重组菌pET-spaA/BL21的超声波破碎液中观察到分子量约为86ku的蛋白条带,与预期值相符,为进一步开展SpaA蛋白保护区域及其致病机理的研究奠定基础.
[1] TAKAHASHI T,FUJISAWA T,TAMURA Y,et al.DNA Relatedness Among Erysipelothrix Rhusiopathiae Strains Representing All Twenty-Three Serovars and Erysipelothrix Tonsillarum[J].Int.J.Syst.Bacteriol,1992,42(3):469-473.
[2] FTHENAKIS G,CHRISTODOULOPOULOS G,LEONTIDES L,et al.Abortion In Ewes Associated with Erysipelothrix Rhusiopathiae[J].Small Ruminant Research,2006,63(1-2):183-188.
[3] EAMENS G,CHIN J,TURNER B,et al.Evaluation of Erysipelothrix Rhusiopathiae Vaccines in Pigs by Intradermal Challenge and Immune Responses[J].Vet.Microbiol,2006,116(1-3):138-148.
[4] KITAJIMA T,OISHI E,AMIMOTO K,et al.Protective Effect of NaOH-Extracted Erysipelothrix Rhusiopathiae Vaccine in Pigs[J].J.Vet.Med.Sci.,1997,60(1):9-14.
[5] MAKINO S,YAMAMOTO K,MURAKAMI S,et al.Properties of Repeat Domain Found in a Novel Protective Antigen,SpaA,of Erysipelothrix Rhusiopathiae[J].Microb.Pathog,1998,25(2):101-109.
[6] IMADA Y,GOJI N,ISHIKAWA H,et al.Truncated Surface Protective Antigen(SpaA)of Erysipelothrix Rhusiopathiae Serotype 1aElicits Protection Against Challenge with Serotypes 1aand 2bin Pigs[J].Infect Immun.,1999,67(9):4 376-4 382.
[7] 吾鲁木汗·那孜尔别克,张 磊,何 翠,等.猪丹毒丝菌天然SpaA和重组SpaA-N免疫保护效果的评价[J].微生物学报,2010,50(3):367-372.
[8] MAKINO SI,YAMAMOTO K,ASAKURA H,et al.Surface Antigen,SpaA,of Erysipelothrix Rhusiopathiae Binds to Gram-Positive Bacterial Cell Surfaces[J].FEMS Microbiol Lett,2000,186(2):313-317.
[9] 吾鲁木汗·那孜尔别克,张 磊,何 翠,等.猪丹毒丝菌C43065株表面保护性抗原AN端保护区在大肠杆菌中的表达[J].生物技术通讯,2008,19(4):548-551.
[10] 吾鲁木汗·那孜尔别克,刘祝祥,李 科,等.猪丹毒丝菌C43311株spaA基因N端免疫保护区的克隆和表达[J].微生物学报,2008,48(2):207-212.
(责任编辑 易必武)
Cloning and Expression of spaA Gene of Erysipelothrix Rhusiopathiae C43065
LIU Dan-dan,YANG Zhen-long,NAZIERBIEKE Wulumuhan
(College of Biology and Environmental Sciences,Jishou University,Jishou 416000,China)
The spaA gene encoding mature surface protective antigen A(SpaA)without signal peptide was amplified from genomic DNA of E.rhusiopathiae C43065by PCR,The BamHⅠand HindⅢdigested PCR product was cloned into prokaryotic expression vector pET32ato generate a recombinant plasmid pET-spaA.The recombinant protein rSpaA was expressed in E.coli BL21harboring the recombinant plasmid pET-spaA by IPTG inducing,and the expressed protein was determined by SDS-PAGE.The DNA sequence analysis showed that the spaA gene of C43065strain was 1794bp in length.SDS-PAGE analysis revealed a single protein band with a molecular weight of 86kDa successfully expressed in E.coli BL21.The expressed protein of rSpaA will contribute to further study on protective domain of this protein.
Erysipelothrix rhusiopathiae;spaA gene;cloning;prokaryotic expression
S588.28
A
10.3969/j.issn.1007-2985.2013.05.021
1007-2985(2013)05-0085-04
2013-06-09
国家自然科学基金资助项目(31072142)
刘丹丹(1987-),女,湖南邵东人,吉首大学生物资源与环境科学学院硕士研究生,主要从事微生物生态学研究
吾鲁木汗·那孜尔别克,吉首大学生物资源与环境科学学院教授,博士,从事畜禽传染病免疫预防,E-mail:ulum@jsu.edu.cn.

